| |
| Med Sci (Paris). 2007 August; 23(8-9): 687–689. Published online 2007 August 15. doi: 10.1051/medsci/20072389687.L’enzyme de la glycolyse GAPDH joue un double rôle dans la neurotransmission GABAergique et l’épilepsie humaine Jacques Laschet* and René Pumain Laboratoire de Neurobiologie et Pharmacologie Moléculaire, Inserm U573, Centre Paul Broca, 2ter rue d’Alésia, F75014 Paris, France MeSH keywords: Épilepsie, Glyceraldehyde 3-phosphate dehydrogenases, Glycolyse, Humains, Phosphorylation, Récepteurs GABA-A, Transmission synaptique, Acide gamma-amino-butyrique |
De nombreux systèmes de neurotransmission sont modulés par des phosphorylations de récepteurs synaptiques dans le système nerveux central (SNC) des vertébrés. Il a été en particulier établi que les récepteurs ionotropes au glutamate et au GABA peuvent être phosphorylés sur les boucles intracellulaires de plusieurs des sous-unités qui les composent par des kinases comme la PKA, PKC, PKG, CAMKII, et PTK. Ces mécanismes de phosphorylations sont impliqués dans la stabilité des récepteurs à la membrane plasmique et peuvent jouer un rôle essentiel dans la désensibilisation, l’agrégation, l’internalisation, le recyclage ou la dégradation de ces entités protéiques (pour revue, voir [
1]). En ce qui concerne le récepteur de type A au GABA (GABAAR), qui est composé de cinq sous-unités dont les plus fréquentes sont les α, β, et γ, ces kinases classiques phosphorylent essentiellement les sous-unités β ou γdu GABAAR, mais pas les sous-unités α. Un mécanisme différent de phosphorylation a été décrit pour ce récepteur, mécanisme qualifié d’endogène car ne nécessitant l’addition ni de kinase ni d’activateurs de kinase [
2,
3]. La kinase endogène doit donc être étroitement liée au récepteur au niveau de la membrane neuronale. Ce mécanisme de phosphorylation prévient le rundown ou « incapacitation »1 de la réponse GABAergique des neurones hippocampiques ou corticaux dissociés de façon aiguë [
4]. Les caractéristiques de ce mécanisme vont être décrites, ainsi que son altération dans les structures nerveuses à l’origine des crises d’épilepsie. |
Un nouveau mécanisme : la modulation glycolyse-dépendante de l’inhibition Le premier point essentiel était d’identifier la kinase endogène du GABAAR. À notre grande surprise, la protéine ciblée après purification du récepteur et essais de phosphorylation ne faisait pas partie des kinases connues, mais correspondait à une enzyme clé de la glycolyse, la glycéraldéhyde-3-phosphate déshydrogénase (GAPDH) [
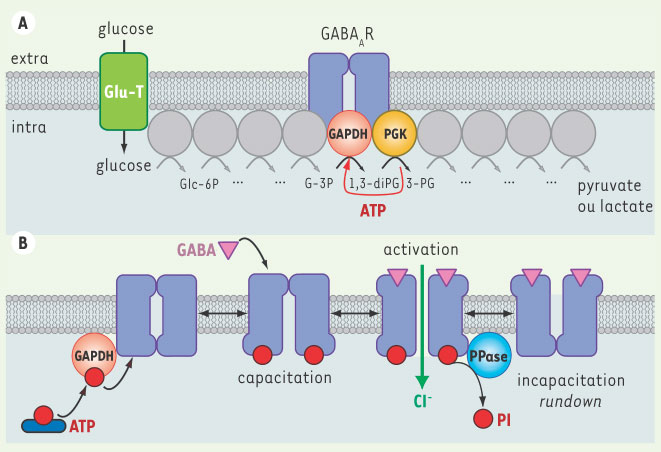
5]. Un examen attentif de la littérature a alors révélé que le rôle de kinase de la GAPDH, indépendamment de son rôle de déshydrogénase dans la glycolyse, avait été mis en évidence dans des muscles de lapin. Il avait été montré que la GAPDH utilise l’ATP glycolytique pour s’autophosphoryler et transférer ensuite le radical phosphate sur d’autres protéines du muscle, qui, à l’époque, n’avaient pas été identifiées [5]. Nous avons ensuite montré que la GAPDH est physiquement associée au récepteur et est partiellement co-localisée avec la sous-unité α1 à la membrane plasmique de neurones en culture. Nous avons également montré qu’une synthèse locale d’ATP se produisait dans des membranes lavées de cortex cérébral en présence de glycéraldéhyde-3P, le substrat glycolytique spécifique de la GAPDH. Ce résultat indique que l’enzyme qui suit la GAPDH dans la chaîne des réactions glycolytiques, la phosphoglycérate kinase, est aussi présente à la membrane neuronale sans être associée directement au récepteur, et qu’elle utilise le produit de la réaction catalysée par la GAPDH pour produire les molécules d’ATP glycolytique, probablement sans diffusion dans le milieu cytosolique. L’ATP est ensuite rétrocédé à la GAPDH qui va s’autophosphoryler, toujours probablement sans diffusion. La phospho-GAPDH phosphoryle ensuite le GABAAR auquel elle est liée sur la boucle intracellulaire I2 de sa sous-unité α1. La phosphorylation endogène du GABAAR est donc un mécanisme dépendant de la glycolyse (Figure 1A).  | Figure 1.
Modulation directe de l’inhibition GABAergique par la glycolyse. Le maintien de l’état fonctionnel du GABAAR est assuré par une kinase associée au récepteur, que nous avons identifiée comme la glycéraldéhyde-3P déshydrogénase (GAPDH), une enzyme de la glycolyse. Elle y joue successivement deux rôles. A. Rôle glycolytique de la GAPDH. Dès que le glucose extracellulaire est transporté dans le neurone, ce glucide entre immédiatement dans la voie glycolytique dont les enzymes peuvent s’associer en chaîne pour plus d’efficacité. Une production d’ATP glycolytique s’effectue à la membrane à l’étape catalysée par la phosphoglycérate kinase (PGK). Cet ATP sera rétrocédé à la GAPDH qui va alors pouvoir jouer son rôle supplémentaire de kinase du GABAAR. B. Rôle de kinase endogène de la GAPDH. La GAPDH utilise l’ATP glycolytique pour s’autophosphoryler. La phospho-enzyme transfère ensuite deux phosphates à la boucle intracytoplasmique de la sous-unité α1 du GABAAR sur une thréonine et une sérine. Cela entraîne la capacitation du récepteur : le canal associé pourra alors - et alors seulement - s’ouvrir lors de la liaison du GABA sur son site extracellulaire. Enfin, une phosphatase membranaire atypique (PPase) contrecarre ce mécanisme en déphosphorylant le récepteur, ce qui conduit à une incapacitation et au rundown de la réponse GABAergique. Le maintien de l’inhibition rapide dépend donc étroitement de la consommation de glucose. Glu-T : transporteur du glucose ; Glc-6P : glucose-6P ; G-3P : glycéraldéhyde-3P, 1,3-diPG : 1,3-diphosphoglycérate ; 3-PG : 3-phosphoglycérate. |
La phosphorylation endogène a-t-elle un rôle fonctionnel ? Nous avons montré, sur des neurones pyramidaux isolés du cortex de rat, que toute manipulation favorisant la phosphorylation endogène diminue l’incapacitation des courants GABAA enregistrés en patch-clamp, et à l’inverse, que tout ce qui prévient la phosphorylation endogène du GABAAR la renforce [
6]. Ainsi l’ajout de glycéraldéhyde-3P au milieu intracellulaire maintient les réponses GABAergiques au cours du temps, mais un ajout ultérieur d’iodoacétamide, qui inactive la GAPDH, induit une incapacitation de ces réponses aussi importante qu’en l’absence de ce substrat. L’ATP endogène produit à la membrane par la glycolyse est très largement préféré à l’ATP exogène présent dans la solution de la pipette de patch.
Par ailleurs, il existe une phosphatase membranaire atypique qui déphosphoryle la sous-unité α1 et contrecarre la phosphorylation endogène [
7]. L’ajout de certains inhibiteurs de phosphatase au milieu intracellulaire prévient l’incapacitation des réponses GABAergiques en maintenant le récepteur dans son état phosphorylé. Nous proposons que la phosphorylation glycolyse-dépendante maintient les courants GABAA par « capacitation » du récepteur, et que la phosphatase membranaire atypique, en contrecarrant la phosphorylation endogène, est à l’origine du rundown des courants GABAergiques par « incapacitation » du récepteur (Figure 1B).
|
Déficience de la phosphorylation endogène du GABA A-R dans l’épilepsie humaine De nombreux travaux ont fortement suggéré qu’un déficit de la neurotransmission inhibitrice GABAergique pouvait être à l’origine des crises chez des patients épileptiques. Cependant, nos propres travaux, et ceux de plusieurs autres équipes, avaient montré que l’inhibition GABAergique était fonctionnelle dans le tissu cortical prélevé pour des raisons strictement thérapeutiques dans des zones à l’origine des crises chez ces patients. Existait-il donc un mécanisme pouvant diminuer de façon rapide et transitoire l’efficacité de la neurotransmission inhibitrice chez ces patients ? Un mécanisme impliquant des phosphorylations pouvait présenter ces caractéristiques. Nous avons émis l’hypothèse d’une altération de la phosphorylation endogène du GABAAR dans du tissu épileptogène humain provenant de pièces de cortectomie de patients souffrant d’épilepsie partielle pharmacorésistante. En effet, pour certains de ces patients, l’exérèse chirurgicale de la zone corticale à l’origine des crises est la seule thérapeutique efficace. Dans quelques rares cas, nous avons pu obtenir du tissu cortical témoin provenant de l’exérèse de tumeurs intraparenchymateuses ou de méningiomes chez des patients ne présentant pas d’épilepsie. Les résultats obtenus sont clairs et concordants [
8]. Sur des préparations de membranes corticales lavées, la phosphorylation du GABAAR par la GAPDH est significativement réduite dans le tissu épileptogène par rapport au tissu contrôle. Cette altération ne résulte pas d’une diminution de l’expression de la sous-unité α1, mais reflète un déficit intrinsèque de la phosphorylation endogène. Les réponses GABAergiques présentaient un rundown significativement plus rapide et plus ample lorsque les enregistrements étaient réalisés sur des neurones corticaux isolés de tissu épileptogène par rapport aux réponses de neurones isolés de tissu témoin. Par ailleurs, ce rundown observé dans le tissu épileptogène pouvait être largement réduit, soit en ajoutant le substrat glycolytique de la GAPDH, soit en inhibant la phosphatase membranaire. Le déficit de la phosphorylation endogène du GABAAR induit donc une labilité fonctionnelle des courants GABAergiques. Nous proposons que chez le patient épileptique, toute augmentation fortuite de la demande métabolique puisse induire une diminution transitoire de l’efficacité de la neurotransmission inhibitrice du fait de la moindre efficacité de la phosphorylation glycolyse-dépendante et faire « basculer » la zone corticale pathologique concernée dans un fonctionnement « épileptique ». Ces résultats sont à rapprocher d’un fait constant observé chez les patients atteints d’épilepsie partielle. La mesure chez ces patients du métabolisme cérébral du glucose par imagerie de tomographie d’émission de positons (TEP), a montré que, dans les périodes intercritiques, le foyer épileptique et les zones corticales limitrophes étaient dans un état d’hypométabolisme, c’est-à-dire de moindre utilisation du glucose [
9], de l’ordre de 10 % à 15 %. La relation entre cette altération métabolique et la pathologie épileptique n’avait jamais été établie de façon claire. Nous proposons que la déficience de la modulation glycolyse-dépendante de l’inhibition GABAergique puisse au moins partiellement rendre compte de l’hypométabolisme intercritique du glucose. En effet, d’autres équipes ont montré que l’activation des synapses GABAergiques avait un coût énergétique non négligeable. La diminution de l’efficacité de la phosphorylation endogène des GABAAR que nous avons mise en évidence dans le tissu épileptogène devrait diminuer ce coût énergétique et donc la consommation de glucose. À l’appui de cette hypothèse, l’on peut citer le fait que l’administration d’un agoniste GABAA augmente le métabolisme du glucose chez le volontaire sain et chez le patient épileptique (en particulier au niveau des zones corticales à l’origine des crises) avec une amplitude du même ordre que celle de l’hypométabolisme [
10,
11]. Cette idée va à l’encontre de l’opinion souvent avancée selon laquelle une augmentation de l’efficacité de l’inhibition GABAergique produit un hypométabolisme du glucose par simple diminution de l’activité électrique des neurones. |
Conclusions et perspectives La phosphorylation glycolyse-dépendante du récepteur principal de l’inhibition GABAergique que nous avons mise en évidence est déficiente dans le tissu nerveux de patients souffrant d’épilepsies pharmacorésistantes. Cette observation permet d’établir un lien entre l’hypométabolisme intercritique observé chez ces patients et la pathologie épileptique. Cette observation ouvre également une perspective nouvelle et prometteuse pour le développement de molécules anti-épileptiques actives dans les épilepsies pharmacorésistantes, dont souffrent près de 25 % des patients épileptiques. |
Footnotes |
1. Smart, TG, Thomas P, Brandon NJ, Moss SJ. Heterologous regulation of GABAA receptors: protein phosphorylation. In : Pharmacology of GABA and glycine neurotransmission. Berlin : Springer-Verlag, 2001 : 195–225. 2. Sweetnam PM, Lloyd J, Gallombardo P, et al. Phosphorylation of the GABAa/benzodiazepine receptor alpha subunit by a receptor-associated protein kinase. J Neurochem 1988; 51 : 1274–84. 3. Bureau, MH, Laschet JJ. Endogenous phosphorylation of distinct gamma-aminobutyric acid type A receptor polypeptides by Ser/Thr and Tyr kinase activities associated with the purified receptor. J Biol Chem 1995; 270 : 26482–7. 4. Stelzer A, Kay AR, Wong RKS. GABAA-receptor function in hippocampal cells is maintained by phosphorylation factors. Science 1988; 241 : 339–41. 5. Kawamoto RM, Caswell AH. Autophosphorylation of glyceraldehydephosphate dehydrogenase and phosphorylation of protein from skeletal muscle microsomes. Biochemistry 1986; 25 : 657–61. 6. Laschet JJ, Minier F, Kurcewicz I, et al. Glyceraldehyde-3-phosphate dehydrogenase is a GABAA receptor kinase linking glycolysis to neuronal inhibition. J Neurosci 2004; 24 : 7614–22. 7. Minier F, Laschet JJ, Evrard B, Bureau MH. Endogenous phosphorylation of the GABAA receptor protein is counteracted by a membrane-associated phosphatase. Neurochem Int 2000; 36 : 499–506. 8. Laschet JJ, Kurcewicz I, Minier F, et al. Dysfunction of GABAA receptor glycolysis-dependent modulation in human partial epilepsy. Proc Natl Acad Sci USA 2007; 104 : 3472–7. 9. Ryvlin P, Bouvard S, Le Bars D, et al. Clinical utility of flumazenil-PET versus [18F]fluorodeoxyglucose-PET and MRI in refractory partial epilepsy. A prospective study in 100 patients. Brain 1998; 121 : 2067–81. 10. Peyron R, Le Bars D, Cinotti L, et al. Effects of GABAA receptors activation on brain glucose metabolism in normal subjects and temporal lobe epilepsy (TLE) patients. A positron emission tomography (PET) study. Part I: brain glucose metabolism is increased after GABAA receptors activation. Epilepsy Res 1994; 19 : 45–54. 11. Peyron R, Cinotti L, Le Bars D, et al. Effects of GABAA receptors activation on brain glucose metabolism in normal subjects and temporal lobe epilepsy (TLE) patients. A positron emission tomography (PET) study. Part II: the focal hypometabolism is reactive to GABAA agonist administration in TLE. Epilepsy Res 1994; 19 : 55–62. |