| |
| Med Sci (Paris). 2008 January; 24(1): 9–11. Published online 2008 January 15. doi: 10.1051/medsci/20082419.La zone sous-ventriculaire du cerveau adulte Une mosaïque de cellules souches pré-destinées Aurélie Mouret,1 Pierre-Marie Lledo,1* and Laure Coulombel2* 1Laboratoire de perception et mémoire, CNRS URA 2182, Département de neuroscience, Institut Pasteur, 25, rue du Docteur Roux, 75015 Paris, France 2Inserm U602 et Médecine/Sciences, Inserm ADR Paris V, 2, rue d’Alésia, 75014 Paris, France MeSH keywords: Adulte, Humains, Ventricules latéraux, Neurones |
Hétérogénéité des cellules souches de la zone sous-ventriculaire Chez le rongeur adulte, plusieurs milliers de neurones destinés au bulbe olfactif (BO) sont produits chaque jour à partir de cellules souches (CS) de la zone sous-ventriculaire (ZSV) du cerveau [
1]. Ces cellules souches, qui, chez l’adulte, se divisent toutes les trois semaines, donnent naissance à une population de progéniteurs aux divisions cellulaires rapides (toutes les 17 heures). Ces mêmes cellules produisent des neuroblastes qui prolifèrent activement tout en migrant vers le bulbe olfactif, leur destination finale, où ils se différencient en de multiples sous-populations d’interneurones. On distingue ainsi les interneurones périglomérulaires (qui contrôlent les entrées sensorielles du bulbe olfactif) et les cellules granulaires (qui contrôlent l’information sensorielle sortant du BO). Dans la couche glomérulaire du bulbe olfactif, trois populations de cellules périglomérulaires sont reconnaissables par l’expression de marqueurs spécifiques, comme la tyrosine hydroxylase (TH), la calrétinine (Crt), ou la calbindine (Cb) [
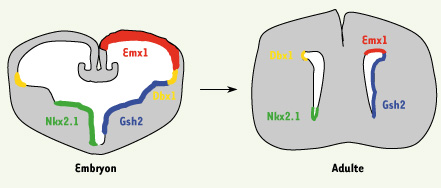
2]. Comme dans le cas du néo-cortex, une des questions fondamentales qui se posent actuellement est celle de la diversification des interneurones bulbaires. Chacune des CS de la ZSV adulte est-elle investie d’une capacité identique d’engendrer la diversité des interneurones bulbaires ? La spécification interviendrait plus tard, lors de la migration ou durant l’incorporation des néo-neurones dans le circuit bulbaire. Ou bien, au contraire, peut-on distinguer, au sein de la ZSV, des sous-populations de CS déjà spécialisées. Un débat qui n’est pas sans nous rappeler la querelle entre Aristote et Platon au sujet de l’inné et de l’acquis ! Si l’origine des différents sous-types d’interneurones bulbaires dépend de propriétés particulières des CS, quand et comment s’établit cette spécialisation ? Rappelons que les CS de la ZSV sont des astrocytes exprimant, entre autres, la GFAP (glial fibrillar acidic protein). Au cours de l’embryogenèse, ces astrocytes sont issus de progéniteurs neuroépithéliaux qui ont une morphologie et des marqueurs caractéristiques de la glie radiaire (le long de laquelle migrent les neurones). Mais, déjà à cette période, toutes les CS ne sont pas identiques. L’expression de certains facteurs de transcription, limitée à des régions spécifiques, suggère une possible régulation de la neurogenèse de la ZSV adulte. Ainsi, l’expression de Nkx2.1 est restreinte à l’éminence ganglionnaire médiane (MGE), Gsh2 à l’éminence latérale et médiane (LGE et MGE) et Emx1 au pallium (futur cortex cérébral). Le facteur de transcription à homéodomaine Dbx1 est quant à lui exprimé dans une région restreinte aux frontières entre le pallium et le sous-pallium (Figure 1). Des expériences antérieures de marquage de la glie radiaire ont montré que le striatum embryonnaire LGE était la source d’une majorité des CS de la ZSV [
3], sans exclure une contribution de la MGE et du cortex cérébral à cette population de CS chez l’adulte. Compte tenu de cette forte restriction régionale des facteurs de transcription pro-neuronaux chez l’embryon, on peut légitimement se demander si de telles contraintes sont à l’œuvre chez l’adulte. L’éventuelle hétérogénéité du potentiel des CS de la ZSV adulte pourrait ainsi refléter la pérennisation d’une spécificité régionale acquise au cours du développement.  | Figure 1.
Domaines d’expression de certains facteurs de transcription des cellules souches du cerveau embryonnaire et du cerveau adulte murin. Les différents domaines embryonnaires neuroépithéliaux ciblés grâce aux différentes souris Cre de l’équipe de Richardson ainsi que leur contribution relative à la formation de la ZSV adulte ont été représentés (d’après [
5]). |
|
L’origine embryonnaire des CS de la ZSV détermine leur destin neuronal dans le bulbe olfactif Cette hypothèse a récemment été examinée et les résultats publiés dans deux articles récents, l’un dans Science, l’autre dans J Neuroscience [
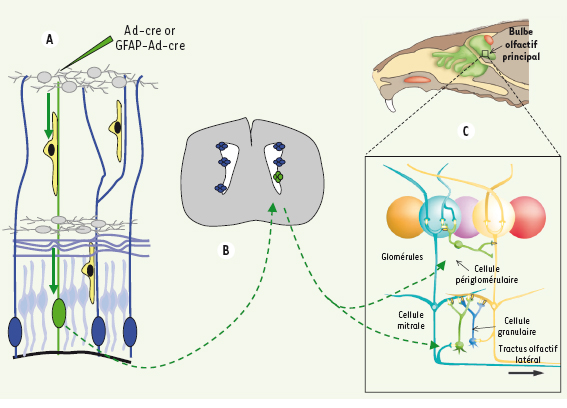
4, 5]. Si la méthodologie est différente, les conclusions sont semblables : les CS de la ZSV ne représentent pas une seule et même population au potentiel homogène, mais une myriade de sous-populations dont le destin neuronal semble arrêté. Les deux équipes ont analysé l’origine des interneurones du bulbe olfactif par deux approches différentes de marquage cellulaire : l’équipe de Richardson [5] a utilisé des souris transgéniques Cre-lox, la recombinase étant sous le contrôle de promoteurs spécifiques de chacune des régions du télencéphale contribuant préférentiellement à un territoire de la ZSV à l’âge adulte (Figure 1). L’analyse simultanée de l’incorporation de BrdU permet de déterminer l’activité proliférative des CS de la ZSV adulte. Deux types d’informations émergent de cette étude : (1) les CS de la ZSV à l’âge adulte proviennent en grande majorité de la LGE mais certaines aussi du cortex embryonnaire ; (2) in vitro, ces CS prolifèrent sous forme de neurosphères, elle sont capables d’auto-renouvellement et sont multipotentes, puisque qu’elles produisent des astrocytes GFAP+, des oligodendrocytes, et des neurones. En revanche, in vivo, la majorité des neurones produits dans le bulbe olfactif ont pour origine les CS issues elles-mêmes de la LGE. Toutefois, les interneurones Crt+ proviennent essentiellement du pallium, les Th+ du pallium et de la LGE, et les Cb+ uniquement de la LGE. Le destin neuronal des CS de la ZSV est donc hétérogène in vivo, et déterminé très tôt en fonction de la région d’origine, cortex (pallium) ou striatum (sous-pallium) du neuroépithélium embryonnaire. L’équipe de Arturo Alvarez-Buylla [4] (Figure 2) a marqué directement les CS d’une région très circonscrite : les chercheurs ont tiré parti de la propriété qu’ont les adénovirus (Ad), injectés par voie stéréotaxique dans les prolongements des cellules de la glie radiaire, de migrer par voie rétrograde jusqu’au corps cellulaire [3]. Des Ad-Cre vont ainsi libérer le signal GFP de cellules de la glie radiaire de souriceaux nouveau-nés GFP-lox, dans un territoire très localisé de la ZSV, permettant de définir, en examinant le bulbe olfactif, le territoire d’origine des différents neurones qui composent le bulbe.  | Figure 2.
Stratégie expérimentale d’identification des sous-populations de cellules souches de la ZSV. A. Marquage des cellules souches via l’injection par voie stéréotaxique d’un adénovirus-Cre dans les prolongements corticaux des cellules de la glie radiaire (traits verticaux vert et bleus) en période néonatale. Le transport rétrograde de l’Ad-cre jusqu’aux corps cellulaires des cellules de la glie radiaire localisés dans la ZSV et l’absence de diffusion du virus, permettent de restreindre le marquage à un territoire très précis de la ZSV (symbolisé ici par une cellule verte). L’équipe d’Alvarez-Buylla a ainsi marqué 15 territoires différents de la ZSV (symbolisés en vert en B). B. représentation schématique (coupe coronale) de la localisation des cellules souches dans la ZSV. C. L’analyse chez l’adulte de la distribution de la GFP dans les différentes populations d’interneurones du bulbe olfactif principal permet d’identifier rétrospectivement le degré de diversification neuronale des cellules souches du territoire de la ZSV qui a été marqué. |
En marquant ainsi en période néo-natale de très nombreuses régions différentes de la paroi du ventricule latéral, et en analysant leur descendance dans le bulbe, les auteurs ont montré que les différentes sous-populations d’interneurones bulbaires proviennent de régions restreintes de la ZSV, suggérant donc une spécification régionale des neuroblastes. Au passage, l’observation d’une production continue de neuroblastes GFP+ indique l’existence de CS actives, même à l’âge adulte. Pour explorer si cette spécification régionale était déjà établie en amont des neuroblastes, au stade des CS, un vecteur Ad : GFAP-Cre (marquant les CS) a été injecté comme précédemment, mais chez l’adulte. La conclusion est sans appel : la distribution de la diversité neuronale dans le bulbe olfactif se superpose à celle qui est observée lorsque l’injection est réalisée chez le nouveau-né, confirmant que les CS de la ZSV n’ont pas toutes le même potentiel neurogénique. |
Origine intrinsèque ou extrinsèque de l’hétérogénéité des CS de la ZSV ? Une telle spécialisation peut être dictée par l’environnement ou elle peut refléter une propriété intrinsèque de la cellule. Des expériences chez le souriceau nouveau-né de microdissection des régions marquées, suivies de la greffe dans une autre région des cellules de la glie radiaire ainsi isolées, démontrent que les CS gardent le potentiel de différenciation neuronal caractéristique de leur région d’origine, et n’acquièrent pas celui de la région dans laquelle elles ont été greffées [14]. Cela reste vrai même après avoir cultivé les cellules in vitro pour éliminer toute cellule contaminante de l’environnement initial. Alors même que ces CS de la ZSV produisent astrocytes, oligodendrocytes et neurones, in vivo comme in vitro (neurosphères) et justifient donc leur qualificatif de multipotentes, chacune donne cependant naissance à un seul type d’interneurone. Cette spécialisation démontre que la ZSV est faite d’une « mosaïque » de CS dont le destin neuronal est déjà fixé. Les auteurs formulent l’hypothèse selon laquelle cette dimension spatiale est intégrée par les CS/progéniteurs lors du développement du cerveau [
6], et conservée à l’âge adulte : une nouvelle preuve étayant l’hypothèse d’une récapitulation de l’embryogenèse chez l’adulte. La nature moléculaire de cette restriction du destin cellulaire (facteurs de transcription ou répresseur particulier ?) reste encore à découvrir. Certes, ces travaux résolvent une vieille controverse et illustrent une fois de plus toute l’imprécision fonctionnelle du terme « cellule souche ». Ils confirment aussi les limites du système des neurosphères puisque le destin cellulaire des progéniteurs issus de ces neurosphères dépendra de l’origine du tissu. Ainsi, en matière de thérapie cellulaire des affections neurodégénératives, ces résultats montrent que le « jeu des possibles » reste encore limité. |
1. Doetsch F, Caille I, Lim A, et al. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell 1999; 97 : 1. 2. Lledo PM, Alonso M, Grubb MS. Adult neurogenesis and functional plasticity in neuronal circuits. Nat Rev Neurosci 2006; 7 : 179–93. 3. Merkle FT, Tramontin AD, Garcia-Verdugo JM, Alvarez-Buylla A. Radial glia give rise to adult neural stem cells in the subventricular zone. Proc Natl Acad Sci USA 2004; 101 : 17528–32. 4. Merkle FT, Mirzadeh Z, Alvarez-Buylla A. Mosaic organization of neural stem cells in the adult brain. Science 2007; 317 : 381–4. 5. Young KM, Fogarty M, Kessaris N, Richardson WD. Subventricular zone stem cells are heterogeneous with respect to their embryonic origins and neurogenic fates in the adult olfactory bulb. J Neurosci 2007; 27 : 8286–96. 6. Guillemot F. Cellular and molecular control of neurogenesis in the mammalian telencephalon. Curr Opin Cell Biol 2005; 17 : 639–47. |