| |
| Med Sci (Paris). 2008 January; 24(1): 12–14. Published online 2008 January 15. doi: 10.1051/medsci/200824112.L’oncogène JUN démasqué Un nouveau rôle pour un vieil acteur Odette Mariani* and Alain Aurias* Institut Curie, Inserm U830, Génétique et Biologie des Cancers, 26, rue d’Ulm, 75248 Paris Cedex 05, France MeSH keywords: Animaux, Amplification de gène, Gènes jun, Humains, Souris, Tumeurs expérimentales, Oncogènes |
Les histiocytofibromes malins (MFH) sont les sarcomes indifférenciés des tissus mous les plus fréquents chez l’adulte de 60-70 ans. Ces sarcomes sont le plus fréquemment localisés au niveau des extémités des membres ou dans le péritoine. Plusieurs études anatomopathologiques et immunohistochimiques ont montré que ce groupe est hétérogène et composé de différents sarcomes ayant évolué vers un même état d’indifférenciation. Une étude par CGH-array a montré que 20 % de ces tumeurs étaient caractérisées par une amplification de la région chromosomique 12q15, caractéristique des liposarcomes, associée à des co-amplicons récurrents en 1p32 ou en 6q23 [
1,
2]. La présence de l’amplicon en 12q15, contenant les gènes CDK4 et MDM2, nous a amenés à penser que ces tumeurs étaient des liposarcomes indifférenciés, l’indifférenciation étant liée à la présence de l’amplicon en 1p32 ou en 6q23. |
Amplicon 1p32, oncogène JUN et blocage de la différenciation adipocytaire Une analyse approfondie de l’amplicon 1p32, à l’aide d’une puce CGH-array dédiée, nous a permis de définir une région minimale commune d’amplification ne contenant qu’un seul gène connu, l’oncogène JUN [
3] (Figure 1). La surexpression de ce gène est parfaitement corrélée avec la présence de l’amplicon en 1p32 et avec le statut indifférencié des liposarcomes. L’analyse de l’expression des gènes séquentiellement induits lors de la différenciation adipocytaire (SREBP1, C/EBPβ, C/EBPα, PPARγ2, LPL et adipsine) [
4] montre que ces liposarcomes indifférenciés sont bloqués à un stade précoce de la différenciation adipocytaire. En effet, ces tumeurs expriment les marqueurs précoces de la différenciation adipocytaire (SREBP1 et C/EBPβ), mais aucun des marqueurs exprimés plus tardivement. La différenciation adipocytaire semble donc bloquée dans ces tumeurs au niveau de l’induction de C/EBPα par C/EBPβ. Cette observation nous a conduits à penser que JUN pouvait bloquer la différenciation adipocytaire en interférant avec C/EBPβ, et ainsi l’empêcher d’induire l’expression de ses gènes cibles. En effet, plusieurs données antérieures nous permettaient d’émettre cette hypothèse. Tout d’abord, il a précédemment été observé dans les liposarcomes myxoïdes que la protéine de fusion TLS-CHOP bloquait la différenciation adipocytaire en se dimérisant avec C/EBPβ [
5]. De plus, il a récemment été démontré que DeltaFosB, un des partenaires de JUN dans le complexe AP-1, était capable d’inhiber la différenciation adipocytaire par interaction avec C/EBPβ, empêchant toute induction de C/EBPα [
6]. En outre, de manière surprenante, dans nos liposarcomes indifférenciés, une analyse par puce Affymetrix de l’expression des gènes pro-prolifératifs cibles de JUN montre que leur expression n’est pas modifiée par la surexpression de JUN, bien que ce dernier soit phosphorylé, et donc actif dans ces tumeurs. Le blocage de la différenciation adipocytaire n’est donc pas dû à une prolifération accrue des cellules en réponse à l’induction des gènes cibles de JUN. Nous avons montré, à l’aide d’un plasmide rapporteur C/EBPβ, qu’un fort niveau d’expression de JUN perturbait l’expression de gènes cibles de C/EBPβ. Il est possible que ce phénomène se produise par interaction directe entre JUN et C/EBPβ.  | Figure 1.
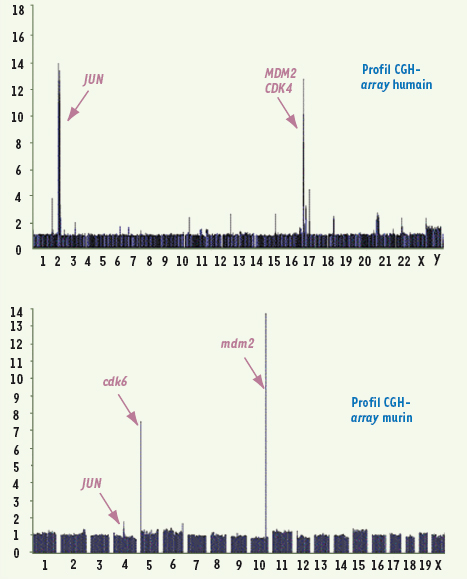
Exemples de profil CGH-
array
humain et murin. A. Un profil CGH-array d’un liposarcome indifférencié humain, comportant l’amplicon 1p32 et 12q15 est présenté. L’axe des abscisses correspond aux chromosomes, l’axe des ordonnées à l’amplitude de l’amplification. Les amplicons contiennent les gènes JUN (1p32), MDM2 et CDK4 (12q15). B. Le profil CGH-array de la lignée 3T3-L1 murine comporte des amplifications des gènes jun (chromosome 4), mdm2 (chromosome 10) et cdk6 (chromosome 5). Les gènes amplifiés dans cette lignée sont très similaires à ceux qui sont amplifiés dans les liposarcomes indifférenciés. La lignée 3T3-L1 constitue donc un bon modèle d’étude pour les liposarcomes indifférenciés. |
|
Amplification de Jun et malignité Devant l’impossibilité d’obtenir des lignées de liposarcomes indifférenciés ou différenciés, et afin de vérifier in vitro et in vivo que JUN bloquait la différenciation adipocytaire, nous avons utilisé la lignée murine 3T3-L1, lignée non tumorale dont les cellules sont capables de se différencier en adipocytes sous l’effet d’une combinaison de molécules différenciantes contenant de l’insuline, du méthyl-isobutyl-xanthine ainsi que du dexaméthasone [
7,
8]. Une analyse de cette lignée à l’aide d’une puce CGH-array murine a révélé qu’elle comportait une forte amplification de mdm2 et cdk6, cette génétique étant très proche de celle des liposarcomes bien différenciés, ainsi qu’une faible amplification de jun
(Figure 1). Une analyse par hybridation in situ (FISH) a révélé que toutes les cellules comportaient des co-amplifications de mdm2 et cdk6, mais que seulement 1 % d’entre elles possédait une très forte amplification de jun. Cette lignée constituait donc un modèle de choix pour notre étude. Lorsqu’on injecte cette lignée à des souris immunodéficientes, on observe l’apparition de petites tumeurs sous-cutanées qui prennent l’aspect de petites masses graisseuses, comme cela avait déjà été précédemment décrit [
9] (Figure 2). Mais contrairement à ce qui est décrit dans la littérature, ces tumeurs vont brusquement grossir, devenir plus fermes et beaucoup plus vascularisées. L’analyse anatomopathologique et immunohistochimique de ces tumeurs prélevées à différents stades d’évolution (précoce, intermédiaire et tardif) montre que les tumeurs prélevées à un stade précoce sont constituées principalement d’une composante correspondant à un liposarcome différencié, négative pour l’expression de Jun, tandis que celles prélevées à un stade tardif sont constituées quasi-exclusivement par une composante correspondant à un liposarcome très indifférencié, exprimant fortement Jun. L’analyse par FISH de ces tumeurs révèle que les zones bien différenciées ne comportent pas d’amplification de jun contrairement aux zones indifférenciées dans lesquelles on observe une très forte amplification de jun. La composante indifférenciée des tumeurs murines dérive donc des quelques cellules amplifiant jun observées en culture, ces cellules étant sélectionnées in vivo. Il est intéressant de noter que ces tumeurs indifférenciées sont très vascularisées contrairement aux tumeurs différenciées, une situation qui pourrait être en rapport avec le rôle important de jun dans l’angiogenèse [
10]. Il est fort probable que ces cellules trouvent chez la souris tous les facteurs nécessaires à leur prolifération accélérée. L’établissement d’une lignée cellulaire à partir d’une composante indifférenciée de tumeur murine nous a permis de montrer que ces cellules amplifiant jun ne prolifèrent pas plus vite en condition d’ancrage, mais que ces cellules en revanche sont beaucoup plus tumorigènes que les cellules 3T3-L1 lorsqu’elles sont cultivées en agar mou. Il est important de noter qu’à l’instar des tumeurs humaines, ces cellules sont engagées dans la voie de différenciation adipocytaire mais sont bloquées juste avant l’induction de C/EBPα par C/EBPβ, et qu’elles ne peuvent pas réaliser une différenciation adipocytaire complète lorsqu’on les soumet aux conditions de différenciation.  | Figure 2.
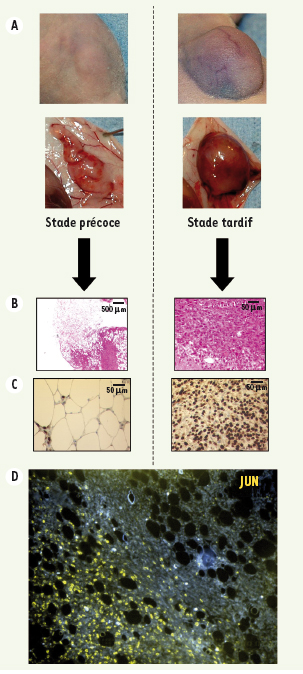
Tumeurs murines obtenues par injection de cellules 3T3-L1. A. Aspect macroscopique, à un stade de développement précoce ou tardif, des tumeurs obtenues après injection de la lignée 3T3-L1. B. Coupes anatomopathologiques des tumeurs respectives. Au stade précoce, les tumeurs sont composées quasi-exclusivement de tissu adipeux bien différencié, tandis qu’au stade tardif, les tumeurs sont totalement indifférenciées. C. Immunohistochimie Jun sur les prélévements respectifs. Seules les zones très indifférenciées sont fortement positives pour Jun. D. FISH jun sur une coupe en paraffine d’un prélévement de tumeur murine. Les cellules de la zone indifférenciée amplifient fortement jun, tandis que les cellules de la zone bien différenciée ne comportent pas d’amplification de jun.
|
En parallèle de cette étude sur les tumeurs développées par injection des cellules 3T3-L1, nous avons transfecté de manière stable des cellules 3T3-L1 avec un plasmide surexprimant jun, ce qui nous a permis d’obtenir après sélection un clone surexprimant jun mais ne comportant pas d’amplification endogène de jun. Ce clone, lorsqu’il est soumis au cocktail différenciant, se différencie très faiblement et très tardivement, ce qui suggère que la différenciation adipocytaire est effectivement bloquée ou nettement retardée dans ces cellules surexprimant jun. |
C’est la première fois qu’une amplification de JUN est décrite dans des tumeurs [
11,
12]. En effet, bien que l’oncogène JUN ait été isolé en 1987, et décrit comme impliqué dans de nombreux processus tels que la prolifération cellulaire, la transformation et l’apoptose, il n’a jamais été directement impliqué dans un processus tumoral. Nous avons montré que l’amplification et la surexpression de JUN bloquent la différenciation adipocytaire à un stade précoce et que ce phénomène conduit à un phénotype indifférencié et donc beaucoup plus agressif de ces liposarcomes. Ces résultats constituent un point de départ important en vue d’un développement de tests diagnostiques ainsi que d’une thérapie ciblée de ces liposarcomes indifférenciés [3]. |
Ce travail a bénéficié du soutien de l’Institut Curie, de l’Inserm, de la Ligue contre le Cancer. O.M. a été soutenue par une bourse de l’ARC et de la SFC.
|
1. Chibon F, Mariani O, Derre J, et al. A subgroup of malignant fibrous histiocytomas is associated with genetic changes similar to those of well-differentiated liposarcomas. Cancer Genet Cytogenet 2002; 139 : 24–9. 2. Coindre JM, Mariani O, Chibon F, et al. Most malignant fibrous histiocytomas developed in the retroperitoneum are dedifferentiated liposarcomas : a review of 25 cases initially diagnosed as malignant fibrous histiocytoma. Mod Pathol 2003; 16 : 256–62. 3. Mariani O, Brennetot C, Coindre JM, et al. JUN oncogene amplification and overexpression block adipocytic differentiation in highly aggressive sarcomas. Cancer Cell 2007; 11 : 361–74. 4. Cowherd RM, Lyle RE, McGehee RE Jr. Molecular regulation of adipocyte differentiation. Semin Cell Dev Biol 1999; 10 : 3–10. 5. Adelmant G, Gilbert JD, Freytag SO. Human translocation liposarcoma-CCAAT/enhancer binding protein (C/EBP) homologous protein (TLS-CHOP) oncoprotein prevents adipocyte differentiation by directly interfering with C/EBPbeta function. J Biol Chem 1998; 273 : 15574–81. 6. Sabatakos G, Sims NA, Chen J, et al. Overexpression of DeltaFosB transcription factor(s) increases bone formation and inhibits adipogenesis. Nat Med 2000; 6 : 985–90. 7. Green, H, Kehinde O. An established preadipose cell line and its differentiation in culture. II. Factors affecting the adipose conversion. Cell 1975; 5 : 19–27. 8. Green H, Kehinde O. Spontaneous heritable changes leading to increased adipose conversion in 3T3 cells. Cell 1976; 7 : 105–13. 9. Green H, Kehinde O. Formation of normally differentiated subcutaneous fat pads by an established preadipose cell line. J Cell Physiol 1979; 101 : 169–71. 10. Toft DJ, Rosenberg SB, Bergers G, et al. Reactivation of proliferin gene expression is associated with increased angiogenesis in a cell culture model of fibrosarcoma tumor progression. Proc Natl Acad Sci USA 2001; 98 : 13055–9. 11. Jochum W, Passegue E, Wagner EF. AP-1 in mouse development and tumorigenesis. Oncogene 2001; 20 : 2401–12. 12. Vogt, PK. Jun, the oncoprotein. Oncogene 2001; 20 : 2365–77. |