| |
| Med Sci (Paris). 2008 January; 24(1): 29–30. Published online 2008 January 15. doi: 10.1051/medsci/200824129.La réponse consécutive à des dommages à l’ADN contribue à la suppression tumorale en détectant l’activité oncogénique Frédérick A. Mallette and Gerardo Ferbeyre* Département de biochimie, Université de Montréal, CP 6128, Succursale Centre-ville, Montréal, Québec, H3C 3J7 Canada MeSH keywords: Altération de l'ADN, Réplication de l'ADN, ADN tumoral, Humains, Modèles génétiques, Tumeurs, Oncogènes |
Une révolution est survenue dans le domaine de la recherche contre le cancer quand fut considérée l’idée que le cancer constituait une maladie génétique. Au cours des deux dernières décennies, de nombreux gènes, ainsi que leurs mutations, participant à la formation de cancers ont été détectés et clonés et identifiés. La tumorigenèse [
1] serait attribuable à l’altération de trois types de gènes : les oncogènes, les suppresseurs tumoraux et les gènes de stabilité (caretakers). La transformation cellulaire dépend donc d’événements conduisant à l’activation d’oncogènes, comme Myc, Ras et STAT5, afin de favoriser la prolifération cellulaire. Toutefois, les cellules normales peuvent mettre en place, par l’activation de suppresseurs tumoraux, des mécanismes de défense afin de contrer la transformation cellulaire. Par exemple, à la suite de l’activation des oncogènes Ras ou STAT5, les voies de p53 et de Rb sont stimulées afin de freiner la croissance des cellules et permettre un arrêt permanent de la prolifération nommé sénescence. L’inactivation des suppresseurs tumoraux constitue alors un élément essentiel à la progression tumorale [1]. Initialement, la sénescence fut associée au potentiel réplicatif limité de cellules normales [
2]. La sénescence réplicative est d’ailleurs reliée au raccourcissement et à la perte de fonction des télomères. La sénescence déclenchée par les oncogènes est, quant à elle, qualifiée de prématurée puisqu’elle survient avant la sénescence réplicative. Les voies engagées par les suppresseurs tumoraux p53 et Rb constituent les axes centraux des mécanismes moléculaires menant à la sénescence par suite de l’expression d’oncogènes. Les événements permettant de détecter l’activité oncogénique et menant à l’activation de p53 et Rb sont donc tout aussi importants. Chez la souris, la protéine ARF remplit ce rôle et permet d’engager la voie de p53 à la suite de nombreux stimulus oncogéniques [
3]. Il fut donc suggéré que ARF représentait le senseur du stress oncogénique. Cependant, Ras ne requiert pas ARF afin d’activer p53 et de provoquer la sénescence dans les cellules humaines [
4]. Il devenait donc primordial d’identifier la nature du senseur du stress oncogénique dans les cellules humaines. En analysant les différents types de sénescence connus, soit la sénescence réplicative, liée au dysfonctionnement des télomères, en réponse à un stress oxydatif ou causée par des agents chimiothérapeutiques, il apparaissait clair que l’élément commun à tous ces modèles de sénescence était la présence de signaux de dommages de l’ADN. Il devenait donc urgent de déterminer le rôle de cette voie lors de la sénescence déclenchée par les oncogènes. |
La réponse consécutive aux dommages de l’ADN conduit a l’activation de p53 par les oncogènes Notre groupe [
5] ainsi que ceux dirigés par les docteurs V. Gorgoulis et F. d’Adda di Fagagna ont récemment démontré que la réponse causée par des dommages à l’ADN est cruciale lors de l’établissement du programme de sénescence provoquée par une myriade d’oncogènes [
6,
7]. Les oncogènes Ras, STAT5, E2F1, Mos et Cdc6 conduisent tous à l’activation de p53 et à la sénescence via la voie de la réponse aux dommages affectant l’ADN. Ces études démontrent que l’activité oncogénique mène à l’altération de l’ADN et que les protéines responsables de la reconnaissance et de la réparation de ces altérations constituent les détecteurs du stress oncogénique. |
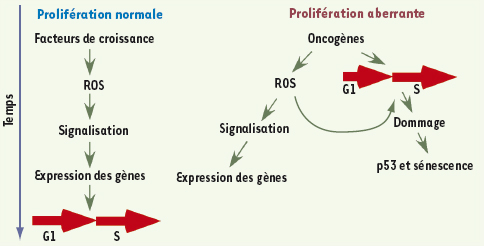
Mécanismes de création de dommages à l’ADN par les oncogènes La compréhension du ou des mécanismes par lesquels les oncogènes induisent des brisures dans l’ADN est dès lors primordiale. Contrairement à ce qui a pu être observé lors de la sénescence réplicative, les foyers de dommages causés à l’ADN par les oncogènes ne sont pas associés aux télomères [5]. En fait, l’activation d’oncogènes, comme Myc [
8], Ras et STAT5 augmente les densités intracellulaires d’espèces oxygénées réactives (ROS) [
9]. Les ROS peuvent alors endommager l’ADN par des bris simple et double brin et ainsi stimuler une réponse de dommage à l’ADN. D’ailleurs, il a été démontré que la sénescence introduite par l’oncogène Ras dépendait de la présence de ROS [
10]. D’autres chercheurs ont suggéré que les oncogènes endommagent l’ADN en causant un certain stress réplicatif [6, 7]. L’activation de la voie de réponse de dommage à l’ADN par les oncogènes peut donc être la somme de plusieurs mécanismes différents dont font partie le stress réplicatif et les ROS. Un modèle combinant l’action des ROS et les effets des oncogènes sur le cycle cellulaire est présenté dans la Figure 1. D’une part, les oncogènes accélèrent le passage de la phase G1 à la phase S où les cellules synthétisent leur ADN. D’autre part, les oncogènes entraînent l’accumulation de ROS. Nous proposons que pendant le cycle cellulaire normal ces deux phénomènes sont dissociés dans le temps pour empêcher l’altération de l’ADN. Les oncogènes en forçant les cellules vers une phase S aberrante, rendent l’ADN vulnérable aux ROS (Figure 1).  | Figure 1.
Schéma suggérant un modèle de dommage à l’ADN par les oncogènes. Normalement (A), les facteurs de croissance stimulent une production limitée d’espèces oxygénées réactives afin de stimuler la signalisation et la transition de la phase G1 vers la phase S, où les cellules synthétisent leur ADN.B. les oncogènes déclenchent une production élevée de ROS et une entrée dérégulée en phase S. Par conséquent, les ROS endommagent l’ADN engagé dans la machinerie de réplication. |
|
La réponse consécutive aux dommages causés à l’ADN joue donc un rôle crucial lors de la sénescence déclenchée par les oncogènes. En plus de préserver l’intégrité génomique, les kinases ATM, ATR et Chk1/2 activées par l’altération de l’ADN, protègent les cellules de la transformation en permettant l’établissement du programme de sénescence [5–7]. Certes l’on savait déjà que les sénescences réplicatives, liées à la dysfonction des télomères [
11] exerçaient une part active dans la réponse de dommage à l’ADN. La démonstration du rôle crucial de cette voie, lors de la sénescence causée par les oncogènes, montre que la réponse consécutive aux dommages constitue un élément commun à plusieurs types de sénescence. Il est donc maintenant possible d’unifier les différents modèles de sénescence en considérant leur dépendance à la réponse qui suit les dommages à l’ADN. D’un point de vue thérapeutique, la reconnaissance de cellules arborant des dommages au niveau de leur ADN lors de stades précoces de la transformation ouvre de nouvelles avenues de recherche. Le ciblage de telles cellules permettrait la prévention potentielle du cancer. |
1. Vogelstein B, Kinzler KW. Cancer genes and the pathways they control. Nat Med 2004; 10 : 789–99. 2. Hayflick L. The limited in vitro lifetime of human diploid cell strains. Exp Cell Res 1965; 37 : 614–36. 3. Zindy F, Williams RT, Baudino TA, et al. Arf tumor suppressor promoter monitors latent oncogenic signals in vivo. Proc Natl Acad Sci USA 2003; 100 : 15930–5. 4. Wei W, Hemmer RM, Sedivy JM. Role of p14(ARF) in replicative and induced senescence of human fibroblasts. Mol Cell Biol 2001; 21 : 6748–57. 5. Mallette FA, Gaumont-Leclerc MF, Ferbeyre G. The DNA damage signaling pathway is a critical mediator of oncogene-induced senescence. Genes Dev 2007; 21 : 43–8. 6. Bartkova J, Rezaei N, Liontos M, et al. Oncogene-induced senescence is part of the tumorigenesis barrier imposed by DNA damage checkpoints. Nature 2006; 444 : 633–7. 7. Di Micco R, Fumagalli M, Cicalese A, et al. Oncogene-induced senescence is a DNA damage response triggered by DNA hyper-replication. Nature 2006; 444 : 638–42. 8. Vafa O, Wade M, Kern S, et al. c-Myc can induce DNA damage, increase reactive oxygen species, and mitigate p53 function : a mechanism for oncogene-induced genetic instability. Mol Cell 2002; 9 : 1031–44. 9. Mallette FA, Ferbeyre G. The DNA damage signaling pathway connects oncogenic stress to cellular senescence. Cell Cycle 2007; 6 : 1831–6. 10. Lee AC, Fenster BE, Ito H, et al. Ras proteins induce senescence by altering the intracellular levels of reactive oxygen species. J Biol Chem 1999; 274 : 7936–40. 11. D’Adda di Fagagna F, Reaper PM, Clay-Farrace L, et al. A DNA damage checkpoint response in telomere-initiated senescence. Nature 2003; 426 : 194–8. |