| |
| Med Sci (Paris). 2008 January; 24(1): 105–110. Published online 2008 January 15. doi: 10.1051/medsci/2008241105.OPG/RANKL Implication et cible thérapeutique dans l’ostéoporose Pierre Marie1* and Philippe Halbout2* 1Directeur de recherche au CNRS, Inserm U606 et Université Paris 7, Hôpital Lariboisière, 2, rue Ambroise Paré, 75475 Paris Cedex 10, France 2Division Thérapeutique de Rhumatologie, Institut de Recherches Internationales Servier, 6, place des Pléiades, 92415 Courbevoie Cedex, France |
Rôle essentiel d’OPG/RANKL dans le contrôle du remodelage osseux Le remodelage osseux est un processus physiologique qui assure le renouvellement de la matrice osseuse, et le maintien de la quantité et de la qualité du tissu osseux. Ce processus débute par une phase de résorption, caractérisée par la différenciation de cellules mononucléées et leur fusion en ostéoclastes matures qui adhèrent à la matrice osseuse et creusent une lacune de résorption [
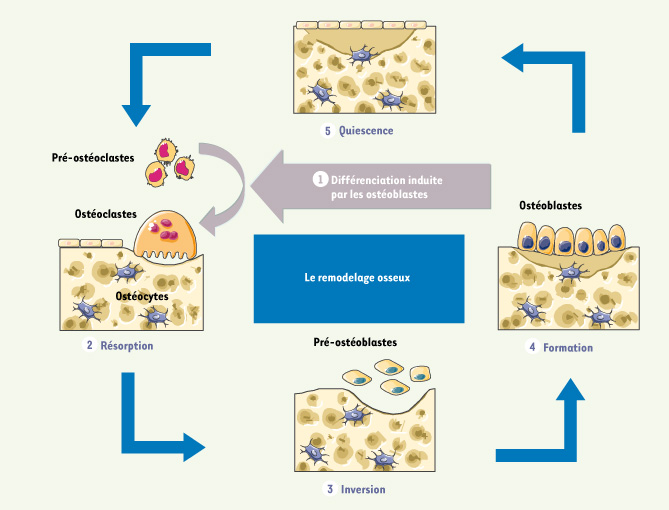
1]. À la fin de cette phase de résorption, l’ostéoclaste meurt par apoptose et après une phase d’inversion, des pré-ostéoblastes se différencient et synthétisent une nouvelle matrice osseuse qui se minéralise progressivement au niveau de la lacune de résorption. Ce mécanisme physiologique permet le remplacement progressif du tissu osseux par un nouvel os dont les propriétés mécaniques sont optimales (Figure 1).  | Figure 1.
Le processus de remodelage osseux. Le cycle de remodelage osseux débute par une phase de résorption caractérisée par la différenciation de cellules mononucléées et leur fusion en ostéoclastes matures qui creusent une lacune de résorption. Après cette phase de résorption, les pré-ostéoblastes se différencient en ostéoblastes qui synthétisent une nouvelle matrice osseuse à la fin de la période de formation, ce qui permet de renouveler la structure osseuse et de préserver les propriétés mécaniques de l’os. |
Les cellules osseuses impliquées dans le remodelage osseux sont étroitement régulées par de nombreux facteurs hormonaux et locaux [
2]. Ces facteurs agissent en régulant la différenciation, l’activité et la durée de vie des cellules osseuses. Plusieurs travaux expérimentaux ont démontré le rôle essentiel d’une molécule, le RANKL (receptor activator of nuclear factor-κB ligand), protéine membre de la famille du TNF, dans l’ostéoclastogenèse [
3–
6]. Cette protéine transmembranaire est exprimée, sous forme clivable, par les ostéoblastes et leurs précurseurs. La liaison de RANKL à son récepteur RANK exprimé par les ostéoclastes et leurs précurseurs active de multiples voies de signalisation [
5] conduisant à l’augmentation de l’activité du facteur de transcription NF-κB (nuclear factor-κB ligand), puis à l’expression de gènes impliqués dans la différenciation, l’activité et la survie de l’ostéoclaste [
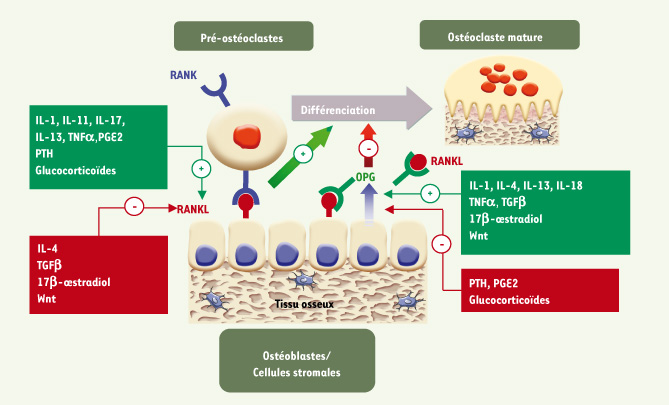
7]. L’ostéoprotégérine (OPG) est une molécule soluble produite par les ostéoblastes et les cellules stromales, qui se lie au RANKL et antagonise sa liaison à RANK. La liaison OPG/RANKL inhibe ainsi la différenciation ostéoclastique ainsi que l’activité et la survie des ostéoclastes (Figure 2). Cette modulation peut varier en fonction du stade de différenciation des ostéoblastes. Ainsi, les taux d’OPG diminuent alors que ceux de RANKL augmentent avec la différenciation des ostéoblastes [
8]. L’ostéoblaste joue ainsi un rôle essentiel dans le contrôle de l’ostéoclastogenèse et du remodelage osseux en modulant l’équilibre OPG/RANKL (Figure 2). 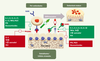 | Figure 2.
Contrôle du remodelage osseux par le système OPG/RANKL. La liaison de RANKL à son récepteur RANK sur les précurseurs des ostéoclastes induit la différenciation ostéoclastique et la survie des ostéoclastes. L’OPG produite par les ostéoblastes se lie au RANKL, antagonise sa liaison à RANK et inhibe l’ostéoclastogenèse. Les hormones et facteurs régulateurs du remodelage osseux agissent en contrôlant positivement ou négativement la production d’OPG et de RANKL par les ostéoblastes. |
Plusieurs hormones et facteurs locaux agissent sur le remodelage osseux en modulant l’expression d’OPG et de RANKL [
4]. Ainsi, l’expression d’OPG est diminuée in vitro par la prostaglandine E2 (PGE2), les glucorticoïdes et la parathormone (PTH) mais est augmentée par les œstrogènes et plusieurs cytokines (IL-1, IL-4, IL-13, IL-18, TNFα, TGFβ). Par ailleurs, l’expression de RANKL par les ostéoblastes ou les cellules stromales est augmentée in vitro par les activateurs de l’ostéoclastogenèse tels que le 1,25(OH)2 vitamine D, les glucocorticoïdes, la PTH, la PGE2, plusieurs interleukines (IL-1, IL-11, IL-13, IL-17) et le TNFα. En revanche, les œstrogènes, l’IL-4, le 17 β œstradiol et le TGFβ diminuent l’expression de RANKL et l’ostéoclastogenèse [7]. La voie de signalisation Wnt/β-caténine, si importante dans le contrôle des ostéoblastes et de la formation osseuse, contrôle aussi le système OPG/RANKL et donc la différenciation ostéoclastique [
9,
10]. Toutes ces molécules physiologiques régulent ainsi l’ostéoclastogenèse et le remodelage osseux en modulant le système OPG/RANKL in vitro
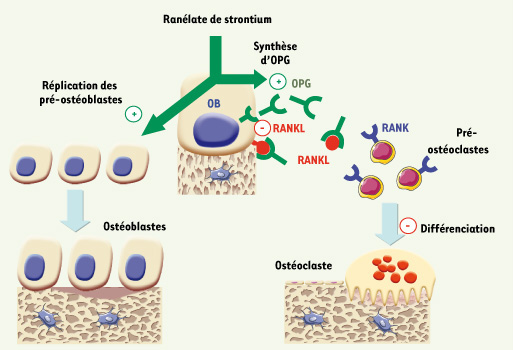
(Figure 3). 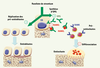 | Figure 3.
Nouvelle stratégie anti-ostéoporotique ciblant le système OPG/RANKL. Le ranélate de strontium augmente l’expression d’OPG et diminue celle de RANKL, et, par ailleurs, stimule la réplication des ostéoblastes. Cette stratégie vise à rééquilibrer le rapport OPG/RANKL et le métabolisme osseux et à prévenir la perte osseuse dans l’ostéoporose. |
L’importance du couple OPG/RANKL dans le contrôle de l’ostéoclastogenèse a été également démontrée in vivo. Plusieurs travaux expérimentaux ont en effet montré que l’inactivation de RANKL (ou de RANK) et la sur-expression d’OPG inhibent la résorption osseuse et induisent par suite une augmentation de la masse osseuse chez la souris. Au contraire, l’invalidation de l’OPG induit une perte osseuse importante chez la souris [
11,
12]. Ainsi, le maintien de la masse osseuse est étroitement dépendant de la régulation du système OPG/RANKL par l’ostéoblaste : tout déséquilibre entre ces deux molécules induit des anomalies du métabolisme osseux avec une répercussion importante sur la masse osseuse. Chez l’homme, la plupart des pathologies osseuses caractérisées par une ostéolyse est associée à une anomalie de la production d’OPG ou de RANKL [
13]. Une augmentation du rapport OPG/RANKL a ainsi été impliquée dans la pathogénie de nombreuses pathologies osseuses telles que l’ostéoporose, la polyarthrite rhumatoïde, la maladie de Paget, l’hyperparathyroïdisme, les métastases osseuses lytiques et l’hypercalcémie maligne, entre autres pathologies [13]. Ces données ont révélé le rôle essentiel du couple OPG/RANKL dans la pathogénie des maladies ostéo-articulaires à caractère lytique. |
Implication de OPG/RANKL dans l’ostéoporose L’ostéoporose est caractérisée par une diminution de la masse osseuse et de la qualité osseuse, aboutissant à une fragilisation du tissu osseux et à une augmentation du risque fracturaire [
14]. Les mécanismes impliqués dans la perte osseuse avec l’âge et la ménopause sont maintenant mieux connus. La capacité de remplacement de la matrice osseuse par les ostéoblastes diminue avec l’âge, ce qui induit un déficit de dépôt de matrice et un amincissement des travées osseuses. La déficience en œstrogènes à la ménopause induit une accélération rapide et importante du remodelage osseux : le nombre de sites de résorption augmente, ce qui amplifie le déficit entre résorption et formation osseuses, et induit une perte de connexion intertrabéculaire, avec pour conséquence une diminution de la résistance mécanique et une augmentation du risque de fractures. À cet effet, au niveau de l’os trabéculaire, s’ajoute également un amincissement de l’os cortical par résorption endostée qui contribue à diminuer la résistance mécanique de l’os [
15]. Plusieurs mécanismes moléculaires, tels que l’augmentation de la production locale de cytokines [
16] ont été impliqués dans l’accélération du remodelage osseux et de la perte osseuse en cas de carence œstrogénique. Un déséquilibre du système OPG/RANKL pourrait également jouer un rôle important dans l’augmentation du remodelage osseux dans l’ostéoporose post-ménopausique. In vivo, l’ovariectomie chez la souris augmente les taux circulants de RANKL [
17]. De façon intéressante, il a été observé que les taux de RANKL produits par les cellules stromales sont plus élevés chez les femmes ménopausées par rapport aux femmes en pré-ménopause ou ménopausées recevant un traitement hormonal substitutif [
18]. Enfin, l’expression de RANKL est inversement corrélée avec les taux d’œstrogènes circulants et positivement corrélée avec les marqueurs de résorption osseuse dans l’ostéoporose [18]. Enfin, l’augmentation de l’expression de RANKL semble être impliquée dans l’augmentation de la résorption osseuse chez la femme au moment de la ménopause [18]. Ces observations mettent en évidence le rôle essentiel du déséquilibre entre OPG et RANKL dans l’augmentation de la résorption osseuse consécutive à la déficience en œstrogènes chez la femme ménopausée. Cette implication du couple OPG/RANKL dans la pathogénie de l’ostéoporose post-ménopausique suggère que l’on pourrait développer de nouvelles stratégies thérapeutiques visant à rééquilibrer le système OPG/RANKL [
19]. |
OPG/RANKL : une nouvelle cible thérapeutique dans l’ostéoporose Étant donné l’augmentation du remodelage osseux à la ménopause et ses conséquences néfastes sur la structure de l’os, certaines stratégies thérapeutiques (traitement hormonal substitutif, SERM [modulateur sélectif des récepteurs des œstrogènes], bisphosphonates) utilisées pour cibler l’ostéoclaste et la résorption osseuse ont des effets anti-ostéoporotiques reconnus [16,
20]. L’effet anti-résorbant des œstrogènes pourrait résulter en partie de la modulation de l’équilibre OPG/RANKL puisque le 17β-œstradiol favorise la production d’OPG et diminue celle de RANKL in vitro [
21]. En revanche, l’implication du système OGP/RANKL dans l’inhibition du remodelage osseux induit par les bisphosphonates est plus controversée [
22]. Une autre stratégie thérapeutique consiste à promouvoir la formation osseuse. Ainsi, un traitement intermittent par la PTH a un effet anti-fracturaire important grâce à son effet anabolique [20]. L’effet anabolique osseux de la PTH n’est pas lié à un rééquilibrage du système OPG/RANKL. En effet, la PTH induit une diminution de l’expression de l’OPG et une augmentation de l’expression de RANKL in vitro, ce qui est par ailleurs compatible avec son effet catabolique [
23]. La découverte de l’importance du couple OPG/RANKL dans la résorption osseuse normale et pathologique a conduit à développer de nouvelles thérapies ciblant directement le système RANK/RANKL. D’un point de vue théorique, les effets du RANKL pourraient être inhibés par l’OPG, par le RANK soluble, ou par des anticorps anti-RANK ou anti-RANKL [4] (Figure 3). Ce concept a été validé dans plusieurs modèles expérimentaux. Ainsi, l’administration d’OPG permet d’inhiber la différenciation, la fonction et la survie des ostéoclastes et donc la résorption osseuse, permettant d’améliorer la résistance osseuse chez la rate ovariectomisée, un modèle établi de perte osseuse par déficience œstrogénique [
24]. Par ailleurs, l’administration d’OPG chez des femmes ostéoporotiques ménopausées induit bien une diminution de la résorption osseuse, évaluée par les marqueurs biochimiques [
25]. Ceci a permis de valider le concept selon lequel le rééquilibrage OPG/RANKL a un effet bénéfique sur le remodelage osseux. L’utilisation d’anti-RANKL semble cependant plus prometteuse par ses effets plus spécifiques sur l’inhibition de RANKL [4]. Une étude clinique récente chez des femmes ménopausées avec densité minérale osseuse basse a ainsi montré qu’un anticorps anti-RANKL (Denosumab, AMG162) inhibe la résorption osseuse évaluée par les marqueurs biochimiques, et induit une augmentation de la masse osseuse (BMD, densité minérale osseuse) par rapport au groupe témoin [
26]. Cette étude a montré que l’on peut durablement réduire le remodelage osseux en neutralisant RANKL, ce qui peut à terme conduire à une nouvelle stratégie prometteuse dans le traitement de l’ostéoporose. Compte tenu du fait que RANKL joue également un rôle important dans la différenciation des lymphocytes B et T [4], il reste à démontrer l’absence d’effets non spécifiques de cet anticorps. Un nouveau traitement anti-ostéoporotique, le ranélate de strontium, agit en rééquilibrant le système OPG/RANKL. Plusieurs travaux de notre laboratoire, confirmés par d’autres équipes internationales, ont montré que le ranélate de strontium stimule la réplication des ostéoblastes et leur différenciation, tout en diminuant la résorption osseuse [
27]. Ce double effet conduit à réduire l’incidence des fractures chez les femmes ostéoporotiques [
28,
29]. Des travaux récents ont montré que le ranélate de strontium agit sur l’ostéoclastogenèse en modulant favorablement l’équilibre OPG/RANKL. Ainsi, il a été démontré que cette molécule augmente l’expression d’OPG et réduit l’expression de RANKL par des ostéoblastes humains en culture [
30] (Figure 3). Ce nouveau traitement pourrait donc augmenter la réplication des ostéoblastes tout en diminuant leur capacité à promouvoir l’ostéoclastogenèse en rétablissant l’équilibre OPG/RANKL (Figure 3). Ainsi, cette molécule cible l’ostéoblaste par ses effets favorables sur la réplication cellulaire et la synthèse matricielle, et en rééquilibrant la production d’OPG et de RANKL. Les mécanismes mis en jeu dans la modulation de l’expression de ces molécules dans l’ostéoblaste ne sont pas encore connus, mais pourraient faire intervenir le calcium-sensing receptor qui est sensible au strontium [27]. |
Les données expérimentales et cliniques récentes ont permis de montrer que le système OPG/RANKL joue un rôle essentiel dans le contrôle du métabolisme osseux normal et pathologique, mettant ainsi en lumière le rôle central de l’ostéoblaste dans la régulation de la formation et de la résorption osseuses. En particulier, l’augmentation du remodelage osseux dans l’ostéoporose post-ménopausique est associée à un déséquilibre du rapport OPG/RANKL. Plusieurs stratégies thérapeutiques visant à rééquilibrer le rapport OPG/RANKL dans l’ostéoporose ont été développées. La normalisation du rapport OPG/RANKL par ces interventions thérapeutiques a conduit à restaurer le niveau de remodelage osseux et à freiner la perte osseuse dans l’ostéoporose. Ces données suggèrent que l’utilisation de molécules ciblant le système OPG/RANKL pourrait avoir des applications cliniques importantes dans le traitement de nombreuses maladies osseuses caractérisées par une perte osseuse induite par une augmentation du remodelage osseux. |
1. Marie PJ. Différenciation, fonction et régulation de l’ostéoblaste. Med Sci (Paris) 2001; 12 : 1252–9. 2. Marie P, Debiais F, Cohen-Solal M, de Vernejoul MC. De nouveaux facteurs contrôlent le remodelage osseux. Rev Rhumatol 2000; 67 : 260–7. 3. Suda T, Takahashi N, Udagawa N, et al. Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families. Endocr Rev 1999; 20 : 345–57. 4. Hofbauer LC, Heufelder AE. Role of receptor activator of nuclear factor-kappaB ligand and osteoprotegerin in bone cell biology. J Mol Med 2001; 79 : 243–53. 5. Boyle WJ, Simonet WS, Lacey DL. Osteoclast differentiation and activation. Nature 2003; 423 : 337–42. 6. Tanaka S, Nakamura K, Takahasi N, Suda T. Role of RANKL in physiological and pathological bone resorption and therapeutics targeting the RANKL-RANK signaling system. Immunol Rev 2005; 208 : 30–49. 7. Wada T, Nakashima T, Hiroshi N, Penninger JM. RANKL-RANK signaling in osteoclastogenesis and bone disease. Trends Mol Med 2006; 12 : 17–25. 8. Huang JC, Sakata T, Pfelger LL, et al. PTH differentially regulates expression of RANKL and OPG. J Bone Miner Res 2004; 19 : 235–44. 9. Spencer GJ, Utting JC, Etheridge SL, et al. Wnt signalling in osteoblasts regulates expression of the receptor activator of NFkappaB ligand and inhibits osteoclastogenesis in vitro. J Cell Sci 2006; 119 : 1283–96. 10. Holmen SL, Zylstra CR, Mukherjee A, et al. Essential role of beta-catenin in postnatal bone acquisition. J Biol Chem 2005; 280 : 21162–8. 11. Kostenuik PJ, Shaloub V. Osteoprotegerin : a physiological and pharmacological inhibitor of bone resorption. Curr Pharm Des 2001; 7 : 613–35. 12. Kostenuik PJ. Osteoprotegerin and RANKL regulate bone resorption, density, geometry and strength. Curr Opin Pharmacol 2005; 5 : 618–25. 13. Hofbauer LC, Schoppet M. Clinical implications of the osteoprotegerin/RANKL/RANK system for bone and vascular diseases. JAMA 2004; 292 : 490–5. 14. Seeman E, Delmas P. Bone quality-the material and structural basis of bone strength and fragility. N Engl J Med 2006; 354 : 2250–61. 15. Khosla S, Riggs BL. Pathophysiology of age-related bone loss and osteoporosis. Endocrinol Metab Clin North Am 2005; 34 : 1015–30. 16. Rodan GA, Martin TJ. Therapeutic approaches to bone diseases. Science 2000; 289 : 1508–14. 17. Nakamichi Y, Udagawa N, Kobayashi Y, et al. Osteoprotegerin reduces the serum level of receptor activator of NF-kappaB ligand derived from osteoblasts. J Immunol 2007; 178 : 192–200. 18. Eghbali-Fatourechi G, Khosla S, Sanyal A, et al. Role of RANK ligand in mediating increased bone resorption in early postmenopausal women. J Clin Invest 2003; 111 : 1221–30. 19. Martin TJ. Current, new and emerging anti-resorptive drugs; antibody blockade of RANKL action. BoneKey-Osteovision 2006; 3 : 42–6. 20. Riggs BL, Parfitt AM. Drugs used to treat osteoporosis : the critical need for a uniform nomenclature based on their action on bone remodeling. J Bone Miner Res 2005; 20 : 177–84.7. 21. Hofbauer LC, Khosla S, Dunstan CR, et al. Estrogen stimulates gene expression and protein production of osteoprotegerin in human osteoblastic cells. Endocrinology 1999; 140 : 4367–70. 22. Kim YH, Kim GS, Jeong-Hwa B. Inhibitory action of bisphosphonates on bone resorption does not involve the regulation of RANKL and OPG expression. Exp Mol Med 2002; 34 : 145–51. 23. Locklin RM, Khosla S, Turner RT, Riggs BL. Mediators of the biphasic responses of bone to intermittent and continuously administered parathyroid hormone. J Cell Biochem 2003; 89 : 180–90. 24. Bolon B, Carter C, Daris M, et al. Adenoviral delivery of osteoprotegerin ameliorates bone resorption in a mouse ovariectomy model of osteoporosis. Mol Ther 2001; 3 : 197–205. 25. Bekker PJ, Holloway D, Nakanishi A, et al. The effect of a single dose of osteoprotegerin in postmenopausal women. J Bone Miner Res 2001; 16 : 348–60. 26. McClung MR, Lewieki EM, Cohen SB, et al. Denosumab in postmenopausal women with low bone mineral density. N Engl J Med 2006; 354 : 821–31. 27. Marie PJ. Strontium ranelate : a dual mode of action rebalancing bone turnover in favour of bone formation. Curr Opin Rheumatol 2006; 18 : S11–5. 28. Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004; 350 : 459–68. 29. Reginster JY, Seeman E, De Vernejoul MC, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis : treatment of peripheral osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005; 90 : 2816–22. 30. Brennan T, Rybchyn MS, Conigrave AD, Mason RS. Strontium ranelate effect on proliferation and OPG expression in osteoblasts. Calcif Tissue Int 2006; 78 : S1–129. |