| |
| Med Sci (Paris). 2008 October; 24(10): 799–800. Published online 2008 October 15. doi: 10.1051/medsci/20082410799.Le ver endormi ? Jean-Louis Bessereau* École Normale Supérieure, Biologie Cellulaire de la Synapse, 46, rue d’Ulm, 75005 Paris, France Inserm U789, 75005 Paris, France MeSH keywords: Animaux, Caenorhabditis elegans, Protéines de Caenorhabditis elegans, Cyclic GMP-Dependent Protein Kinases, Drosophila, Facteur de croissance épidermique, Interneurones, Locomotion, Mammifères, Neurones, Récepteur facteur croissance épidermique, Seuils sensoriels, Sommeil, Spécificité d'espèce |
Nous en avons un besoin absolu, mais nous ne nous savons pas pourquoi. Serait-il pertinent de se placer dans une perspective résolument évolutive pour mieux comprendre la biologie du sommeil, qui reste si fascinante et néanmoins si mystérieuse malgré des décennies de recherche intense ? Il y a sûrement beaucoup à apprendre du sommeil du poisson ou de l’oiseau. Mais de celui du ver ? Une étude récente publiée par Raizen et al. [
1] décrit chez le nématode Caenorhabditis elegans un comportement qui partage avec le sommeil des vertébrés d’intriguantes similarités. Anthropomorphisme ou décryptage de lointaines origines évolutives ? Difficile de répondre. Mais il est plaisant d’imaginer que l’identification des voies moléculaires impliquées dans le contrôle de comportements de quiescence chez C. elegans ou la drosophile [
2] pourrait contribuer à la compréhension de certains aspects de la biologie du sommeil. Et les premiers indices sont prometteurs ! |
Léthargie de C. elegans : analogies avec le sommeil
La première difficulté de ce type d’approche est de définir le sommeil chez un organisme aussi distant (pour une discussion de ce point, voir la revue de Nicolau et al. [
3]). Point de critères électroencéphalographiques chez un animal dont la totalité du système nerveux ne contient que 302 neurones connectés par seulement 5 000 synapses [
4], moins que dans un seul neurone pyramidal de notre cortex ! Il y a près d’un siècle, le physiologiste français Henri Piéron proposait trois caractéristiques pour définir le sommeil : (1) le repos moteur ; (2) l’élévation des seuils sensoriels ; (3) la réversibilité facile du comportement. Dans leur étude récente, Raizen et al. montrent que la léthargie de C. elegans répond à ces critères. Ce comportement est observé durant la période précédant chacune des quatre mues qui permettent aux larves de grandir en se débarrassant de leur ancienne cuticule, exosquelette rigide qui protége les animaux de l’environnement [
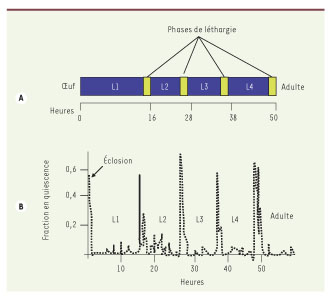
5]. Avant chacune des mues, l’animal rentre dans une phase de quiescence au cours de laquelle l’activité locomotrice est réduite et l’animal arrête de se nourrir (Figure 1). Les auteurs montrent que, durant cette période de léthargie, il y a une diminution des réponses aux stimulations mécaniques ou à des substances répulsives comme l’octanol-1. Mais si la stimulation est suffisamment forte, l’animal se remet à bouger à la même vitesse qu’un animal non léthargique. Une autre des caractéristiques du sommeil est une régulation homéostatique qui, en cas de privation de sommeil, entraîne une compensation au cours de la période de sommeil suivante qui est généralement plus profonde et plus prolongée. De façon remarquable, si l’on empêche C. elegans d’entrer en quiescence normalement au cours de la troisième mue, alors les seuils sensoriels pour les « réveiller » à la mue suivante sont plus élevés. L’ensemble de ces observations comportementales permettent d’établir une analogie entre la léthargie du nématode et le sommeil des mammifères.
 | Figure 1.
Léthargie chez C. elegans Le développement. post-embryonnaire de C. elegans passe par 4 stades larvaires (L1 à L4) (A). Chaque mue est précédée par une phase de léthargie (rectangles jaunes) durant laquelle les animaux sont quiescents (B) (adapté de [ 1]). |
|
Un seul neurone coordonnerait-il la léthargie de C. elegans ?
Quelles sont les bases cellulaires et moléculaires de ce comportement chez C. elegans ? Des travaux antérieurs avaient montré qu’une augmentation d’activité de la protéine kinase G (PKG) EGL-4 provoque chez l’animal adulte une suspension de l’activité locomotrice et de l’alimentation [
6–
8]. Raizen et al. démontrent que, comme durant les épisodes de léthargie physiologique, cette réduction d’activité chez les animaux mutants egl-4 s’accompagne d’une augmentation des seuils de réponse sensorielle, réversible après une stimulation forte par un stimulus indépendant. Réciproquement, une perte de fonction du gène egl-4 est responsable d’une diminution de la quiescence pendant les périodes de léthargie. Une étude récente menée en parallèle par Van Burskik et Sternberg [
9] révèle que l’activation de la voie EGF (epidermal growth factor) déclenche un état de léthargie chez le nématode. La surexpression de LIN-3, le seul facteur de croissance de type EGF présent chez C. elegans, induit un comportement de type léthargique. Cet effet requiert le récepteur de l’EGF, LET-23, et l’un de ses effecteurs, la phospholipase Cγ PLC-3, mais pas la voie Ras. Cet effet est supprimé par des mutations affectant la neurotransmission, suggérant que l’expression de l’EGF module une voie de signalisation neuronale. Le gène let-23 n’est exprimé chez C. elegans que dans quelques neurones, dont un interneurone appelé ALA, de fonction jusqu’alors inconnue. L’ablation de ce neurone rend les animaux insensibles à la surexpression de LIN-3. Cette étude montre également que le neurone ALA et la signalisation EGF/PLC-3 participent au déclenchement de la léthargie physiologique qui précède la mue. Le neurone ALA n’ayant que très peu de partenaires synaptiques, il pourrait jouer un rôle neuro-endocrine intégrateur pour cordonner les différents événements cellulaires nécessaires à la genèse de la léthargie chez le nématode. |
Pertinence de l’analogie entre léthargie de C. elegans
, sommeil des mouches et des mammifères
Existe-t-il une conservation évolutive du rôle de ces voies de signalisation ? Raizen et al. ont analysé l’effet de mutations du gène foraging qui code la PKG chez la drosophile [
10]. De façon similaire à ce qui est observé chez C. elegans, des mouches qui ont une activité PKG diminuée dorment moins que celles qui ont une activité PKG plus élevée. De plus, l’inhibition de la production d’EGF dans certains neurones de la pars intercerebralis du cerveau de la drosophile diminue les niveaux de sommeil alors que l’activation du récepteur EGF augmente le sommeil des mouches [
11]. De façon remarquable, la voie EGF a également été impliquée dans le contrôle du niveau d’éveil des mammifères [
12,
13]. L’infusion d’un membre de la famille EGF, le TGF-α, dans le noyau suprachiasmatique de hamsters adultes provoque une réduction de l’activité locomotrice et de l’alimentation. Réciproquement, des souris porteuses d’une perte de fonction du récepteur EGF sont spontanément plus actives que les animaux non mutés pendant les périodes diurnes. Établir des parallèles entre la léthargie des vers et le sommeil des insectes et des mammifères est tentant. Jusqu’où ces analogies sont-elles pertinentes ? Pour répondre à cette question, l’identification des bases cellulaires, et surtout moléculaires, des comportements de quiescence dans les systèmes modèles invertébrés permettra de tester une possible conservation entre phylums. C. elegans ne détient certainement pas la clé des songes. Mais peut-être sera-t-il possible de mettre en évidence une origine évolutive très ancienne du contrôle de l’activité des métazoaires, déclinée sous diverses formes au cours de la léthargie du ver et du sommeil des mammifères. Pourquoi s’interdire d’imaginer qu’il y a quelque 650 millions d’années notre dernier ancêtre commun somnolait entre deux eaux après un bon repas de micro-organismes. |
1. Raizen DM, Zimmerman JE, Maycock MH, et al. Lethargus is a Caenorhabditis elegans sleep-like state. Nature 2008; 451 : 569–72. 2. Greenspan RJ, Tononi G, Cirelli C, et al. Sleep and the fruit fly. Trends Neurosci 2001; 24 : 142–5. 3. Nicolau MC, Akaarir M, Gamundi A, et al. Why we sleep : the evolutionary pathway to the mammalian sleep. Prog Neurobiol 2000; 62 : 379–406. 4. Gally C, Bessereau JL. C. elegans : des neurones et des gènes. Med Sci (Paris) 2003; 19 : 725–34. 5. Cassada RC, Russell RL. The dauerlarva, a post-embryonic developmental variant of the nematode Caenorhabditis elegans. Dev Biol 1975; 46 : 326–42. 6. Avery L. The genetics of feeding in Caenorhabditis elegans. Genetics 1993; 133 : 897–917. 7. Fujiwara M, Sengupta P, McIntire SL. Regulation of body size and behavioral state of C. elegans by sensory perception and the EGL-4 cGMP-dependent protein kinase. Neuron 2002; 36 : 1091–102. 8. Raizen DM, Cullison KM, Pack AI, et al. A novel gain-of-function mutant of the cyclic GMP-dependent protein kinase egl-4 affects multiple physiological processes in Caenorhabditis elegans. Genetics 2006; 173 : 177–87. 9. Van Buskirk C, Sternberg PW. Epidermal growth factor signaling induces behavioral quiescence in Caenorhabditis elegans. Nat Neurosci 2007; 10 : 1300–7. 10. Osborne KA, Robichon A, Burgess E, et al. Natural behavior polymorphism due to a cGMP-dependent protein kinase of Drosophila. Science 1997; 277 : 834–6. 11. Foltenyi K, Greenspan RJ, Newport JW. Activation of EGFR and ERK by rhomboid signaling regulates the consolidation and maintenance of sleep in Drosophila. Nat Neurosci 2007; 10 : 1160–7. 12. Kramer A, Yang FC, Snodgrass P, et al. Regulation of daily locomotor activity and sleep by hypothalamic EGF receptor signaling. Science 2001; 294 : 2511–5. 13. Snodgrass-Belt P, Gilbert JL, Davis FC. Central administration of transforming growth factor-alpha and neuregulin-1 suppress active behaviors and cause weight loss in hamsters. Brain Res 2005; 1038:171–82. |