| |
| Med Sci (Paris). 2008 October; 24(10): 821–827. Published online 2008 October 15. doi: 10.1051/medsci/20082410821.Survivine en cancérologie Aspects moléculaires et applications thérapeutiques Mathilde Romagnoli,* Céline Séveno, Régis Bataille, and Sophie Barillé-Nion Inserm, Université de Nantes, UMR 892, Département de recherche en cancérologie 9 quai Moncousu, 44093 Nantes, France |
Découverte il y a 10 ans [
1], Survivine a rapidement attiré l’attention de la communauté scientifique par sa biologie fascinante et son potentiel thérapeutique en cancérologie. Conservée au cours de l’évolution, Survivine appartient à la famille des IAP (inhibitors of apoptosis proteins), définie par le domaine structurel BIR caractérisé à l’origine chez le baculovirus pour son rôle dans la protection vis-à-vis de l’apoptose. Chez les mammifères, Survivine fut initialement décrite comme importante pour la survie des cellules cancéreuses, ce qui lui valut son nom. Survivine se place en fait au carrefour de la régulation de processus cellulaires essentiels : cycle et mort cellulaires. La majorité des tumeurs, solides ou hématopoïétiques, l’exprime de façon aberrante et des études génomiques l’ont rapidement identifiée comme le quatrième gène le plus fréquent et abondant dans les tumeurs [
2]. Survivine possède également un rôle physiologique majeur lors du développement, aucune souris dépourvue de cette protéine ne survivant au-delà du cinquième jour embryonnaire [
3]. En revanche, Survivine n’est pas ou peu exprimée dans les tissus différenciés adultes. En cancérologie, de nombreuses études démontrent l’intérêt pronostique de Survivine, et son expression préférentielle dans les tumeurs en fait une cible thérapeutique attractive, actuellement en cours d’évaluation clinique. Dans cet article, nous aborderons les causes et les conséquences de l’expression aberrante de Survivine dans les cellules tumorales. Nous ferons le bilan des mécanismes moléculaires de Survivine qui participent au cycle cellulaire, et détaillerons ceux encore en cours d’exploration, impliqués dans la résistance à l’apoptose. Les fonctions multiples de Survivine la projettent au cœur d’un réseau fonctionnel pro-tumoral et la désignent comme une cible thérapeutique particulièrement pertinente dans le cancer [
4]. Nous évoquerons donc son intérêt pronostique en cancérologie et les applications thérapeutiques qui découlent des nombreux travaux de recherche menés depuis 10 ans. |
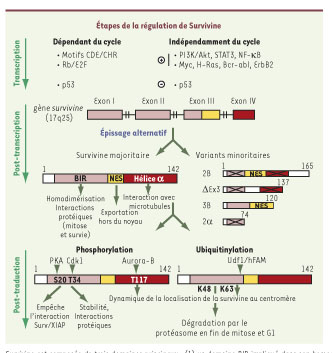
Survivine dans les cancers : les causes de sa surexpression Survivine est une petite protéine de 16,5 kDa, à la demi-vie courte (30 minutes) et composée de trois domaines principaux : un domaine BIR de localisation amino-terminale, une extrémité carboxy-terminale en hélice α et, entre les deux, un domaine NES (nuclear export sequence) d’exportation hors du noyau (Figure 1). L’étude de son promoteur a fourni de nombreuses informations sur la régulation du gène. Tout d’abord, les régions CDE/CHR qui sont des séquences consensus impliquées dans la régulation transcriptionnelle liée au cycle cellulaire, participent à la modulation de l’expression de Survivine au cours du cycle cellulaire. Ainsi, dans les cellules normales, l’expression de Survivine est indétectable en G1, apparaît en S, puis culmine en phase G2/M en relation directe avec sa fonction de régulateur mitotique. La voie Rb/E2F participe également à la régulation de son expression, notamment lors de l’entrée en cycle ou de la transition G1/S. Cependant, dans les cellules tumorales, Survivine est exprimée de manière aberrante, indépendamment du cycle cellulaire [
5]. En effet, d’une part, l’expression de Survivine est induite par de nombreuses voies de signalisation (STAT3, PI3K, NF-κB) ou oncogènes (Myc, ErbB2…) fréquemment dérégulés ou amplifiés dans les cancers. D’autre part, son expression n’est plus réprimée par des suppresseurs de tumeur souvent non fonctionnels dans les cellules cancéreuses (p53, Rb). Des anomalies génétiques (amplification [
6]) et épigénétiques (hypométhylation [
7]) du gène survivine peuvent également être à l’origine de sa surexpression. Quatre variants (2B, ∆Ex3, 3B et 2α) de Survivine obtenus par épissage alternatif ont été décrits, mais ils sont exprimés à des niveaux nettement inférieurs à ceux de Survivine. Une étude récente montre que seul le variant 3B possède des propriétés biologiques proches de celles de Survivine, le rôle précis des autres variants reste à définir [
8]. Enfin, des mécanismes post-traductionnels régulent la stabilité de la protéine : (1) phosphorylation en T34 par Cdk1 au cours des phases G2/M [
9], et (2) polyubiquitinylation sur plusieurs de ses résidus lysines (Survivine en possède 16) à travers des liaisons K48 permettant sa dégradation par le protéasome en fin de mitose [
10], processus inhibé par son interaction avec Hsp90 [
11]. Ces différents mécanismes entraînent une expression soutenue de Survivine dans les cellules cancéreuses indépendamment du cycle cellulaire, leur procurant un avantage de croissance (mitose et survie) [5].
 | Figure 1.
Régulation de l’expression de Survivine. Dans les cellules normales, la transcription du gène survivine est dépendante du cycle cellulaire grâce à ses motifs CDE/CHR et la voie Rb/E2F. Dans les cellules tumorales, son expression aberrante indépendante du cycle cellulaire est soutenue par diverses voies de signalisation ou oncogènes [voies activatrices (+)], et n’est plus réprimée par des suppresseurs de tumeur [voies répressives (-)]. Les exons 1, 2 et une partie du 3 codent pour le domaine BIR tandis que l’exon 4 code pour l’extrémité en hélice α. L’ARNm survivine peut subir un épissage alternatif, les variants 2B, ∆Ex3, 3B et 2α obtenus sont minoritaires par rapport à Survivine. L’introduction d’un exon 2B ou l’excision de l’exon 3 conduisent à la formation d’un domaine BIR tronqué et donc non fonctionnel (domaine barré) dans les variants 2B et ∆Ex3 respectivement. De plus, ces modifications d’épissage perturbent le cadre de lecture et donc affectent probablement la fonctionnalité de l’hélice α (domaine barré). L’introduction d’un exon 2α ou d’un exon 3B introduit un codon stop qui conduit à un domaine BIR tronqué dans le variant 2α et une absence d’hélice α dans le variant 3B respectivement. En effet, Survivine est composée de trois domaines principaux : (1) un domaine BIR impliqué dans son homodimérisation, ses interactions avec les membres du CPC (chromosomal passenger complex) lors de la mitose et diverses protéines lors de l’apoptose, (2) une séquence d’exportation hors du noyau (NES) et (3) une extrémité carboxy-terminale en hélice α impliquée dans son interaction avec les microtubules. Enfin, au niveau post-traductionnel, Survivine peut être modifiée : phosphorylations et/ou ubiquitinylations. Survivine porte trois sites de phosphorylation qui peuvent moduler ses interactions protéiques et localisations. Survivine est entraînée vers le protéasome après sa polyubiquitinylation via des liaisons K48, au contraire de sa polyubiquitinylation via des liaisons K63 modulée par Udf1/hFAM qui intervient dans sa localisation au centromère. |
|
Son rôle dans le déroulement du cycle cellulaire Survivine est un régulateur important de la mitose. En effet, elle intervient en tant que membre du complexe CPC (chromosomal passenger complex) avec les deux autres protéines, INCENP et boréaline, régulatrices de la kinase mitotique Aurora-B (pour revue, voir [
12,
54](→)). Le CPC est localisé au niveau des chromosomes en prophase, des centromères en métaphase, des cortex et fuseau équatoriaux en anaphase et du pont intercellulaire en télophase. Il assure le déroulement correct de la mitose : régulation de la structure des chromosomes et du fuseau mitotique, ségrégation correcte des chromatides sœurs et achèvement de la cytodiérèse. Lors du point de contrôle de l’assemblage du fuseau mitotique en métaphase, le CPC contrôle la tension de l’attachement des chromosomes au fuseau mitotique. Survivine est fortement impliquée dans la localisation du CPC, aussi bien dans les cellules normales que tumorales. Sa phosphorylation en T117 par Aurora-B [
13] et sa polyubiquitinylation via des liaisons de type K63 (sans impact sur sa dégradation par le protéasome) [
14] régulent la dynamique de sa localisation au centromère. INCENP et boréaline interviennent elles aussi dans la localisation du CPC [
15].
(→) Voir l’article de Marlène Delacour-Larose et al.
, page 828 de ce numéro
En plus de son rôle canonique dans la mitose, Survivine intervient lors de la transition G1/S. En effet, elle est nécessaire à l’entrée en cycle des cellules murines normales, comme les précurseurs hématopoïétiques exposés aux cytokines ou les lymphocytes T lors de leur activation. De plus, dans les cellules tumorales, Survivine forcerait la transition G1/S en l’absence de facteurs de croissance, en déplaçant les inhibiteurs des Cdk (p16INK4a, p21Cip et p27Kip1) des complexes Cycline-Cdk [
16]. Nous avons ainsi observé que la survivine permet la croissance des cellules myélomateuses humaines en l’absence d’interleukine-6, leur facteur majeur de croissance (manuscrit soumis). |
Un dialogue entre cycle cellulaire et survie Survivine assurerait le lien entre prolifération et survie au cours du cycle. En effet, dans les cellules tumorales en cycle, Survivine étant à son niveau d’expression maximal, elle peut agir à la fois dans le déroulement correct de la mitose et dans le blocage de la « catastrophe » mitotique (apoptose durant la mitose) à un moment où la cellule cancéreuse est fragilisée par son instabilité chromosomique. Dès la phase G2, le complexe Cycline B1-Cdk1 phosphoryle Survivine en T34 situé dans le domaine BIR, favorisant des interactions protéiques impliquées dans la séquestration d’acteurs majeurs de l’apoptose : la caspase-3 avec p21Cip dans les centrosomes [
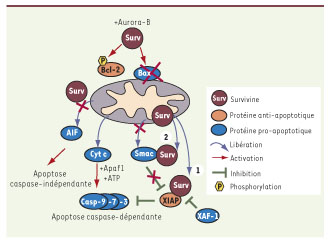
17], et la caspase-9 au niveau des microtubules [9]. De plus, le complexe Survivine-Aurora-B est impliqué dans la régulation des protéines de la famille Bcl-2 au cours de la mitose, notamment en phosphorylant la protéine anti-apoptotique Bcl-2 et inactivant la protéine pro-apoptotique Bax. Cela maintiendrait l’intégrité de la mitochondrie nécessaire à la survie de la cellule tumorale [
18] (Figure 2). Enfin, la kinase Chk2, activée lors d’un dommage à l’ADN pour bloquer le cycle cellulaire afin de permettre la réparation de l’ADN, interviendrait également dans la libération d’une fraction mitochondriale de survivine spécialisée dans le blocage de l’apoptose (voir le paragraphe « Lien entre localisation subcellulaire et blocage de l’apoptose ») [
19]. La fonction de Survivine dans la survie au cours de la mitose semble particulièrement importante dans les cellules cancéreuses qui ont une activité proliférative soutenue [
20].
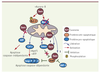 | Figure 2.
Rôle de Survivine dans le blocage de l’apoptose mitochondriale. En amont de la mitochondrie, dans les cellules en mitose, le complexe Survivine-Aurora-B semble contrôler la stabilisation de la protéine anti-apoptotique Bcl-2 par sa phosphorylation et la diminution de l’activation de la protéine pro-apoptotique Bax. Au niveau de la mitochondrie, Survivine inhibe la libération des facteurs Smac et AIF, impliqués dans l’apoptose caspase-dépendante et indépendante respectivement. En aval de la mitochondrie, Survivine, elle-même relarguée à partir de la mitochondrie lors d’un stress cellulaire : (1) forme un complexe avec XIAP pour le stabiliser et favoriser son rôle d’inhibiteur direct des caspases et (2) neutralise Smac, un inhibiteur de XIAP. XAF-1, autre inhibiteur de XIAP, inhibe le complexe survivine/XIAP. |
|
Survivine contre la mort cellulaire L’activité anti-apoptotique de Survivine est largement démontrée aussi bien dans les cellules cancéreuses par l’utilisation d’antagonistes moléculaires (antisens, ARN interférence…) in vitro et in vivo que dans les cellules normales par des modèles d’animaux hétérozygotes survivine+/-. Cette activité est essentielle au cours de la mitose et l’est aussi au cours de l’interphase, particulièrement dans les cellules cancéreuses qui expriment Survivine de façon aberrante indépendamment du cycle. Cependant, les mécanismes moléculaires impliqués ne sont pas totalement élucidés et de nombreux travaux essaient de les identifier actuellement. Malgré la présence d’un domaine BIR, des études à la fois structurelles et biochimiques éliminent définitivement l’hypothèse selon laquelle Survivine pourrait se lier de façon stable aux caspases et les inhiber directement comme cela est clairement démontré pour XIAP (X-linked inhibitor of apoptosis protein), membre de la famille des IAP et puissant inhibiteur direct des caspases. Survivine inhiberait les caspases de façon indirecte avec l’aide d’autres partenaires [
21]. De plus, Survivine bloquerait la mort cellulaire indépendante des caspases notamment en inhibant la libération du facteur mitochondrial pro-apoptotique AIF [
22] (Figure 2). Enfin, Survivine participerait aussi à la survie en régulant les processus de réparation de l’ADN et le métabolisme cellulaire en réponse à un stress [
23]. |
Survivine préfère la coopération dans le blocage de l’apoptose L’étude de « l’interactome » de Survivine ouvre un champ riche d’investigations [
24]. Le domaine BIR de Survivine lui permet de former des homodimères et d’interagir avec plusieurs partenaires moléculaires impliqués eux-mêmes dans le contrôle de l’apoptose (Figure 2). D’une part, Survivine favorise l’activité anti-apoptotique de XIAP par deux mécanismes : (1) le complexe survivine/XIAP protège ce dernier de sa dégradation par le protéasome [
25] ; (2) Survivine neutralise Smac, un inhibiteur de XIAP libéré par la mitochondrie au cours de l’apoptose [
26]. Cependant, l’activité anti-apoptotique du complexe Survivine/XIAP peut être contrecarrée par XAF-1, autre inhibiteur de XIAP, qui entraîne la dégradation de Survivine [
27]. D’autre part, Survivine pourrait participer à la régulation de la perméabilité mitochondriale en interagissant avec Bax, un complexe observé dans les cellules myélomateuses (données personnelles). Enfin, Survivine semble impliquée dans l’installation d’un environnement permissif pro-oncogénique associé à l’adaptation aux stress cellulaires en formant des complexes stables avec la protéine chaperonne Hsp90 [11,
28], ou encore avec HBXIP (hepatitis B X-interacting protein) du virus de l’hépatite B impliqué dans les cancers du foie [
29]. |
Lien entre localisation subcellulaire et blocage de l’apoptose La localisation subcellulaire de Survivine et sa fonction sont étroitement liées. En effet, il a été montré que l’exportation de Survivine hors du noyau, grâce notamment au transporteur Crm1/Exportine1, était indispensable à son activité anti-apoptotique dans les cellules interphasiques [
30]. De plus, une fraction de Survivine située dans l’espace intermembranaire de la mitochondrie a été spécifiquement identifiée dans des lignées tumorales [
31]. Bien que Survivine ne possède pas de séquence d’import mitochondrial, son association avec Hsp90 pourrait lui permettre d’entrer dans la mitochondrie [11]. Dans ce compartiment, Survivine séquestrerait Smac en l’empêchant d’être libéré lors de l’apoptose [
32]. Survivine mitochondriale pourrait aussi être libérée dans le cytoplasme au cours de l’apoptose et ainsi interagir avec XIAP pour le stabiliser. La mitochondrie serait alors un passage important pour Survivine car elle y est déphosphorylée en S20, une modification essentielle pour son interaction avec XIAP [
33] (Figures 1 et 2). Ainsi, lors d’un stress cellulaire, la libération de Survivine mitochondriale limiterait l’amplification du processus apoptotique. Cette localisation confère donc un avantage aux cellules tumorales vis-à-vis de l’apoptose, et ceci indépendamment du cycle cellulaire. |
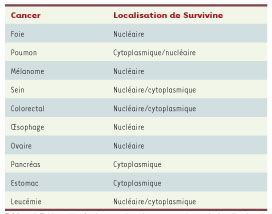
Survivine : un bon marqueur pronostique ? Plusieurs modèles animaux transgéniques comme celui du mélanome soulignent l’importance de Survivine dans la prédisposition à l’apparition de cancers [
34]. En clinique humaine, l’expression aberrante de Survivine dans les tumeurs a fait l’objet de nombreuses études qui ont montré sa corrélation avec la progression de la maladie et un pronostic défavorable (pour revue, voir [
35]). Nous avons également observé cette corrélation dans le myélome multiple [
36]. Néanmoins, ce pronostic diffère selon que la localisation de Survivine est cytoplasmique ou nucléaire (Tableau I) et aucune donnée n’est encore disponible sur la valeur prédictive de Survivine mitochondriale. Des études complémentaires utilisant des protocoles standardisés devront être réalisées pour conclure sur ce sujet.
 | Tableau I.
Tableau des études associant la surexpression et la localisation de Survivine à un mauvais pronostic (d’après [35]).
|
Certaines études se sont également attachées à étudier le rôle de Survivine en tant que marqueur prédictif de l’efficacité des thérapies anti-tumorales (pour revue, voir [
37]). Des études in vitro montrent que Survivine est fortement exprimée dans des lignées cellulaires radio- ou chimio-résistantes. Chez les patients, l’expression aberrante de Survivine est ainsi corrélée à la résistance au taxol pour les carcinomes ovariens ou au cisplatine pour les cancers de l’estomac et de la vessie. Elle est également associée à une résistance aux traitements hormonaux dans les cancers du sein et de la prostate. De plus, l’expression de Survivine est induite par des traitements anti-cancéreux tels que le cisplatine. Survivine jouerait donc un rôle dans la résistance aux traitements à la fois de novo et acquise. En plus de son intérêt pronostique, Survivine semble également utilisable en clinique en tant que biomarqueur urinaire dans le cancer de la vessie [
38] et indicateur de rechute dans le cancer du sein [
39]. |
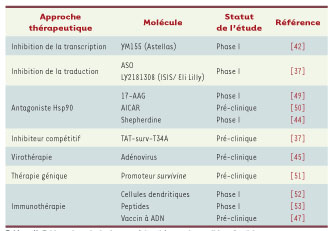
Survivine : une cible thérapeutique prometteuse L’expression préférentielle de Survivine dans les tissus tumoraux en fait une cible thérapeutique potentielle particulièrement pertinente (Tableau II). De plus, Survivine étant également exprimée par les cellules endothéliales lors de l’angiogenèse [
40], son inhibition permettrait de cibler aussi bien la tumeur que les néovaisseaux qui lui sont associés.
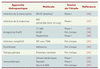 | Tableau II.
Tableau des principales stratégies thérapeutiques ciblant Survivine.
|
Plusieurs inhibiteurs ciblant l’expression ou la fonction de Survivine sont actuellement en cours de développement clinique (pour revue, voir [
41]). Récemment, la molécule YM155, issue du criblage d’une chimiothèque pour son activité inhibitrice directe de la transcription du gène survivine, a permis d’induire une régression tumorale importante chez des patients au cours d’essais de phase I [
42]. Par ailleurs, l’inhibition de la traduction de Survivine permettrait d’obtenir une augmentation de l’apoptose spontanée, une sensibilisation aux radiations et à différentes drogues in vitro (cisplatine, étoposide) ainsi qu’une inhibition de la croissance tumorale in vivo, comme nous l’avons notamment observé dans le myélome multiple [36]. En se fondant sur ces résultats, un oligonucléotide antisens (ASO) vient d’être testé avec succès dans un essai clinique de phase I, et la phase II a été annoncée. Enfin, plusieurs inhibiteurs de l’interaction Hsp90/Survivine [28] ont également été produits (17-AAG, AICAR, shepherdine). Ces molécules libèrent les « protéines-clientes » d’Hsp90 [
43], et particulièrement Survivine, déclenchant alors leur dégradation et induisant l’apoptose dans les cellules cancéreuses comme cela a été clairement démontré pour la shepherdine [
44]. L’association d’inhibiteurs de Survivine à des traitements anti-cancéreux conventionnels et leur administration éventuellement séquentielle pourraient améliorer les protocoles thérapeutiques anti-anticancéreux existants. Survivine est également la cible de thérapies géniques et cellulaires innovantes (pour revue, voir [37]). Ainsi, une molécule de fusion entre la protéine TAT du VIH et le dominant négatif T34A de Survivine a été testée avec succès dans un modèle pré-clinique de mélanome. Des études ont également tiré parti de l’expression tissulaire restreinte de Survivine pour induire une apoptose spécifique grâce à des virus oncolytiques. Cette technique qui consiste à induire un cycle lytique viral dans les cellules ayant le promoteur survivine actif, a permis d’obtenir une forte inhibition de la croissance tumorale dans des modèles de cancer du poumon et de gliome chez la souris [
45]. La surexpression de Survivine dans les tumeurs en fait également un antigène de choix pour des protocoles d’immunothérapie et de vaccination (pour revue, voir [41]). Des lymphocytes T CD8+ cytotoxiques dirigés contre des épitopes de Survivine ont été détectés dans le sang de patients atteints de mélanome ou de myélome multiple [
46], et un protocole de vaccination (phase I) a permis d’observer une régression tumorale transitoire. Un vaccin à ADN utilisant des bactéries atténuées exprimant Survivine a également permis d’observer une apoptose tumorale ainsi qu’une inhibition de la néo-angiogenèse chez la souris [
47]. Enfin, la persistance dans le temps de la réponse anti-Survivine indique qu’une vaccination à long terme pourrait s’avérer efficace dans la prévention des rechutes [
48]. |
Survivine est au cœur de processus cellulaires complexes et ses propriétés biologiques sont particulièrement exploitées par les tumeurs, qui l’expriment fréquemment à des niveaux aberrants et pour lesquelles une « addiction » à celle-ci est souvent observée. Ces arguments font de Survivine une cible prometteuse des thérapies anti-tumorales, et les essais pré-cliniques et cliniques la ciblant montrent une efficacité significative sans effet secondaire majeur. Néanmoins, le rôle physiologique de Survivine dans l’hématopoïèse et le système immunitaire suggère qu’une utilisation prolongée des inhibiteurs de Survivine pourrait s’avérer délétère. Un suivi sera donc nécessaire pour trancher définitivement la question de l’innocuité de l’inhibition de Survivine en cancérologie. C’est pourquoi, il est important d’approfondir nos connaissances sur les fonctions et les mécanismes d’action de cette protéine qui, en 10 ans, a montré de multiples facettes. Les prochaines études montreront peut-être que la cellule souche tumorale tant convoitée exprime Survivine. Ainsi, des thérapies ciblant Survivine seraient capables d’atteindre à la fois la masse tumorale, les néovaisseaux associés ainsi que la cellule souche tumorale qui alimente la tumeur.

|
Nous remercions pour leur soutien : la Ligue Contre le Cancer (équipe labellisée), l’Institut National du Cancer (contrat C. Séveno) et la Société Française d’Hématologie (contrat M. Romagnoli).
|
1. Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med 1997; 3 : 917–21. 2. Velculescu VE, Madden SL, Zhang L, et al. Analysis of human transcriptomes. Nat Genet 1999; 23 : 387–8. 3. Uren AG, Wong L, Pakusch M, et al. Survivin and the inner centromere protein INCENP show similar cell-cycle localization and gene knockout phenotype. Curr Biol 2000; 10 : 1319–28. 4. Altieri DC. Survivin, cancer networks and pathway-directed drug discovery. Nat Rev Cancer 2008; 8 : 61–70. 5. Xia F, Altieri DC. Mitosis-independent survivin gene expression in vivo and regulation by p53. Cancer Res 2006; 66 : 3392–5. 6. Islam A, Kageyama H, Takada N, et al. High expression of Survivin, mapped to 17q25, is significantly associated with poor prognostic factors and promotes cell survival in human neuroblastoma. Oncogene 2000; 19 : 617–23. 7. Hattori M, Sakamoto H, Satoh K, Yamamoto T. DNA demethylase is expressed in ovarian cancers and the expression correlates with demethylation of CpG sites in the promoter region of c-erbB-2 and survivin genes. Cancer Lett 2001; 169 : 155–64. 8. Knauer SK, Bier C, Schlag P, et al. The survivin isoform survivin-3B is cytoprotective and can function as a chromosomal passenger complex protein. Cell Cycle 2007; 6 : 1502–9. 9. O’Connor DS, Grossman D, Plescia J, et al. Regulation of apoptosis at cell division by p34cdc2 phosphorylation of survivin. Proc Natl Acad Sci USA 2000; 97 : 13103–7. 10. Zhao J, Tenev T, Martins LM, et al. The ubiquitin-proteasome pathway regulates survivin degradation in a cell cycle-dependent manner. J Cell Sci 2000; 113 : 4363–71. 11. Fortugno P, Beltrami E, Plescia J, et al. Regulation of survivin function by Hsp90. Proc Natl Acad Sci USA 2003; 100 : 13791–6. 12. Ruchaud S, Carmena M, Earnshaw WC. Chromosomal passengers: conducting cell division. Nat Rev Mol Cell Biol 2007; 8 : 798–812. 13. Delacour-Larose M, Thi MN, Dimitrov S, Molla A. Role of survivin phosphorylation by aurora B in mitosis. Cell Cycle 2007; 6 : 1878–85. 14. Vong QP, Cao K, Li HY, et al. Chromosome alignment and segregation regulated by ubiquitination of survivin. Science 2005; 310 : 1499–504. 15. Jeyaprakash AA, Klein UR, Lindner D, et al. Structure of a Survivin-Borealin-INCENP core complex reveals how chromosomal passengers travel together. Cell 2007; 131 : 271–85. 16. Suzuki A, Hayashida M, Ito T, et al. Survivin initiates cell cycle entry by the competitive interaction with Cdk4/p16(INK4a) and Cdk2/cyclin E complex activation. Oncogene 2000; 19 : 3225–34. 17. Li F, Ackermann EJ, Bennett CF, et al. Pleiotropic cell-division defects and apoptosis induced by interference with survivin function. Nat Cell Biol 1999; 1 : 461–6. 18. Vogel, C, Hager C, Bastians H. Mechanisms of mitotic cell death induced by chemotherapy-mediated G2 checkpoint abrogation. Cancer Res 2007; 67 : 339–45. 19. Ghosh JC, Dohi T, Raskett CM, et al. Activated checkpoint kinase 2 provides a survival signal for tumor cells. Cancer Res 2006; 66 : 11576–9. 20. Blanchard JM. Des oncogènes aux régulateurs de la mitose: un changement de perspective dans notre vision des processus cancéreux. Med Sci (Paris) 2003; 19 : 187–99. 21. Verdecia MA, Huang H, Dutil E, et al. Structure of the human anti-apoptotic protein survivin reveals a dimeric arrangement. Nat Struct Biol 2000; 7 : 602–8. 22. Liu, T, Brouha B, Grossman D. Rapid induction of mitochondrial events and caspase-independent apoptosis in Survivin-targeted melanoma cells. Oncogene 2004; 23 : 39–48. 23. Chakravarti A, Zhai GG, Zhang M, et al. Survivin enhances radiation resistance in primary human glioblastoma cells via caspase-independent mechanisms. Oncogene 2004; 23 : 7494–506. 24. Laudet B, Prudent R, Filhol O, Cochet C. Des agents thérapeutiques ciblant des interactions protéine-protéine : mythe ou réalité ? Med Sci (Paris) 2007; 23 : 273–8. 25. Dohi T, Okada K, Xia F, et al. An IAP-IAP complex inhibits apoptosis. J Biol Chem 2004; 279 : 34087–90. 26. Song, Z, Yao X, Wu M. Direct interaction between survivin and Smac/DIABLO is essential for the anti-apoptotic activity of survivin during taxol-induced apoptosis. J Biol Chem 2003; 278 : 23130–40. 27. Arora V, Cheung HH, Plenchette S, et al. Degradation of survivin by the X-linked inhibitor of apoptosis (XIAP)-XAF1 complex. J Biol Chem 2007; 282 : 26202–9. 28. Didelot C, Garrido C. HSP90 mitochondriale : la cible à inactiver dans la thérapie anti-cancéreuse ? Med Sci (Paris) 2008; 24 : 363–4. 29. Marusawa H, Matsuzawa S, Welsh K, et al. HBXIP functions as a cofactor of survivin in apoptosis suppression. EMBO J 2003; 22 : 2729–40. 30. Colnaghi R, Connell CM, Barrett RM, Wheatley SP. Separating the anti-apoptotic and mitotic roles of survivin. J Biol Chem 2006; 281 : 33450–6. 31. Dohi T, Beltrami E, Wall NR, et al. Mitochondrial survivin inhibits apoptosis and promotes tumorigenesis. J Clin Invest 2004; 114 : 1117–27. 32. Ceballos-Cancino G, Espinosa M, Maldonado V, et al. Regulation of mitochondrial Smac/DIABLO-selective release by survivin. Oncogene 2007; 26 : 7569–75. 33. Dohi T, Xia F, Altieri DC. Compartmentalized phosphorylation of IAP by protein kinase A regulates cytoprotection. Mol Cell 2007; 27 : 17–28. 34. Thomas J, Liu T, Cotter MA, et al. Melanocyte expression of survivin promotes development and metastasis of UV-induced melanoma in HGF-transgenic mice. Cancer Res 2007; 67 : 5172–8. 35. Fukuda S, Pelus LM. Survivin, a cancer target with an emerging role in normal adult tissues. Mol Cancer Ther 2006; 5 : 1087–98. 36. Romagnoli M, Trichet V, David C, et al. Significant impact of survivin on myeloma cell growth. Leukemia 2007; 21 : 1070–8. 37. Pennati M, Folini M, Zaffaroni N. Targeting survivin in cancer therapy: fulfilled promises and open questions. Carcinogenesis 2007; 28 : 1133–9. 38. Kenney DM, Geschwindt RD, Kary MR, et al. Detection of newly diagnosed bladder cancer, bladder cancer recurrence and bladder cancer in patients with hematuria using quantitative rt-PCR of urinary survivin. Tumour Biol 2007; 28 : 57–62. 39. Yie SM, Luo B, Ye NY, et al. Detection of Survivin-expressing circulating cancer cells in the peripheral blood of breast cancer patients by a RT-PCR ELISA. Clin Exp Metastasis 2006; 23 : 279–89. 40. Mesri M, Morales-Ruiz M, Ackermann EJ, et al. Suppression of vascular endothelial growth factor-mediated endothelial cell protection by survivin targeting. Am J Pathol 2001; 158 : 1757–65. 41. Altieri DC. Targeted therapy by disabling crossroad signaling networks: the survivin paradigm. Mol Cancer Ther 2006; 5 : 478–82. 42. Tolcher. A phase I study of YM155, a novel survivin suppressant, administered by 168 hour continuous infusion to patients with advanced solid tumors. Atlanta, USA : American Society of Clinical Oncology, 2006. 43. Arrigo AP. Chaperons moléculaires et repliement des protéines : l’exemple de certaines protéines de choc thermique. Med Sci (Paris) 2005; 21 : 619–25. 44. Plescia J, Salz W, Xia F, et al. Rational design of shepherdin, a novel anticancer agent. Cancer Cell 2005; 7 : 457–68. 45. Li B, Liu X, Fan J, et al. A survivin-mediated oncolytic adenovirus induces non-apoptotic cell death in lung cancer cells and shows antitumoral potential in vivo. J Gene Med 2006; 8 : 1232–42. 46. Grube M, Moritz S, Obermann EC, et al. CD8+ T cells reactive to survivin antigen in patients with multiple myeloma. Clin Cancer Res 2007; 13 : 1053–60. 47. Xiang R, Mizutani N, Luo Y, et al. A DNA vaccine targeting survivin combines apoptosis with suppression of angiogenesis in lung tumor eradication. Cancer Res 2005; 65 : 553–61. 48. Hadrup SR, Gehl J, Sørensen RB, et al. Persistence of survivin specific T cells for seven years in a melanoma patient during complete remission. Cancer Biol Ther 2006; 5 : 480–2. 49. Sausville EA, Tomaszewski JE, Ivy. Clinical development of 17-allylamino, 17-demethoxygeldanamycin. Curr Cancer Drug Targets 2003; 3 : 377–83. 50. Meli M, Pennati M, Curto M, et al. Small-molecule targeting of heat shock protein 90 chaperone function: rational identification of a new anticancer lead. J Med Chem 2006; 49 : 7721–30. 51. Chen JS, Liu JC, Shen L, et al. Cancer-specific activation of the survivin promoter and its potential use in gene therapy. Cancer Gene Ther 2004; 11 : 740–7. 52. Otto K, Andersen MH, Eggert A, et al. Lack of toxicity of therapy-induced T cell responses against the universal tumour antigen survivin. Vaccine 2005; 23 : 884–9. 53. Tsuruma T, Hata F, Torigoe T, et al. Phase I clinical study of anti-apoptosis protein, survivin-derived peptide vaccine therapy for patients with advanced or recurrent colorectal cancer. J Transl Med 2004; 2 : 19. 54. Delacour-Larose M, Nhung Hoang TM, Molla A. Survivine, la petite reine du complexe passager : check-up pour son dixième anniversaire. Med Sci (Paris) 2008; 24 : 828–32. |