| |
| Med Sci (Paris). 2008 November; 24(11): 972–976. Published online 2008 November 15. doi: 10.1051/medsci/20082411972.Les cellules Th17 Une nouvelle population de cellules T CD4 effectrices pro-inflammatoires Stéphane Leung-Theung-Long* and Sylvie Guerder Inserm, U563, Université Toulouse III Paul-Sabatier, Centre de Physiopathologie de Toulouse Purpan, CHU Purpan, Bâtiment A, BP 3028, Place du Docteur Baylac, 31024 Toulouse Cedex, France |
Le paradigme Th1/Th2 et ses paradoxes En réponse à une stimulation antigénique, les cellules T CD4 naïves prolifèrent et se différencient en cellules T effectrices qui se distinguent par leur production de cytokines et leurs fonctions. En 1986, Tim Mosmann et al. proposèrent un modèle de différenciation des cellules T CD4 qui permettait de relier la fonction des effecteurs T CD4 et la nature de la réponse immunitaire induite, réponse à médiation cellulaire ou humorale. Ces travaux pionniers et de nombreuses études ultérieures ont permis de classifier les cellules T effectrices en deux catégories, les cellules Th1 (T helper) et Th2, qui sont issues d’une différenciation terminale de précurseurs T CD4 naïfs. Les cellules Th1 produisent principalement de l’IFNγ (interféron γ) alors que les cellules Th2 produisent essentiellement de l’IL-4 (interleukine-4), de l’IL-5 et de l’IL-13. Grâce à leurs caractéristiques fonctionnelles, les cellules Th1 activent les fonctions bactéricides des macrophages et peuvent détruire les cellules infectées (via FasL, TRAIL) et par conséquent sont efficaces dans le contrôle des pathogènes intracellulaires et induisent une hypersensibilité retardée. Inversement, les cellules Th2 favorisent la commutation isotypique et la production d’IgG1, IgE et IgA qui sont importantes dans le contrôle de certains pathogènes extracellulaires et des helminthes. Cette dichotomie est aussi associée à des pathologies du système immunitaire. Ainsi, chez l’Homme et chez la souris, l’asthme allergique résulte de réponses Th2 exacerbées. En revanche, de nombreuses études suggéraient que le développement de pathologies auto-immunes telles que l’encéphalomyélite auto-immune expérimentale (EAE), le diabète autoimmun (IDDM) ou l’arthrite rhumatoïde (RA) résultait d’une activation incontrôlée d’effecteurs Th1 spécifiques d’antigènes du « soi ». Le rôle critique attribué aux effecteurs Th1 reposait sur l’observation d’un recrutement de cellules Th1 et non Th2 dans les organes cibles de la pathologie, et de l’induction de la pathologie après transfert à des souris des clones autoréactifs Th1, mais pas Th2. Par ailleurs, l’administration d’IL-12, une cytokine qui favorise le développement d’effecteurs Th1 et inhibe la différenciation Th2, augmente la sévérité et l’incidence de maladies comme le diabète ou l’EAE. À l’opposé, des souris génétiquement déficientes pour l’IL-12 après l’ablation génique de la chaîne IL-12p40, sont résistantes à ces pathologies auto-immunes. Néanmoins, des souris déficientes pour la chaîne IL-12p35, exprimant aussi une perte d’expression de l’IL-12 et un défaut de différenciation Th1, développent l’EAE. De même, des souris déficientes pour l’IFNγ, le récepteur de l’IFNγ ou le facteur de transcription STAT1, essentiel à la différenciation Th1, sont susceptibles à l’EAE [
1,
2]. En revanche, des souris déficientes pour Tbet, le facteur de transcription initiateur de la différenciation Th1, ou STAT4, le facteur de transcription intervenant en aval du récepteur de l’IL-12, sont résistantes à l’EAE [1,
3]. Il était difficile de concilier les conclusions de ces différents résultats avec un rôle direct des cellules Th1 dans ces pathologies auto-immunes. La découverte de l’IL-23 a permis de résoudre certains de ces paradoxes [
4]. |
Découverte des cellules Th17 L’IL-23 fait partie de la famille des cytokines hétérodimériques IL-6/IL-12 (Figure 1). Elle est constituée de la chaîne p19, homologue à la chaîne IL-12p35, et de la chaîne IL-12p40 qu’elle partage avec l’IL-12. Ainsi, les souris invalidées pour la chaîne IL-12p40, résistantes à l’EAE sont déficientes à la fois pour l’IL-12 et l’IL-23, alors que l’invalidation de la chaîne IL-12p35, qui est associée à une susceptibilité accrue à l’EAE, induit uniquement la perte d’IL-12. Ces observations suggéraient donc un rôle essentiel de l’IL-23 et non de l’IL-12 dans le développement de l’EAE, rôle qui fut confirmé par la démonstration que des souris invalidées pour la chaîne IL-23p19 sont résistantes à l’EAE [
5]. Les mêmes résultats étaient obtenus dans un modèle murin de RA induit par l’injection de collagène (CIA) [5]. Conjointement, Aggarwal et al. montraient que l’IL-23 induit la production d’IL-17 et non d’IFNγ, par des cellules T CD4 effectrices ou mémoires [
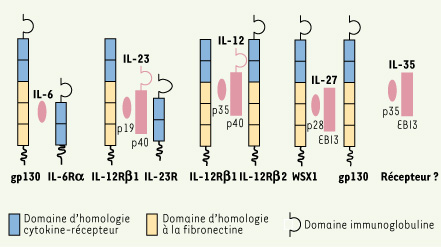
6]. En accord avec l’observation que des souris déficientes pour l’IL-17 sont résistantes à l’EAE, ces différents résultats montraient que l’IL-23, et non l’IL-12, induisait cette pathologie inflammatoire en favorisant le développement de cellules T CD4 productrices d’IL-17.  | Figure 1.
Famille des cytokines hétérodimériques IL-6/IL-12. Les différentes cytokines de la famille IL-6/IL-12, leurs récepteurs spécifiques et domaines structuraux sont représentés. La sous-unité p19, composant l’IL-23, partage 70 % d’homologie de séquence peptidique avec la sous-unité p35 de l’IL-12. La nouvelle cytokine de cette famille, l’IL-35, est composée des sous-unités p35 et EBI3 qui est identique à l’IL-12p40 avec une homologie de séquence égale à 27 %. Le récepteur de l’IL-35 est inconnu à ce jour. |
L’ensemble des données actuelles chez la souris est en accord avec un rôle majeur des cellules Th17 dans des pathologies auto-immunes inflammatoires telles que l’EAE, le RA ou la maladie de Crohn. Il reste encore à définir si des cellules Th17 autoréactives sont impliquées dans le développement d’un diabète de type 1. Le rôle des Th17 dans ces mêmes pathologies chez l’homme reste encore à définir, néanmoins, plusieurs études mettent en évidence un rôle important de l’IL-23 dans le développement de lésions cutanées chez des patients atteints de psoriasis. |
Régulation de la différenciation Th17 chez la souris Rôle des cytokines La résistance à l’EAE observée chez des souris déficientes pour l’IL-23 suggérait un rôle crucial de cette cytokine dans le développement du lignage Th17 [ 5]. Cependant et en accord avec l’expression du récepteur de l’IL-23 par des cellules mémoires, l’IL-23 n’est pas essentielle à l’engagement vers le lignage Th17, mais favorise plutôt son amplification et/ou son maintien et contribue à la pathogénicité de ces cellules [ 6–
8]. Des travaux plus récents ont révélé le rôle clé du TGF-β ( transforming growth factor β), de l’IL-6 et de l’IL-21, une cytokine de la famille de l’IL-2, dans l’initiation de la différenciation Th17 [
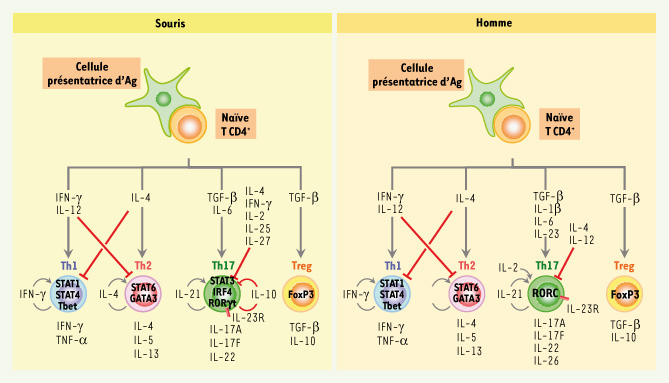
7] (Figure 2). Le modèle actuel propose que l’IL-6 induit l’expression de l’IL-21 qui, de manière autocrine, favorise sa propre expression ainsi que celle du récepteur de l’IL-23 par les cellules T CD4 naïves. Ainsi, à l’instar de l’IL-4 pour les cellules Th2 ou de l’IFNγ pour les cellules Th1, l’IL-21 agit de manière autocrine et instruirait la différenciation Th17. Il est très intéressant de noter que le TGF-β est également important pour la génération des cellules T régulatrices. Cependant, en présence de signaux inflammatoires tels que l’IL-6 ou l’IL-21, le TGF-β est capable d’induire la polarisation de cellules Th17.  | Figure 2.
Lignage des cellules T CD4 chez la souris et l’homme. À la suite de la stimulation par la cellule présentatrice d’antigène, les cellules T CD4 naïves se différencient en cellules effectrices définies par les cytokines qu’elles produisent. Suite à une stimulation antigénique, les cellules T CD4 naïves produisent transitoirement de l’IFNγ qui, conjointement à l’IFNγ produit par d’autres cellules de l’immunité innée, permettra l’activation du facteur de transcription STAT1. Conjointement aux signaux TCR, STAT1 initiera la différenciation Th1 en induisant l’expression de Tbet et de la chaîne IL-12Rβ2. Ces cellules engagées vers le lignage Th1 se différencieront en effecteurs Th1 sous l’influence de l’IL-12 qui active STAT4. De manière similaire, après activation, les cellules T naïves produisent transitoirement de l’IL-4, qui de manière autocrine et conjointement à l’IL-4 produite par d’autres types cellulaires encore mal identifiés, induira l’activation de STAT6 et ainsi l’expression de GATA3. Chez la souris, le TGF-β et l’IL-6, qui active STAT3, induisent la différenciation de cellules Th17 via l’expression du facteur de transcription RORγt. L’expression du facteur de transcription IRF4 est aussi indispensable à la différenciation des cellules Th17. Le maintien et l’amplification du phénotype Th17 sont assurés par l’expression du récepteur de l’IL-23 et par la production de l’IL-21 par la cellule T elle-même. Chez l’Homme, un modèle de différenciation des cellules Th17, dans lequel le TGF-β, l’IL-23, l’IL-1β et l’IL-6 sont les cytokines responsables de cette polarisation, est proposé. Le développement des cellules Th17 caractérisé par l’expression du facteur de transcription RORC (orthologue de RORγt chez l’homme) est potentialisé par l’IL-2 et inhibé par le TGF-β, l’IL-4 et l’IL-12. Les cellules T régulatrices expriment le facteur de transcription FoxP3 en réponse au TGF-β seul. FoxP3 n’est pas indispensable à la différenciation des cellules T régulatrices mais semble être plutôt un facteur de transcription intermédiaire qui serait régulé par d’autres mécanismes encore non identifiés à ce jour [
29]. |
Plusieurs cytokines régulent négativement la polarisation Th17. De la même façon que l’IL-4 inhibe la différenciation des cellules Th1 et l’IFNγ celle des cellules Th2, ces 2 cytokines contrôlent négativement le développement des cellules Th17. La différenciation Th17 est aussi inhibée par l’IL-2, l’IL-25, une autre cytokine de la famille de l’IL-17 produite par les cellules Th2 (Tableau I) et l’IL-27, une cytokine importante pour la différenciation des cellules Th1 [
9–
11]. L’IL-27 inhibe la différenciation Th17 en induisant la production de la cytokine immunosuppressive IL-10 par la cellule T elle-même [8]. L’IL-10, dont la production est également induite par le TGF-β et l’IL-6, contrôle négativement en retour la production d’IL-17.
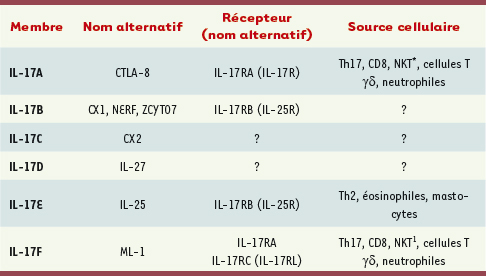
 | Tableau I.
Famille des cytokines IL-17. Pour plus de détails, voir [
21]. * Voir [
28]. |
Facteurs de transcription clés contrôlant le lignage Th17 chez la souris Les cytokines instruisent la différenciation des effecteurs CD4 en régulant l’expression de facteurs de transcription clés spécifiant chaque lignage. Ces facteurs de transcription permettront directement ou indirectement le remodelage de la structure de la chromatine des gènes du lignage correspondant et ainsi la régulation de l’expression des cytokines correspondantes. Les cellules Th17 n’expriment pas les facteurs clés des cellules Th1 et Th2, Tbet et GATA3 respectivement, révélant ainsi une troisième population de cellules T CD4 effectrices. Le groupe de Littman a montré que RORγt pouvait être le facteur de transcription clé du lignage Th17 (Figure 2) [
12]. L’expression de RORγt est induite dans des conditions optimales de différenciation Th17, en présence de TGF-β et d’IL-6. Par ailleurs, RORγt est nécessaire et suffisant à l’induction de la différenciation de cellules T CD4 naïves vers le phénotype Th17. De plus, les souris n’exprimant plus RORγt dans les cellules T sont protégées partiellement du développement d’EAE. Le développement des cellules Th17 nécessite la présence d’IL-6 qui transduit le signal via l’activation du facteur de transcription STAT3. Ce facteur est requis pour la différenciation in vitro et in vivo des cellules T CD4 naïves en cellules Th17 et le développement d’EAE [
13]. Le facteur de transcription Interferon-regulatory factor 4 (IRF4) est essentiel au développement des cellules Th2. Ce facteur de transcription contrôle également la différenciation des cellules Th17 [
14]. En effet, les cellules T CD4 n’exprimant plus IRF4 ne se différencient pas en cellules Th17. Par ailleurs, l’expression de RORγt est fortement diminuée dans les cellules T CD4 Irf4−/−
et les souris Irf4−/−
sont protégées totalement de l’EAE. Ces résultats révèlent un rôle central de IRF4 puisque les souris Rorγt−/−
ne sont que partiellement résistantes à l’EAE et peuvent tout de même générer quelques cellules Th17. |
La différenciation Th17 chez l’homme La différenciation des cellules Th17 humaines a été jusqu’à maintenant peu comprise. Une série de publications a dans un premier temps mis en évidence des différences très importantes dans la régulation des cellules Th17 entre l’homme et la souris [
15,
16]. Les premiers travaux montraient que la différenciation de cellules T CD4 humaines naïves en effecteurs Th17 pouvait être induite par l’IL-23 ou l’IL-1β, et que l’IL-6, en permettant une expression soutenue de RORC (orthologue de RORγt chez l’Homme) indispensable à la différenciation Th17, potentialiserait l’effet de l’IL-1β [15]. L’IL-2 aurait aussi un rôle positif sur la différenciation du lignage Th17 notamment en réprimant la production d’IFN-γ. Comme chez la souris, l’IL-12 ou l’IL-4 réprime la différenciation Th17. Toutefois, le rôle de l’IL-1β dans la différenciation Th17 est loin d’être consensuel. En effet, van Beelen et al. montraient que les cellules dendritiques, en libérant l’IL-23 et l’IL-1, induisaient la production de l’IL-17 mais préférentiellement par les cellules T mémoires et non les cellules T naïves [
17]. Alors que le TGF-β est essentiel à la différenciation des cellules Th17 chez la souris, ces études montraient également que cette cytokine non seulement n’était pas nécessaire, mais inhibait le développement de cellules Th17 humaines. Récemment, 3 études ont permis d’éclaircir cette controverse et d’aboutir à un consensus sur les signaux indispensables à la différenciation Th17 chez l’homme (Figure 2) (→). Ces travaux indépendants, dans lesquels les lymphocytes T naïfs ont été purifiés à partir de sang de cordon ombilical, montrent tous que le TGF-β est essentiel à la différenciation de cellules Th17 chez l’homme [
18–
20]. De plus, l’IL-23 et l’IL-6 jouent également un rôle positif dans cette différenciation de la même façon que chez la souris. (→) Voir la Nouvelle de Vassili Soumelis et Elisabetta Volpe, p. 925 de ce numéro
|
Fonctions physiologiques des cellules Th17 L’IL-17 (IL-17A), la cytokine effectrice du lignage Th17 est l’un des 6 membres de cette nouvelle famille [21] (Tableau I). Les cellules Th17 produisent aussi l’IL-17F, très homologue à l’IL-17A. Les gènes correspondant à ces deux cytokines sont génétiquement liés et leur expression semble être totalement co-régulée. IL-17A et IL-17F se lient au même récepteur, l’IL-17RA, dont l’expression est relativement ubiquitaire bien que plus prononcée dans les poumons et les intestins (fibroblastes, cellules épithéliales et endothéliales, monocytes et macrophages). L’IL-17A et F sont des cytokines pro-inflammatoires qui, selon la cellule cible, induisent l’expression de cytokines inflammatoires (IL-6, TNF-α, IL-1β) et de chimiokines (CXCL8, CXCL1, CXCL10), permettant ainsi le recrutement de cellules de l’immunité innée et notoirement des neutrophiles [
22]. Le rôle respectif des effecteurs Th1 et Th17 dans l’immunité infectieuse reste encore mal compris. Chez la souris l’axe Th17 a un rôle majeur dans le contrôle des infections pulmonaires à Klebsiella pneumoniae, intestinales à Citrobacter rodentium et systémiques à Candida albicans [
23–
25]. Les réponses Th1, et notamment la production d’IFNγ, sont par contre essentielles au contrôle des infections à Listeria, Mycobacterium, Salmonella ou Toxoplasma. Chez l’Homme, un défaut de réponses Th1 et Th17 suite à des mutations des gènes IL-12p40 et IL-12Rβ1 ne conduit pas à une susceptibilité accrue aux infections. Outre leur fonction immunitaire, l’IL-17 et l’IL-22, une autre cytokine produite par les cellules Th17, rétablissent les jonctions entre cellules épithéliales. Cette double fonction, immunitaire et mécanique, suggère un rôle essentiel des cellules Th17 dans le contrôle des procaryotes extracellulaires au niveau des épithéliums. Ainsi, les cellules Th17 sont naturellement présentes dans les organes lymphoïdes du tractus intestinal et l’IL-17 est constitutivement exprimée dans ce tissu, suggérant un rôle essentiel de cette population dans le maintien de l’intégrité et de l’homéostasie de la barrière intestinale. Une étude chez la souris met en évidence un rôle pro- et anti-inflammatoire des Th17 dans l’asthme allergique. Alors que l’IL-17 est nécessaire dans la phase de sensibilisation, elle réduit la réponse allergique chez des animaux sensibilisés en inhibant la production locale de chimiokines CCL11 et CCL17 et, en conséquence, le recrutement d’éosinophiles [
26]. Ces derniers travaux illustrent la complexité, encore mal comprise, des interactions entre les différents effecteurs de la réponse immunitaire innée et acquise. |
La découverte des cellules Th17 et la compréhension, encore parcellaire, de la fonction de cette nouvelle population de cellules effectrices, remet en perspective la dualité du TGF-β. Cette cytokine promeut le développement de cellules T régulatrices qui limitent l’inflammation locale par leur fonction régulatrice mais induit une immunité des muqueuses en potentialisant la production d’IgA [
27] et la différenciation des cellules Th17, cellules pro-inflammatoires. Des travaux récents montrent que le TGF-β induirait aussi la production d’IL-10 par les cellules Th17 qui, de manière autocrine ou paracrine, limiterait la production d’IL-17. Par ces mécanismes le TGF-β régulerait la production basale d’IL-17 à un niveau favorisant l’homéostasie des barrières épithéliales [8]. Par ces mêmes mécanismes, le TGF-β réduit aussi les propriétés encéphalogéniques des cellules Th17 différenciées. Inversement, et en accord avec son rôle encéphalogénique, l’IL-23, réprimerait la production d’IL-10 en maintenant la production d’IL-17 par ces effecteurs [8]. Ces travaux récents suggèrent que l’inhibition de l’IL-23, en favorisant l’émergence d’effecteurs « autorégulés », serait préférable dans le traitement de pathologies auto-immunes impliquant les cellules Th17. |
1. Bettelli E, Sullivan B, Szabo SJ, et al. Loss of T-bet, but not STAT1, prevents the development of experimental autoimmune encephalomyelitis. J Exp Med 2004; 200 : 79–87. 2. Ferber IA, Brocke S, Taylor-Edwards C, et al. Mice with a disrupted IFN-gamma gene are susceptible to the induction of experimental autoimmune encephalomyelitis (EAE). J Immunol 1996; 156 : 5–7. 3. Chitnis T, Najafian N, Benou C, et al. Effect of targeted disruption of STAT4 and STAT6 on the induction of experimental autoimmune encephalomyelitis. J Clin Invest 2001; 108 : 739–47. 4. Oppmann B, Lesley R, Blom B, et al. Novel p19 protein engages IL-12p40 to form a cytokine, IL-23, with biological activities similar as well as distinct from IL-12. Immunity 2000; 13 : 715–25. 5. Cua DJ, Sherlock J, Chen Y, et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature 2003; 421 : 744–8. 6. Aggarwal S, Ghilardi N, Xie MH, et al. Interleukin-23 promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17. J Biol Chem 2003; 278 : 1910–4. 7. Bettelli E, Carrier Y, Gao W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature 2006; 441 : 235–8. 8. McGeachy MJ, Bak-Jensen KS, Chen Y, et al. TGF-beta and IL-6 drive the production of IL-17 and IL-10 by T cells and restrain T(H)-17 cell-mediated pathology. Nat Immunol 2007; 8 : 1390–7. 9. Batten M, Li J, Yi S, et al. Interleukin 27 limits autoimmune encephalomyelitis by suppressing the development of interleukin 17-producing T cells. Nat Immunol 2006; 7 : 929–36. 10. Kleinschek MA, Owyang AM, Joyce-Shaikh B, et al. IL-25 regulates Th17 function in autoimmune inflammation. J Exp Med 2007; 204 : 161–70. 11. Laurence A, Tato CM, Davidson TS, et al. Interleukin-2 signaling via STAT5 constrains T helper 17 cell generation. Immunity 2007; 26 : 371–81. 12. Ivanov, II, McKenzie BS, Zhou L, et al. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell 2006; 126 : 1121–33. 13. Harris TJ, Grosso JF, Yen HR, et al. Cutting edge: an in vivo requirement for STAT3 signaling in TH17 development and TH17-dependent autoimmunity. J Immunol 2007; 179 : 4313–7. 14. Brustle A, Heink S, Huber M, et al. The development of inflammatory T(H)-17 cells requires interferon-regulatory factor 4. Nat Immunol 2007; 8 : 958–66. 15. Acosta-Rodriguez EV, Napolitani G, Lanzavecchia A, Sallusto F. Interleukins 1beta and 6 but not transforming growth factor-beta are essential for the differentiation of interleukin 17-producing human T helper cells. Nat Immunol 2007; 8 : 942–9. 16. Wilson NJ, Boniface K, Chan JR, et al. Development, cytokine profile and function of human interleukin 17-producing helper T cells. Nat Immunol 2007; 8 : 950–7. 17. Van Beelen AJ, Zelinkova Z, Taanman-Kueter EW, et al. Stimulation of the intracellular bacterial sensor NOD2 programs dendritic cells to promote interleukin-17 production in human memory T cells. Immunity 2007; 27 : 660–9. 18. Yang L, Anderson DE, Baecher-Allan C, et al. IL-21 and TGF-beta are required for differentiation of human T(H)17 cells. Nature 2008; 454 : 350–2. 19. Manel N, Unutmaz D, Littman DR. The differentiation of human T(H)-17 cells requires transforming growth factor-beta and induction of the nuclear receptor RORgammat. Nat Immunol 2008; 9 : 641–9. 20. Volpe E, Servant N, Zollinger R, et al. A critical function for transforming growth factor-beta, interleukin 23 and proinflammatory cytokines in driving and modulating human T(H)-17 responses. Nat Immunol 2008; 9 : 650–7. 21. Kolls JK, Linden A. Interleukin-17 family members and inflammation. Immunity 2004; 21 : 467–76. 22. Chakravarti A, Allaeys I, Poubelle PE. Neutrophile et immunité : Est-ce inné ou acquis ? Med Sci (Paris) 2007; 23 : 862–7. 23. Happel KI, Dubin PJ, Zheng M, et al. Divergent roles of IL-23 and IL-12 in host defense against Klebsiella pneumoniae. J Exp Med 2005; 202 : 761–9. 24. Huang W, Na L, Fidel PL, Schwarzenberger P. Requirement of interleukin-17A for systemic anti-Candida albicans host defense in mice. J Infect Dis 2004; 190 : 624–31. 25. Harrington LE, Mangan PR, Weaver CT. Expanding the effector CD4 T-cell repertoire: the Th17 lineage. Curr Opin Immunol 2006; 18 : 349–56. 26. Schnyder-Candrian S, Togbe D, Couillin I, et al. Interleukin-17 is a negative regulator of established allergic asthma. J Exp Med 2006; 203 : 2715–25. 28. Anjuère F, Czerkinsky C. Immunité muqueuse et vaccination. Med Sci (Paris) 2007; 23 : 371–8. 28. Michel ML, Keller AC, Paget C, et al. Identification of an IL-17-producing NK1.1(neg) iNKT cell population involved in airway neutrophilia. J Exp Med 2007; 204 : 995–1001. 29. Hill JA, Feuerer M, Tash K, et al. Foxp3 transcription-factor-dependent and -independent regulation of the regulatory T cell transcriptional signature. Immunity 2007; 27 : 786–800. |