| |
| Med Sci (Paris). 2008 December; 24(12): 1012–1014. Published online 2008 December 15. doi: 10.1051/medsci/200824121012.Les polyoxométallates Des inhibiteurs inorganiques de la protéine kinase CK2 Renaud Prudent,1* Bernold Hasenknopf,2* and Claude Cochet1* 1Laboratoire de Transduction du Signal, Inserm U873, TS, iRTSV, CEA, 17, rue des Martyrs, 38054 Grenoble, France 2Laboratoire de Chimie Inorganique et Matériaux Moléculaires, CNRS UMR 7071, UPMC Université Paris 6, Institut de Chimie Moléculaire, 4, Place Jussieu, 75005 Paris, France MeSH keywords: Adénosine triphosphate, Animaux, Anions, Anti-infectieux, Antinéoplasiques, Sites de fixation, Fixation compétitive, Casein Kinase II, Domaine catalytique, Essais cliniques de phase II comme sujet, Techniques de chimie combinatoire, Humains, Nanoparticules métalliques, Souris, Modèles moléculaires, Protéines tumorales, Tumeurs, Composés de l'oxygène, Conformation des protéines, Inhibiteurs des protéines-kinases, Éléments de transition, Tests d'activité antitumorale sur modèle de xénogreffe |
L’intérêt médical des protéine-kinases La dérégulation de voies de signalisation cellulaires est à l’origine de l’initiation et de la progression des pathologies cancéreuses. Elle participe également à la réponse ou à la résistance des tumeurs aux traitements chimio- et radiothérapiques. Ces voies de signalisation sont riches en protéine kinases qui catalysent le transfert d’un groupement phosphate de l’ATP sur des protéines substrats. Ces enzymes sont ainsi capables d’intégrer, d’amplifier et de relayer les signaux extra- et intracellulaires qui contrôlent l’homéostasie cellulaire. Le lien étroit entre les protéine kinases et le cancer avait été mis en évidence pour la première fois il y a plus de 30 ans, lorsque Harold Varmus et Michaël Bishop avaient démontré que le premier oncogène découvert, src, codait pour une enzyme à activité tyrosine kinase. Depuis cette époque, certaines de ces protéine kinases dérégulées dans des pathologies cancéreuses sont devenues des cibles privilégiées pour les nouvelles chimiothérapies. Plusieurs inhibiteurs de ces enzymes sont utilisés en clinique avec une efficacité et une tolérance supérieures à celles des traitements classiques. Ainsi le Glivec® (Imatinib mésylate) ciblant la kinase BCR-ABL (breakpoint cluster region-abelson) est actif dans certaines leucémies myéloïdes chroniques et dans les tumeurs stromales gastro-intestinales (GIST) ayant une mutation du récepteur ckit. Tarceva® et Iressa®, ciblant le récepteur de l’EGF (epidermal growth factor), sont actifs dans certains gliomes et cancers du poumon respectivement. |
La protéine-kinase CK2 (anciennement caséine kinase 2) a un rôle critique dans une multitude de voies de signalisation contrôlant la prolifération cellulaire, la résistance à l’apoptose chimio-induite et la réparation de dommages à l’ADN [
1–
3]. L’expression de CK2 est dérégulée dans un large panel de cancers et son activité kinase est corrélée à la progression tumorale. Ainsi, des travaux de plusieurs laboratoires, dont le nôtre, ont montré que la surexpression ou la localisation cellulaire aberrante de CK2 constitue un marqueur pronostique défavorable dans les cancers de la prostate [
4], du poumon [
5] et dans les leucémies aiguës myéloïdes [
6]. De plus, des travaux récents ont montré que l’inhibition de CK2 dans un modèle murin de xénogreffe tumorale induit une régression des tumeurs implantées [
7], ce qui suggère que cette enzyme exerce, à côté de ses fonctions normales, des fonctions directement associées à l’oncogenèse. Enfin, l’inhibition pharmacologique de CK2 restaure une sensibilité aux drogues dans des cellules lymphoblastoïdes ayant un phénotype de multi-résistance. Ce faisceau d’arguments souligne l’intérêt médical grandissant pour la CK2 en tant que cible thérapeutique [
8,
9]. |
Inhibiteurs ATP-mimétiques Actuellement, la majorité des inhibiteurs de kinases utilisés en clinique sont des mimétiques de l’un des substrats de l’enzyme : l’ATP. Ces molécules chimiques ciblent la kinase dans une conformation active. Elles agissent alors comme des leurres, se fixent dans son site catalytique et l’empêchent de progresser dans sa réaction de phosphorylation. Une seconde classe d’inhibiteurs cible préférentiellement la conformation inactive de la kinase, empêchant son activation. Ces inhibiteurs, comme le Glivec, le BIRB796 et le sorafénib (Nexavar®)1, utilisent le site de fixation de l’ATP ainsi qu’une poche hydrophobe adjacente créée par la boucle d’activation dans une conformation fermée. Bien que ces différentes approches se soient révélées fructueuses en termes de retombées thérapeutiques, certaines limitations sont apparues : émergence de résistances (mutation dans le site de fixation de l’ATP), faible taux de réussite en phase préclinique dû à un manque de spécificité (inhibition indésirable d’autres kinases que la cible visée). En effet, les protéine kinases forment une large famille d’enzymes dont le site de fixation de l’ATP est l’un des domaines les plus conservés. Le risque est donc grand d’isoler des molécules inhibant la cible visée mais aussi d’autres kinases ou enzymes utilisant l’ATP, avec pour corollaire une toxicité non souhaitée. Parce qu’elles entrent en compétition avec les concentrations élevées de l’ATP intracellulaire, ces molécules doivent présenter une forte affinité pour la kinase ciblée. |
Inhibiteurs qui n’entrent pas en compétition avec l’ATP cellulaire Partant de ce constat, de nouvelles stratégies [
10] sont développées afin de perturber le fonctionnement de l’enzyme sans cibler le site catalytique. En effet, il est possible de cibler d’autres régions critiques de la kinase telles que le site de fixation du substrat protéique, le site de fixation d’éventuels partenaires ou de sous-unités régulatrices. Il est également possible de cibler une région dont la fonction n’est pas encore assignée et qui, par allostérie, peut bloquer l’enzyme dans une conformation inactive. En d’autres termes, il est possible d’exploiter la plasticité conformationnelle des kinases en stabilisant leurs conformations inactives, et ainsi de bloquer leur activité. Ce mode d’action émergent présente plusieurs avantages : contrairement aux formes actives qui subissent une pression de sélection pour accomplir la réaction catalytique, les conformations inactives sont moins conservées et donc plus spécifiques d’une cible particulière. Les nouveaux inhibiteurs ainsi développés sont souvent plus spécifiques (ne ciblant pas le site conservé de fixation de l’ATP) et n’entrent pas en compétition avec l’ATP cellulaire. Ces composés devraient donc être plus efficaces, mieux tolérés et offrir une opportunité pour les patients en échec thérapeutique lors de l’apparition de résistances. Parmi la cinquantaine d’inhibiteurs aujourd’hui testés dans des essais cliniques, certains n’entrent pas en compétition avec l’ATP cellulaire : le BIRB798 ciblant la p38MAPK, utilisé contre la polyarthrite rhumatoïde, est actuellement en phase II d’essai clinique, ou bien le BAY43-9006 ciblant le récepteur du VEGF (vascular endothelial growth factor), est à visée anti-angiogénique. |
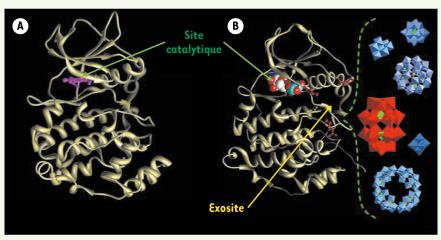
Différents inhibiteurs entrant en compétition avec l’ATP ont été développés contre la CK2 dont le TBB et le DMAT sont les plus représentatifs (Figure 1A). Ces molécules organiques représentent des outils utiles en recherche, mais sont, jusqu’à présent, incompatibles avec leur utilisation en clinique [8]. Dans le but d’identifier des structures innovantes, nous avons cherché à isoler de nouvelles classes de molécules capables d’inhiber la CK2 en se fixant sur d’autres domaines de la kinase, et qui ne seront donc pas des compétiteurs de l’ATP [
11–
14].  | Figure 1.
Deux mécanismes d’inhibition de la CK2. Différents inhibiteurs entrant en compétition avec l’ATP ont été développés contre la CK2. A. Le TBB (en rouge) se fixe dans la poche catalytique au niveau du site de fixation de l’ATP. B. L’étude approfondie du mode d’action des POM a révélé que ces composés ne se fixent pas dans la poche de fixation de l’ATP mais sur un domaine différent. Cela révèle l’existence d’un exosite sur CK2, dont la caractérisation plus précise est en cours. |
|
Les polyoxométallates, une nouvelle famille d’inhibiteurs de la CK2 Un criblage à haut débit d’une collection de molécules chimiques, réalisé sur la plate-forme robotisée du Centre de criblage pour molécules bio-actives (CEA, Grenoble), nous a permis d’identifier diverses classes d’inhibiteurs de CK2. La plupart des molécules actives sont des compétiteurs de l’ATP (à l’instar des inhibiteurs existants). Plus innovant, certaines molécules n’ont pas cette propriété. C’est le cas d’une classe de molécules originales: les polyoxométallates (POM). Ces molécules « inorganiques » sont des agrégats nanométriques anioniques de métaux de transition (vanadium, molybdène, tungstène) et d’oxygène ; leur composition et leur structure sont donc fondamentalement différentes de celles des inhibiteurs organiques qui, eux, ont un squelette en carbone. Elles possèdent des propriétés intéressantes en catalyse chimique. De plus, plusieurs POM présentent des activités antivirales, antibiotiques et anti-cancéreuses [
15,
16]. Cependant, leur mécanisme d’action et leurs cibles cellulaires demeurent mal définis. Une grande série de polyoxométallates a été synthétisée à l’Institut de chimie moléculaire à Paris, et notre étude a permis d’établir les principales caractéristiques de l’interaction CK2-POM. Ces molécules originales présentent une affinité de l’ordre du nanomolaire pour la CK2, ce qui en fait les inhibiteurs les plus puissants de CK2 à ce jour. Des études enzymatiques portant sur un panel de différentes protéine kinases ont révélé que les POM sont spécifiques de la CK2. Ils agissent sur l’enzyme selon un mode d’inhibition totalement inédit en se fixant sur un site en position distale par rapport au site catalytique (Figure 1A). |
L’apport combiné du criblage automatisé de molécules chimiques, de la biochimie et de la biologie structurale a révélé l’existence d’exosites sur les kinases. La perturbation de ces domaines (différents du site de fixation de l’ATP) est capable d’altérer l’activité catalytique de l’enzyme. Les polyoxométallates représentent le prototype de molécules inhibant la CK2 sans entrer en compétition avec l’ATP. Elles appartiennent à une famille de molécules inorganiques composées de métaux et d’oxygène. Cela démontre la nécessité d’utiliser tous les éléments du tableau périodique pour trouver des nouveaux composés actifs. La chimie inorganique a donc sa place dans le développement d’agents thérapeutiques. Parce que les POM nous ont permis de révéler l’existence d’un exosite sur cette kinase, ces molécules constituent des sondes précieuses pour la caractérisation et l’exploitation de cet exosite. L’objectif des travaux en cours est, entre autres, d’élucider le mécanisme d’action de ces molécules. Ces connaissances seront alors déterminantes pour leur optimisation en futur candidats-médicaments. |
Les travaux du groupe Structure et fonctions de la CK2 de l’unité U873 bénéficient du soutien financier de l’Inserm, du CEA, de l’Institut National du Cancer et de la Ligue Nationale contre le Cancer (équipe labellisée EL2007.LNCC/CC1).
Les travaux à l’Institut de chimie moléculaire n’aurait pas été possibles sans la contribution de S. Bareyt, P. Gouzerh, E. Lacôte, J. Li, A. Proust, M. Malacria, S. Thorimbert et R. Thouvenot, et ils bénéficiaient du soutien du CNRS et de l’UPMC.
|
Footnotes |
1. Buchou T, Cochet C. La protéine kinase CK2, une enzyme qui cultive la différence Med Sci (Paris) 2003; 19 : 709–16. 2. Litchfield DW. Protein kinase CK2: structure, regulation and role in cellular decisions of life and death. Biochem J 2003; 369 : 1–15. 3. Ayoub N, Jeyasekharan AD, Bernal JA, Venkitaraman AR. HP1-beta mobilization promotes chromatin changes that initiate the DNA damage response. Nature 2008; 453 : 682–6. 4. Laramas M, Pasquier D, Filhol O, et al. Nuclear localization of protein kinase CK2 catalytic subunit (CK2alpha) is associated with poor prognostic factors in human prostate cancer. Eur J Cancer 2007; 43 : 928–34. 5. O-Charoenrat P, Rusch V, Talbot SG, et al. Casein kinase II alpha subunit and C1-inhibitor are independent predictors of outcome in patients with squamous cell carcinoma of the lung. Clin Cancer Res 2004; 10 : 5792–803. 6. Kim JS, Eom JI, Cheong JW, et al. Protein kinase CK2alpha as an unfavorable prognostic marker and novel therapeutic target in acute myeloid leukemia. Clin Cancer Res 2007; 13 : 1019–28. 7. Slaton JW, Unger GM, Sloper DT, Davis AT, Ahmed K. Induction of apoptosis by antisense CK2 in human prostate cancer xenograft model. Mol Cancer Res 2004; 2 : 712–21. 8. Pagano MA, Cesaro L, Meggio F, Pinna, LA. Protein kinase CK2: a newcomer in the druggable kinome. Biochem Soc Trans 2006; 34 : 1303–6. 9. Duncan JS, Litchfield DW. Too much of a good thing: the role of protein kinase CK2 in tumorigenesis and prospects for therapeutic inhibition of CK2. Biochim Biophys Acta 2008; 1784 : 33–47. 10. Bogoyevitch MA, Fairlie DP. A new paradigm for protein kinase inhibition: blocking phosphorylation without directly targeting ATP binding. Drug Discov Today 2007; 12 : 622–633. 11. Prudent R, Moucadel V, Laudet B, et al. Identification of Polyoxometalates as nanomolar noncompetitive inhibitors of Protein Kinase CK2. Chemistry Biology 2008; 15 : 683–92. 12. Prudent R, Moucadel V, López-Ramos M, et al. Expanding the chemical diversity of CK2 inhibitors. Mol Cell Biochem 2008; 316 : 71–85. 13. Laudet B, Barette C, Dulery V, et al. Structure-based design of small peptide inhibitors of protein kinase CK2 subunit interaction. Biochem J 2007; 408 : 363–73. 14. Laudet B, Prudent R, Filhol O, Cochet C. Des agents thérapeutiques ciblant des interactions protéine-protéine : mythe ou réalité ? Med Sci (Paris) 2007; 23 : 273–8. 15. Hasenknopf B. Polyoxometalates: introduction to a class of inorganic compounds and their biomedical applications. Front Biosci 2005; 10 : 275–87. 16. Yamase T. Anti-tumor, -viral, and -bacterial activities of polyoxometalates for realizing an inorganic drug. J Mater Chem 2005; 15 : 4773–82. |