| |
| Med Sci (Paris). 2008 December; 24(12): 1027–1029. Published online 2008 December 15. doi: 10.1051/medsci/200824121027.Un nouveau mécanisme par lequel la récompense et les drogues modifient la chromatine dans les neurones Denis Hervé,* Miriam Matamales, Alexandre Stipanovich, Emmanuel Valjent, and Jean-Antoine Girault Inserm UMR-S 839, Université Pierre et Marie Curie (UPMC Paris 6), Institut du Fer à Moulin, 17, rue du Fer à Moulin, 75005 Paris, France MeSH keywords: Animaux, Chromatine, Dopamine, Phosphoprotéine DARPP-32 régulée par la dopamine et l'AMPc, Régulation de l'expression des gènes, Techniques de knock-in de gènes, Histone, Humains, Potentialisation à long terme, Souris, Souris transgéniques, Modèles neurologiques, Protéines tissu nerveux, Neurones, Phosphorylation, Maturation post-traductionnelle des protéines, Récompense, Drogues des rues |
Dopamine et apprentissage par renforcement Les récompenses ou les stimulus annonciateurs d’une récompense activent les neurones dopaminergiques lorsqu’ils surviennent de manière inattendue [
1]. La dopamine ainsi libérée faciliterait l’apprentissage du comportement qui a précédé, fournissant un mécanisme central de l’apprentissage par renforcement. Les drogues « addictives » ont la capacité de mimer ces réponses physiologiques en provoquant, par des mécanismes variés, une augmentation de dopamine extracellulaire dans le cerveau antérieur et plus particulièrement le noyau accumbens (ou striatum ventral, Figure 1) [
2,
3]. On pense actuellement que les renforcements dépendants de la dopamine, induits par les récompenses naturelles ou par les drogues, résultent d’une modification à long terme des synapses dans le striatum, et de nombreux résultats indiquent que cette plasticité synaptique nécessite l’expression d’un programme génétique dans les cellules striatales [
4]. Cependant, on sait encore mal comment la dopamine, agissant au niveau de la membrane des neurones, peut agir sur l’expression génique dans le noyau. Récemment, nous avons mis en évidence une nouvelle voie de signalisation induite par la dopamine qui permet ce transfert et qui, en régulant la phosphorylation des histones, participe aux modifications du comportement induites par les récompenses physiologiques ou les drogues [
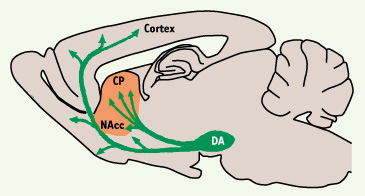
5].  | Figure 1.
Innervation dopaminergique du cerveau antérieur. Les neurones qui libèrent la dopamine (DA) ont leurs corps cellulaires dans la substance noire compacte et l’aire tegmentale ventrale, situées dans la partie supérieure du tronc cérébral (mésencéphale). Ces neurones innervent de nombreuses régions du cerveau antérieur. Le striatum comprend une région dorsale ou caudé-putamen (CP) particulièrement impliquée dans le contrôle des mouvements, et une région ventrale ou noyau accumbens (NAcc), qui joue un rôle dans l’orientation des comportements et la motivation. Les drogues addictives ont toutes la propriété d’augmenter la dopamine extracellulaire dans le noyau accumbens. |
|
Les drogues et l’apprentissage provoquent une accumulation nucléaire de DARPP-32 Des études antérieures, menées principalement dans le laboratoire de Paul Greengard, ont montré que la DARPP-32 (dopamine- and cAMP-regulated phosphoprotein, Mr = 32 000) est une protéine régulatrice majeure de la signalisation intracellulaire stimulée par la dopamine dans le striatum [
6]. Cette protéine est fortement exprimée par les neurones principaux du striatum et, à la suite de la stimulation des récepteurs dopaminergiques D1, elle est phosphorylée par la protéine kinase dépendante de l’AMPc (PKA) sur son résidu Thr-34. Sous cette forme phosphorylée, la DARPP-32 devient un puissant inhibiteur de la protéine phosphatase 1 (PP1), une phosphatase à large spectre agissant sur les résidus sérines/thréonines, et module le fonctionnement des synapses et leur plasticité en amplifiant la phosphorylation de nombreuses protéines. La DARPP-32 était connue pour être essentiellement cytoplasmique [
7] et pourtant, la DARPP-32 régule des événements nucléaires, puisque les souris avec une délétion ou une mutation du gène codant la DARPP-32 ont une altération de l’expression génique en réponse aux drogues [
8,
9]. On pensait que cette régulation nucléaire était indirecte, notamment en raison du rôle exercé par la DARPP-32 sur l’activation de la voie des MAP kinases par les drogues [
10]. Cependant, en examinant des coupes de cerveaux d’animaux traités par la cocaïne, l’amphétamine ou la morphine, nous avons observé une accumulation de DARPP-32 dans le noyau de certains neurones striataux, suggérant que la DARPP-32 pourrait avoir une fonction directe, encore insoupçonnée, dans le noyau [5]. Une accumulation similaire est aussi observée chez des souris qui apprennent à mettre leur museau dans un trou pour obtenir une boulette de nourriture, mais pas chez les animaux recevant la nourriture sans avoir travaillé pour cela. Ainsi, la translocation nucléaire de la protéine est liée à l’obtention active de la récompense, et non à sa délivrance passive, ce qui permet de proposer que ce mécanisme cellulaire est lié à l’apprentissage. |
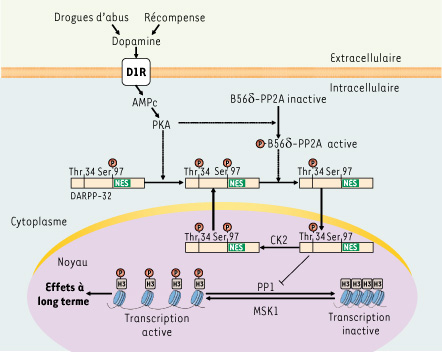
Translocation nucléaire de DARPP-32 : un rôle clé dans la réponse comportementale La localisation subcellulaire de la DARPP-32 n’est pas figée, mais résulte de l’équilibre dynamique d’un mouvement de navette entre le cytoplasme et le noyau (Figure 2). En conditions basales, sa localisation est préférentiellement cytoplasmique parce que l’export nucléaire l’emporte sur l’import en raison de la présence d’un signal d’export nucléaire (nuclear export signal, NES) très efficace dans la DARPP-32. L’accumulation nucléaire de la protéine résulte de l’activation des récepteurs D1 de la dopamine et de la PKA. Cependant, cette accumulation ne nécessite pas la phosphorylation de la DARPP-32 sur le site spécifique de la PKA (Thr-34). Le résidu clé dans ce processus est la Ser-97, un site de phosphorylation pour la protéine kinase CK2 (caséine kinase 2), qui est proche du NES. En effet, lorsque la Ser-97 est mutée en alanine, la DARPP-32 devient préférentiellement nucléaire en conditions basales aussi bien chez des souris mutantes knock-in que dans des neurones striataux transfectés. La Ser-97 étant fortement phosphorylée en conditions basales, cela suggère que la dopamine inhibe l’export nucléaire de la DARPP-32 en diminuant la phosphorylation de la Ser-97. En accord avec cette idée, la stimulation des récepteurs D1 de la dopamine augmente l’activité d’une isoforme de la protéine phosphatase 2A (B56δ) qui déphosphoryle la Ser-97, empêchant l’export de DARPP-32 (Figure 2).  | Figure 2.
Régulation de la réponse nucléosomique par la DARPP-32 dans les neurones du striatum. La libération de dopamine induite par les récompenses naturelles ou les drogues d’abus active les récepteurs dopaminergiques D1 couplés positivement à l’adénylyl cyclase. L’activation de la protéine kinase A (PKA) par l’AMPc intracellulaire a deux conséquences sur la DARPP-32 : (1) une phosphorylation sur le résidu Thr-34 qui rend la DARPP-32 inhibitrice de la protéine phosphatase 1 (PP1), et (2) une déphosphorylation sur le résidu Ser-97 qui empêche la DARPP-32 d’être exportée hors du noyau. La DARPP-32 active s’accumule alors dans le noyau et, en inhibant la PP1 nucléaire, augmente la phosphorylation de l’histone H3 induite dans les neurones striataux par MSK1 ( mitogen- and stress-activated kinase) en réponse à la cocaïne [
13]. La phosphorylation de l’histone H3 participe à la réponse nucléosomale qui facilite la transcription de gènes en relâchant la compaction de la chromatine. La Ser-97 de la DARPP-32 est située à proximité d’une séquence d’export nucléaire (NES). Sa déphosphorylation est catalysée par la protéine phosphatase 2A dont la sous-unité B56δ est activée par phosphorylation par la PKA. La phosphorylation de la Ser-97 est catalysée par la protéine kinase CK2 présente dans le cytoplasme et le noyau des neurones striataux. |
De manière intéressante, les souris knock-in chez lesquelles la Ser-97 est mutée en alanine et chez lesquelles la DARPP-32 est préférentiellement nucléaire présentent des altérations des réponses à long terme aux drogues. La sensibilisation comportementale à la cocaïne ou à la morphine est diminuée ainsi que la préférence de place conditionnée par la cocaïne. De plus, la motivation de ces souris mutantes pour une récompense alimentaire semble diminuée puisqu’elles abandonnent plus vite que les souris de type sauvage lorsqu’elles doivent mettre leur museau de nombreuses fois dans un petit trou pour obtenir une boulette de nourriture. Ces observations indiquent le rôle majeur joué par le résidu Ser-97 dans les fonctions de la DARPP-32 et suggèrent l’importance de sa translocation nucléaire régulée. |
Histone H3, une cible de DARPP-32 dans la chromatine Chez les souris traitées par une drogue, c’est la DARPP-32 phosphorylée sur la Thr-34, inhibitrice de la PP1, qui s’accumule dans le noyau. On sait que la PP1 est présente dans le noyau où elle a de nombreux substrats, ce qui ouvre de larges possibilités d’action à la DARPP-32 nucléaire. Nous avons pour l’instant identifié une protéine nucléaire dont la phosphorylation est contrôlée par la DARPP-32, l’histone H3 (Figure 2). La cocaïne augmente les taux d’histone H3 phosphorylée et phospho-acétylée (respectivement sur les résidus Ser-10 et Lys-14), en agissant essentiellement sur la phosphorylation. La phospho-acétylation de l’histone H3 affecte la structure chromatinienne et participe à la réponse nucléosomale facilitatrice de la transcription de gènes [
11,
12]. La phosphorylation d’H3 sur la Ser-10 en réponse à la cocaïne est perdue chez les souris knock-in porteuses d’une mutation de la Thr-34 ou de la Ser-97 en alanine, et des expériences dans les neurones en culture montrent que la translocation nucléaire de la DARPP-32 est un élément important de cette phosphorylation. L’accumulation nucléaire de DARPP-32 apparaît donc comme un mécanisme par lequel la dopamine peut contrôler la transcription dans les neurones du striatum. |
Notre étude identifie une voie de signalisation inédite par laquelle la dopamine induit une accumulation nucléaire de DARPP-32 sous une forme capable d’inhiber une importante phosphatase nucléaire. La régulation de la phosphorylation de l’histone H3, et vraisemblablement d’autres protéines nucléaires qui restent à identifier, pourrait ainsi participer à la plasticité neuronale requise pour les renforcements comportementaux en modulant l’expression de gènes. Les résultats obtenus avec les souris mutantes soulignent l’importance fonctionnelle de ces mécanismes. |
1. Schultz W, Dickinson A. Neuronal coding of prediction errors. Annu Rev Neurosci 2000; 23 : 473–500. 2. Di Chiara G. Drug addiction as dopamine-dependent associative learning disorder. Eur J Pharmacol 1999; 375 : 13–30. 3. Berke JD, Hyman SE. Addiction, dopamine, and the molecular mechanisms of memory. Neuron 2000; 25 : 515–32. 4. Hyman SE, Malenka RC, Nestler EJ. Neural mechanisms of addiction: the role of reward-related learning and memory. Annu Rev Neurosci 2006; 29 : 565–98. 5. Stipanovich A, Valjent E, Matamales M, et al. A phosphatase cascade by which rewarding stimuli control nucleosomal response. Nature 2008; 453 : 879–84. 6. Svenningsson P, Nishi A, Fisone G, et al. DARPP-32: an integrator of neurotransmission. Annu Rev Pharmacol Toxicol 2004; 44 : 269–96. 7. Ouimet CC, Miller PE, Hemmings HC Jr, et al. DARPP-32, a dopamine- and adenosine 3’:5’-monophosphate-regulated phosphoprotein enriched in dopamine-innervated brain regions. III. Immunocytochemical localization. J Neurosci 1984; 4 : 111–24. 8. Svenningsson P, Fienberg AA, Allen PB, et al. Dopamine D1 receptor-induced gene transcription is modulated by DARPP-32. J Neurochem 2000; 75 : 248–57. 9. Valjent E, Pascoli V, Svenningsson P, et al. Regulation of a protein phosphatase cascade allows convergent dopamine and glutamate signals to activate ERK in the striatum. Proc Natl Acad Sci USA 2005; 102 : 491–6. 10. Valjent E, Herve D, Girault JA. Drogues addictives, protéine phosphatases et voie ERK. Med Sci (Paris) 2005; 21 : 453–4. 11. Bode AM, Dong Z. Inducible covalent posttranslational modification of histone H3. Sci STKE 2005; 2005 : re4. 12. Deng H, Bao X, Cai W, et al. Ectopic histone H3S10 phosphorylation causes chromatin structure remodeling in Drosophila. Development 2008; 135 : 699–705. 13. Brami-Cherrier K, Valjent E, Hervé D, et al. Parsing molecular and behavioral effects of cocaine in mitogen- and stress-activated protein kinase-1-deficient mice. J Neurosci 2005; 25 : 11444–54. |