| |
| Med Sci (Paris). 2008 December; 24(12): 1065–1070. Published online 2008 December 15. doi: 10.1051/medsci/200824121065.Ikaros, facteur de transcription impliqué, aussi, dans l’érythropoïèse Marilyne Dijon,* Christian Chabannon,* and Cécile Tonnelle** Institut Paoli-Calmettes, Centre de Thérapie Cellulaire et Génique, Marseille, F-13009, France Inserm, U891, CRCM, Équipe Recherche Clinique, Marseille, F-13009, France Inserm, CIC-B510, Centre d’Investigations Cliniques en Biothérapie, Marseille, F-13009, France Univ. Méditerranée, F-13007, Marseille, France, 232, boulevard Sainte Marguerite, 13273 Marseille Cedex 9, France |
L’hématopoïèse, comme l’indique son étymologie (haimatos : sang et poieim : faire), est un processus complexe à la base de la production des différentes lignées composant le sang à partir des cellules souches hématopoïétiques (CSH). La différenciation de ces CSH vers des progéniteurs plus engagés, puis des précurseurs, restreint progressivement les potentialités de différenciation des cellules vers une seule et unique destinée, aboutissant à la production de différentes cellules matures et fonctionnelles qui composent notre système immunitaire et sanguin. Ce phénomène complexe est très contrôlé par divers signaux externes, tels que les cytokines ou les hormones, et internes, comme les facteurs de transcription. |
Le facteur de transcription Ikaros Le gène Ikaros, également appelé Lyf-1 ou Zfpm1a1 ou IKZF1, codant pour un facteur de transcription, a été isolé il y a 15 ans lors de la recherche des facteurs de transcription nécessaires à l’expression des gènes de la TdT (terminal deoxynucleotidyl transferase) et du CD3δ, impliqués au cours de la lymphopoïèse T murine [
1,
2]. Son rôle majeur dans la différenciation lymphoïde a été mis en évidence principalement grâce aux modèles d’invalidation du gène chez la souris. Le gène Ikaros, codant pour plusieurs isoformes, présente une forte homologie entre les différentes espèces [
3,
4]. Son expression est restreinte aux organes hématopoïétiques, au système nerveux (corpus striatum) et à l’hypophyse [2,
5]. Au sein du tissu hématopoïétique, Ikaros est exprimé non seulement dans les CSH et au cours de la différenciation lymphocytaire [
48], mais aussi au cours de l’érythropoïèse et de la myélopoïèse, plus particulièrement neutrophile [
6–
8]. Le profil d’expression décrit chez la souris est similaire chez l’homme [
9,
10]. Le gène Ikaros, composé de 7 exons traduits, code pour un facteur de transcription à doigts de zinc appartenant à la famille Ikaros dont il est le membre fondateur. Cette famille comporte 4 autres membres : Hélios [
11,
12], Aiolos [
13], Eos et Pegasus [
14]. La répartition des 6 doigts de zinc d’Ikaros en deux domaines distincts est similaire à celle de la protéine Hunchback décrite chez la drosophile [2] (Figure 1A). Les 4 doigts de zinc présents dans la région amino-terminale permettent la liaison à l’ADN de ce facteur de transcription au niveau de la séquence consensus GGGAA. En revanche, les deux doigts de zinc présents dans la région carboxy-terminale sont nécessaires à l’homo- et l’hétéro-dimérisation des protéines de la famille Ikaros [
15–
17]. Différentes isoformes - 12 sont actuellement connues - résultent d’épissages alternatifs entre les exons 2 et 7, induisant des variations dans le domaine de liaison à l’ADN, le domaine de dimérisation restant constant [4, 8, 15–
18]. Deux groupes d’isoformes, fonctionnelles et ayant un rôle dominant négatif, peuvent donc être distingués en fonction du nombre de doigts de zinc présents dans le domaine de liaison à l’ADN [15–17].  | Figure 1.
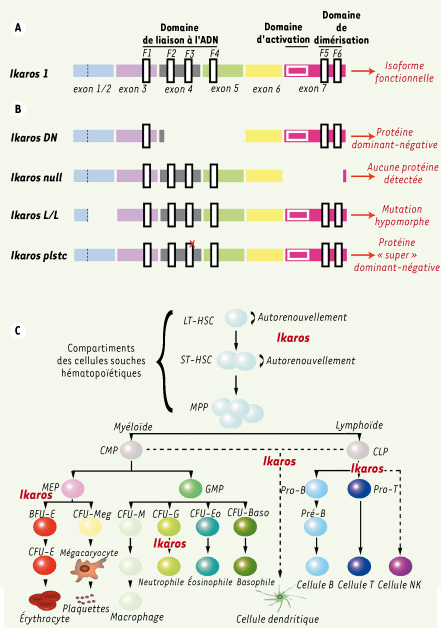
Mutations d’Ikaros et stades hématopoïétiques impliquant Ikaros dans le modèle murin. A. Forme fonctionnelle d’Ikaros (Ikaros 1) contenant un domaine de liaison à l’ADN, un domaine d’activation ainsi qu’un domaine de dimérisation. F1, F2, F3, F4, F5 et F6 représentent les différents doigts de zinc. B. Représentation des différentes protéines mutantes d’Ikaros réalisées chez la souris. Ikaros DN : délétion d’une partie de l’exon 4 et de la totalité de l’exon 5, ce qui forme une protéine Ikaros dont le domaine de liaison à l’ADN est partiellement délété. Ikaros null : délétion d’une partie de l’exon 7 comprenant le domaine de transactivation et le domaine de dimérisation, ce qui résulte en un ARNm instable ne formant aucune protéine. Ikaros L/L : insertion en phase dans la trame de lecture de l’exon 2 du gène de la β-galactosidase, ce qui se traduit par l’absence partielle de la protéine Ikaros. Ikaros plstc : mutation dans le troisième doigt de zinc du domaine de liaison à l’ADN (représentée par X) invalidant la structure de liaison à l’ADN. Cette mutation aboutit à la formation d’une protéine aux caractéristiques dites d’un « super » dominant-négatif, en raison de sa capacité à entraîner des défauts plus drastiques que la protéine Ikaros DN. C. Schéma présentant la filiation entre les différentes lignées hématopoïétiques et les différents stades nécessitant la présence de la protéine Ikaros (notée en rouge sur le schéma). Les pointillés représentent la filiation hypothétique des cellules dendritiques et NK. |
La fonction d’Ikaros, régulée par phosphorylation [
19] ou sumoylation [
20], est particulièrement complexe et dépendante du type cellulaire étudié. Ikaros peut avoir d’une part un rôle activateur de la transcription, c’est le cas pour les gènes CD3δ ou CD8 [2,
21] et d’autre part celui de répresseur de la transcription, du gène λ5, par exemple [
22]. De plus, il a été localisé au niveau des régions hétérochromatiniennes des noyaux de lymphocytes, y entraînant le recrutement et l’inhibition de ses gènes cibles, tels que TdT [
23–
26]. Les différents rôles d’Ikaros au cours de l’hématopoïèse sont mis en évidence lors de l’analyse des défauts engendrés par l’invalidation du gène, ou de la fonction, d’Ikaros chez la souris [
7,
27–
29,
49] (Figure 1B) ou chez l’homme [
30–
33]. De manière générale, l’implication d’Ikaros au cours de l’hématopoïèse n’est pas restreinte à la lignée lymphocytaire B et T [7, 27–29], comme on l’a pensé pendant longtemps, mais s’étend à tout le système hématopoïétique (Figure 1C) : CSH [
28,
34], cellules natural killer (NK) [
35], cellules dendritiques [
31,
32,
36,
37], polynucléaires, plus particulièrement neutrophiles [
38], et cellules érythrocytaires [27, 28, 34,
39,
40]. Toutefois, Ikaros ne semble pas impliqué directement dans la différenciation monocytaire [
41]. |
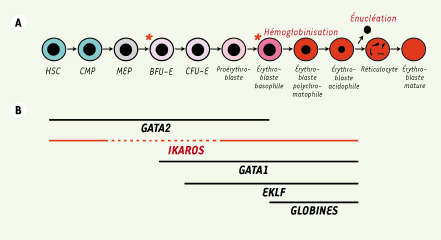
Le processus érythropoïétique est une succession d’étapes de différenciation accompagnées de changements morphologiques, qui conduit les CSH à produire jusqu’à environ 100 milliards de globules rouges, ou érythrocytes matures, par jour. Émergeant initialement dans le sac vitellin et la région aorte gonade mésonéphros (AGM) chez l’embryon, l’érythropoïèse se localisera ensuite dans le foie fœtal, puis la moelle osseuse au cours du développement [
50]. Les premières étapes engageant les CSH vers la lignée érythrocytaire sont caractérisées par la formation d’un progéniteur commun myéloïde (CMP), puis d’un progéniteur commun aux lignées mégacaryocytaire et érythrocytaire (MEP) ; ces MEP se différencient en progéniteurs monopotents, les « burst forming unit-erythroid » (BFU-E), puis les « colony forming unit-erythroid » (CFU-E), identifiés par leur capacité à former des colonies d’érythroblastes différenciés (en milieu semi-solide), puis ces progéniteurs se différencient en précurseurs (Figures 1 et 2A). La lignée érythroïde comporte, ensuite, 6 stades de différenciation séquentiels morphologiquement reconnaissables : le proérythroblaste, cellule la plus immature, l’érythroblaste basophile, l’érythroblaste polychromatophile, l’érythroblaste acidophile, le réticulocyte et enfin l’érythrocyte mature, ces deux derniers stades étant énucléés. La différenciation érythropoïétique s’accompagne de l’évolution de l’expression des antigènes de surface (perte de l’expression du CD34, du c-kit : CD117 et de la nectine 1 : CD111, et expression de la glycophorine A : GPA ou CD235a, du récepteur de la transferrine : CD71 et de CD36). Lors de l’érythropoïèse, on peut noter aussi l’accumulation de l’hémoglobine, véhicule moléculaire permettant d’accomplir la fonction primaire de l’érythrocyte : le transport du dioxygène capté dans les poumons vers les différents tissus périphériques. Différentes hémoglobines sont présentes dans ces cellules selon le stade du développement. Cette variabilité est due à une association différente au cours de l’ontogénie entre les chaînes du groupe des globines α (ζ et α) et les chaînes du groupe des globines β (ε, γ, δ et β). Ainsi, lors de la période embryonnaire humaine, les érythrocytes « primitifs » (produits dans la vésicule vitelline, et qui restent nucléés) expriment les hémoglobines embryonnaires (Gower 1 α2ε2, Gower 2 ζ2ε2, Portland ζ2γ2) pendant les deux premiers mois de gestation. Les érythrocytes dits « définitifs » (produits dans le foie fœtal, puis la moelle osseuse) expriment les hémoglobines fœtales ou HbF (α2
Gγ2 et α2
Aγ2) jusqu’à la période post-natale, où elles seront remplacées par les deux hémoglobines adultes, une majoritaire HbA α2β2, et une minoritaire HbA2 α2δ2. Le remplacement progressif de l’expression d’un type de globine par un autre est appelé « switch » (Figure 3). L’expression temporelle de ces gènes de globine est régulée par des facteurs spécifiques, comme certains facteurs de remodelage de la chromatine et/ou facteurs de transcription. Le plus important d’entre eux, GATA1, est impliqué dans l’expression de nombreux gènes érythrocytaires, tels que EKLF (Erythroid krüppel like factor) ou les globines, mais également dans la survie des érythroblastes [
42] (Figure 2B).  | Figure 2.
Différenciation érythrocytaire. A. Présentation des différents stades érythropoïétiques. HSC : hematopoietic stem cell ; CMP : common myeloid progenitor ; MEP : mega erythroid progenitor ; BFU-E : burst forming unit-erythroid ; CFU-E : colony forming unit-erythroid. Les deux principaux événements spécifiques de l’érythropoïèse sont également représentés (l’hémoglobinisation et l’expulsion nucléaire) (*localise les possibles stades impliquant la protéine Ikaros). B. Variation de l’expression de certains gènes nécessaires à la différenciation érythrocytaire. L’expression d’Ikaros est représentée en rouge, les pointillés représentent les interrogations quant aux stades précis où Ikaros est exprimé. |
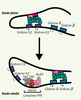 | Figure 3.
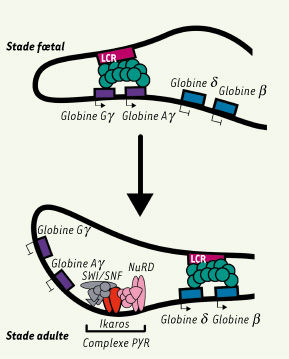
Rôle proposé d’Ikaros lors du switch entre les globines fœtales et adultes. Dans les cellules fœtales, le LCR ( locus control region) est associé aux régions promotrices des globines γ, alors que dans les cellules adultes, le LCR, lié aux gènes δ et β, active leur expression. Le complexe PYR associe le complexe NuRD, SWI/SNF et la protéine Ikaros qui permet la liaison à l’ADN de cet ensemble multiprotéique entre les gènes de globines γ et δ spécifiquement au stade adulte. La présence de ce complexe dans la région intergénique entre les globines fœtales et adultes est à l’origine du switch entre ces mêmes globines. Les mécanismes moléculaires par lesquels le recrutement de ce complexe PYR contribue au switch entre les globines adultes et fœtales demeurent cependant inconnus (d’après [
43]). |
|
Ikaros et l’érythropoïèse murine Ikaros semble jouer un rôle à trois niveaux du processus de l’érythropoïèse : lors de l’engagement dans la lignée érythroïde, de la prolifération des érythroblastes immatures et du « switch » des globines. À ce jour, il est difficile de savoir si ces différentes fonctions sont dépendantes ou non les unes des autres. Chez la souris, la mutation Ik plstc (Figure 1B) à l’état homozygote, entraîne une anémie sévère des embryons et leur mort in utero à J15-17,5 alors que les mutations Ik DN ou Ik null, à l’état homozygote, moins drastiques, sont à l’origine d’une anémie plus tardive à l’âge adulte associée à une augmentation du nombre de cellules immatures dans le sang. Ces anémies embryonnaires ou adultes se traduisent par une diminution de l’hématocrite et du taux d’hémoglobine et entraînent une destruction accrue des cellules d’origine érythrocytaire [27, 28, 39]. Ikaros est impliqué dans la détermination vers l’érythropoïèse des progéniteurs du foie fœtal. La déficience d’Ikaros n’engendre aucun défaut dans la formation des progéniteurs communs méga-érythrocytaires (MEP) [28, 41], alors qu’elle entraîne une diminution de la proportion des progéniteurs plus engagés, BFU-E et CFU-E [28, 34]. Les précurseurs précoces (proérythroblastes ou érythroblastes basophiles) sont faiblement affectés, alors que le nombre de cellules ayant atteint un stade de maturation plus tardif s’effondre littéralement en raison d’un défaut de prolifération. Ikaros semble donc avoir un rôle au niveau de la prolifération et de la différenciation des érythroblastes [28]. Au niveau moléculaire, Ikaros influence l’expression d’un certain nombre de gènes érythrocytaires, principalement étudiés chez les souris Ik null [39]. Parmi les transcrits analysés dans le foie fœtal de ces souris Ik null homozygotes, certains transcrits érythrocytaires sont exprimés à un taux diminué (récepteur de la transferrine CD71, EKLF), d’autres ne sont pas modifiés (globines α et β, GATA1, GPA) tandis que la quantité de transcrits du gène myéloïde PU.1 est augmentée. De plus, Ikaros est impliqué dans le switch des globines. Dans les cellules érythrocytaires murines, le complexe PYR, associant les complexes SWI/SNF et NURD, se fixe via la protéine Ikaros à la région inter-génique située entre les gènes des globines fœtales et adultes, facilitant le « switch » entre les deux globines fœtales (Gγ et Aγ) et adultes (β et δ) [40, 43] (Figure 3). En l’absence d’Ikaros, le taux de la globine embryonnaire augmente par rapport à celui de la globine adulte, traduisant un retard dans le « switch » entre les globines. Ce résultat est confirmé lors du croisement des souris Ik
null avec des souris transgéniques contenant les séquences du locus de la globine β humaine (32kb) ; en effet, l’absence d’Ikaros entraîne un retard de « switch » entre la globine humaine fœtale (γ) et adulte (β) dans le locus transgénique [39]. Ikaros est donc impliqué dans la différenciation érythrocytaire murine, notamment dans le « switch » entre les différentes globines. |
Ikaros et l’érythropoïèse humaine Nos données récemment publiées sur l’érythropoïèse fœtale et adulte humaine [30] confirment et complètent les observations décrites précédemment chez la souris. Au cours de ce travail, nous avons forcé l’expression d’un dominant-négatif d’Ikaros, appelé Ikaros 6, afin de bloquer la fonction des isoformes endogènes d’Ikaros. Pour cela, nous avons transduit des CSH issues du sang placentaire ou d’aphérèse adulte à l’aide de vecteurs lentiviraux contenant l’ADNc d’Ikaros 6. Ces cellules ont ensuite été placées dans un système de différenciation érythrocytaire in vitro, dérivé du protocole validé par l’équipe de Luc Douay [
44,
45], permettant des études cytométriques et moléculaires aux différentes étapes de l’érythropoïèse. La présence d’Ikaros 6 au cours de la différenciation érythropoïétique induit un ralentissement très net de la prolifération ainsi qu’une augmentation de la mort cellulaire. L’analyse par PCR quantitative des principaux transcrits extraits à différents temps de culture des progéniteurs érythropoïétiques met en évidence l’augmentation de l’expression de GATA1 en situation contrôle, cette expression restant constante avec Ikaros 6. Cette altération suggère l’induction d’un blocage de l’érythropoïèse avant l’hémoglobinisation, hypothèse confortée par l’observation, d’une part d’une persistance de l’expression de gènes précoces - par exemple GATA2 - et, d’autre part, de l’absence d’augmentation d’expression des gènes cibles de GATA1, tels que EKLF et les gènes des globines, au cours de la culture des progéniteurs exprimant Ikaros 6 (Figure 2B). Ce maintien dans un état « immature » se traduit par une plus grande facilité à induire la différenciation en monocytes des cellules engagées dans la voie érythrocytaire en présence d’Ikaros 6. Ces observations suggèrent un rôle d’Ikaros dans le choix d’un engagement érythrocytaire versus monocytaire [30]. Elles sont compatibles aussi avec les données publiées chez la souris quant au rôle d’Ikaros dans l’engagement érythrocytaire versus mégacaryocytaire [41]. On peut ainsi noter l’étrange similitude entre la fonction d’Ikaros et celle d’EKLF dont les effets d’inactivation semblent dans les deux cas conduire à la fois à une augmentation de la différenciation mégacaryocytaire et à un retard dans le « switch » des globines [39, 41,
46,
47]. En effet, nous avons pu confirmer chez l’homme [30], à partir des CSH issues d’aphérèses adultes, l’altération du « switch » entre les globines fœtale et adulte en présence d’Ikaros 6 : le rapport entre les transcrits des globines fœtale et adulte diminue dans la situation contrôle alors qu’il reste constant avec Ikaros 6. À la lumière des observations faites chez la souris, Bank et al. [43] avaient suggéré la possibilité de pallier certaines thalassémies en réactivant l’expression des globines fœtales par l’invalidation d’Ikaros. Cependant, à supposer que le mécanisme moléculaire observé au cours de la différenciation in vitro soit prédictif du phénomène in vivo, notre étude remet en cause la pertinence d’une telle stratégie thérapeutique. En effet, l’invalidation de la fonction d’Ikaros entraînerait une diminution de l’érythropoïèse qui viendrait contrecarrer l’effet bénéfique attendu de l’augmentation de l’expression des globines fœtales. |
Au cours des premières études sur la fonction d’Ikaros lors de l’hématopoïèse, l’attention s’était concentrée sur la lymphopoïèse. Cependant, les fonctions d’Ikaros se révèlent plus complexes. En effet, son action sur la régulation de l’expression d’autres gènes hors du système lymphocytaire traduit une implication qui s’étend à presque tout le système hématopoïétique. Plus précisément, les études murines et humaines précédemment développées ont permis d’identifier un rôle fondamental d’Ikaros au cours de l’érythropoïèse et, en particulier, lors de l’étape précédant l’hémoglobinisation. Reste à déterminer le mode d’action de cette protéine dans un contexte érythrocytaire : agit-elle en tant qu’activateur ou répresseur, sur quel(s) gène(s), dans quel complexe ? La question reste ouverte. |
Ce travail a été financé en partie par l’Institut Paoli-Calmettes et par l’Inserm (contrat Inserm n°A03188AS). M.D. a reçu une bourse du Conseil Régional PACA et de la Société Française d’Hématologie (SFH).
|
1. Ernst P, Hahm K, Smale ST. Both LyF-1 and an Ets protein interact with a critical promoter element in the murine terminal transferase gene. Mol Cell Biol 1993; 13 : 2982–92. 2. Georgopoulos K, Moore DD, Derfler B. Ikaros, an early lymphoid-specific transcription factor and a putative mediator for T cell commitment. Science 1992; 258 : 808–12. 3. Haire RN, Miracle AL, Rast JP, Litman GW. Members of the Ikaros gene family are present in early representative vertebrates. J Immunol 2000; 165 : 306–12. 4. Molnar A, Wu P, Largespada DA, et al. The Ikaros gene encodes a family of lymphocyte-restricted zinc finger DNA binding proteins, highly conserved in human and mouse. J Immunol 1996; 156 : 585–92. 5. Yu S, Asa SL, Ezzat S. Fibroblast growth factor receptor 4 is a target for the zinc-finger transcription factor Ikaros in the pituitary. Mol Endocrinol 2002; 16 : 1069–78. 6. Georgopoulos K, Winandy S, Avitahl N. The role of the Ikaros gene in lymphocyte development and homeostasis. Annu Rev Immunol 1997; 15 : 155–76. 7. Kirstetter P, Thomas M, Dierich A, et al. Ikaros is critical for B cell differentiation and function. Eur J Immunol 2002; 32 : 720–30. 8. Klug CA, Morrison SJ, Masek M, et al. Hematopoietic stem cells and lymphoid progenitors express different Ikaros isoforms, and Ikaros is localized to heterochromatin in immature lymphocytes. Proc Natl Acad Sci USA 1998; 95 : 657–62. 9. Nakayama H, Ishimaru F, Katayama Y, et al. Ikaros expression in human hematopoietic lineages. Exp Hematol 2000; 28 : 1232–8. 10. Nietfeld W, Meyerhans A. Cloning and sequencing of hIk-1, a cDNA encoding a human homologue of mouse Ikaros/LyF-1. Immunol Lett 1996; 49 : 139–41. 11. Hahm K, Cobb BS, McCarty AS, et al. Helios, a T cell-restricted Ikaros family member that quantitatively associates with Ikaros at centromeric heterochromatin. Genes Dev 1998; 12 : 782–96. 12. Kelley CM, Ikeda T, Koipally J, et al. Helios, a novel dimerization partner of Ikaros expressed in the earliest hematopoietic progenitors. Curr Biol 1998; 8 : 508–15. 13. Morgan B, Sun L, Avitahl N, et al. Aiolos, a lymphoid restricted transcription factor that interacts with Ikaros to regulate lymphocyte differentiation. EMBO J 1997; 16 : 2004–13. 14. Perdomo J, Holmes M, Chong B, Crossley M. Eos and pegasus, two members of the Ikaros family of proteins with distinct DNA binding activities. J Biol Chem 2000; 275 : 38347–54. 15. Hahm K, Ernst P, Lo K, et al. The lymphoid transcription factor LyF-1 is encoded by specific, alternatively spliced mRNAs derived from the Ikaros gene. Mol Cell Biol 1994; 14 : 7111–23. 16. Molnar A, Georgopoulos K. The Ikaros gene encodes a family of functionally diverse zinc finger DNA-binding proteins. Mol Cell Biol 1994; 14 : 8292–303. 17. Sun L, Liu A, Georgopoulos K. Zinc finger-mediated protein interactions modulate Ikaros activity, a molecular control of lymphocyte development. EMBO J 1996; 15 : 5358–69. 18. Payne KJ, Nicolas JH, Zhu JY, et al. Cutting edge: predominant expression of a novel Ikaros isoform in normal human hemopoiesis. J Immunol 2001; 167 : 1867–70. 19. Gomez-del Arco P, Maki K, Georgopoulos K. Phosphorylation controls Ikaros’s ability to negatively regulate the G(1)-S transition. Mol Cell Biol 2004; 24 : 2797–807. 20. Gomez-del Arco P, Koipally J, Georgopoulos K. Ikaros SUMOylation: switching out of repression. Mol Cell Biol 2005; 25 : 2688–97. 21. Harker N, Naito T, Cortes M, et al. The CD8alpha gene locus is regulated by the Ikaros family of proteins. Mol Cell 2002; 10 : 1403–15. 22. Sabbattini P, Lundgren M, Georgiou A, et al. Binding of Ikaros to the lambda5 promoter silences transcription through a mechanism that does not require heterochromatin formation. EMBO J 2001; 20 : 2812–22. 23. Cobb BS, Morales-Alcelay S, Kleiger G, et al. Targeting of Ikaros to pericentromeric heterochromatin by direct DNA binding. Genes Dev 2000; 14 : 2146–60. 24. Georgopoulos K. Haematopoietic cell-fate decisions, chromatin regulation and ikaros. Nat Rev Immunol 2002; 2 : 162–74. 25. Terranova R, Core N, Djabali M. Ikaros, chromatine et contrôle du développement lymphocytaire. Med Sci (Paris) 2000; 16 : 685–88. 26. Trinh LA, Ferrini R, Cobb BS, et al. Down-regulation of TDT transcription in CD4+CD8+ thymocytes by Ikaros proteins in direct competition with an Ets activator. Genes Dev 2001; 15 : 1817–32. 27. Georgopoulos K, Bigby M, Wang JH, et al. The Ikaros gene is required for the development of all lymphoid lineages. Cell 1994; 79 : 143–56. 28. Papathanasiou P, Perkins AC, Cobb BS, et al. Widespread failure of hematolymphoid differentiation caused by a recessive niche-filling allele of the Ikaros transcription factor. Immunity 2003; 19 : 131–44. 29. Wang JH, Nichogiannopoulou A, Wu L, et al. Selective defects in the development of the fetal and adult lymphoid system in mice with an Ikaros null mutation. Immunity 1996; 5 : 537–49. 30. Dijon M, Bardin F, Murati A, et al. The role of Ikaros in human erythroid differentiation. Blood 2008; 111 : 1138–46. 31. Galy A, Christopherson I, Ferlazzo G, et al. Distinct signals control the hematopoiesis of lymphoid-related dendritic cells. Blood 2000; 95 : 128–37. 32. Movassagh M, Laderach D, Galy A. Proteins of the Ikaros family control dendritic cell maturation required to induce optimal Th1 T cell differentiation. Int Immunol 2004; 16 : 867–75. 33. Tonnelle C, Bardin F, Maroc C, et al. Forced expression of the Ikaros 6 isoform in human placental blood CD34+ cells impairs their ability to differentiate toward the B-lymphoid lineage. Blood 2001; 98 : 2673–80. 34. Nichogiannopoulou A, Trevisan M, Neben S, et al. Defects in hemopoietic stem cell activity in Ikaros mutant mice. J Exp Med 1999; 190 : 1201–14. 35. Boggs SS, Trevisan M, Patrene K, Geogopoulos K. Lack of natural killer cell precursors in fetal liver of Ikaros knockout mutant mice. Nat Immunol 1998; 16 : 137–45. 36. Allman D, Dalod M, Asselin-Paturel C, et al. Ikaros is required for plasmacytoid dendritic cell differentiation. Blood 2006; 108 : 4025–34. 37. Wu L, Nichogiannopoulou A, Shortman K, Georgopoulos K. Cell-autonomous defects in dendritic cell populations of Ikaros mutant mice point to a developmental relationship with the lymphoid lineage. Immunity 1997; 7 : 483–92. 38. Dumortier A, Kirstetter P, Kastner P, Chan S. Ikaros regulates neutrophil differentiation. Blood 2003; 101 : 2219–26. 39. Lopez RA, Schoetz S, DeAngelis K, et al. Multiple hematopoietic defects and delayed globin switching in Ikaros null mice. Proc Natl Acad Sci USA 2002; 99 : 602–7. 40. O’Neill DW, Schoetz SS, Lopez RA, et al. An ikaros-containing chromatin-remodeling complex in adult-type erythroid cells. Mol Cell Biol 2000; 20 : 7572–82. 41. Yoshida T, Ng SY, Zuniga-Pflucker JC, Georgopoulos K. Early hematopoietic lineage restrictions directed by Ikaros. Nat Immunol 2006; 7 : 382–91. 42. Vandekerckhove J, Ribeil JA, Zermati Y, et al. Hsp70, l’ange gardien de GATA-1 lors de la différenciation des globules rouges. Med Sci (Paris) 2008; 24 : 37–40. 43. Bank A. Regulation of human fetal hemoglobin: new players, new complexities. Blood 2006; 107 : 435–43. 44. Giarratana MC, Douay L. Le globule rouge de culture : une nouvelle étape dans l’ingénierie cellulaire. Med Sci (Paris) 2005; 21 : 231–2. 45. Giarratana MC, Kobari L, Lapillonne H, et al. Ex vivo generation of fully mature human red blood cells from hematopoietic stem cells. Nat Biotechnol 2005; 23 : 69–74. 46. Frontelo P, Manwani D, Galdass M, et al. Novel role for EKLF in megakaryocyte lineage commitment. Blood 2007; 110 : 3871–80. 47. Wijgerde M, Gribnau J, Trimborn T, et al. The role of EKLF in human beta-globin gene competition. Genes Dev 1996; 10 : 2894–902. 48. Cavazzana-Calvo M, Six E, André-Schmutz I, Coulombel L. Hématopoïèse humaine : des cellules CD34 aux lymphocytes T. Med Sci (Paris) 2007; 23 : 151–9. 49. Kastner P, Chan S. La voie Notch au centre du mécanisme de leucémogenèse dans un modèle murin de leucémies T. Med Sci (Paris) 2006; 22 : 708–10. 50. Godin I, Cumano A. Les cellules souches hématopoïétiques : une double origine embryonnaire ? Med Sci (Paris) 2007; 23 : 681–4. |