| |
| Med Sci (Paris). 2008 February; 24(2): 147–148. Published online 2008 February 15. doi: 10.1051/medsci/2008242147.La pigmentation du poil Comment les kératinocytes instruisent les mélanocytes Véronique Delmas* and Lionel Larue* UMR146 CNRS, Génétique du développement des mélanocytes, Laboratoires Raymond Latarjet, Centre Universitaire, Institut Curie, Bâtiments 110-111-112, 91405 Orsay Cedex, France MeSH keywords: Animaux, Communication cellulaire, Différenciation cellulaire, Humains, Kératinocytes, Mélanocytes, Souris, Pigmentation |
Du mélanocyte au kératinocyte : la vision passive du transfert de mélanine La plupart des espèces animales n’apparaissent pas en noir et blanc, mais sous une palette variété de couleurs, organisées de manière plus ou moins complexe. La pigmentation chez les mammifères résulte de la présence de mélanines, de carotènes et d’hémoglobines. Chez les humains, la coloration de la peau est principalement due à l’accumulation de mélanines dans les kératinocytes, cellules épithéliales formant l’épiderme. Les mélanines sont des polymères plus ou moins purs de tyrosine. L’homopolymère de tyrosine (eumélanine) est de couleur noire et les hétéropolymères de tyrosine-cystéine (phéomélanine) sont de couleur rouge-orangée. La coloration de la peau ou des poils est établie grâce à deux types de cellules : les cellules productrices de mélanine (les mélanocytes) et les cellules receveuses et accumulatrices de mélanine (les kératinocytes). Les mélanocytes ont pour origine la crête neurale, forment de nombreuses dendrites et contiennent des organites spécialisés, les mélanosomes, à l’intérieur desquels la mélanine est produite. Les mélanosomes sont véhiculés à l’intérieur du mélanocyte de manière centrifuge, vers l’extrémité de ses dentrites, avant d’être transférés dans les kératinocytes adjacents. Selon le schéma classique, le kératinocyte reçoit passivement la mélanine provenant du mélanocyte. Or le groupe de Janice Brissette a reévalué cette vision d’un rôle passif du kératinocyte dans le transfert des mélanosomes des mélanocytes vers les kératinocytes, et recherché une fonction active de ces derniers dans le transfert de la mélanine [
1]. En d’autres termes, les kératinocytes instruiraient-ils les mélanocytes pour induire, diriger la mélanine vers eux ? |
Rôle du gène Foxn1 muté dans le transfert de mélanine Le facteur de transcription Foxn1 est essentiel au développement de divers tissus épithéliaux et son invalidation chez la souris provoque le phénotype bien connu de souris nude [
2]1. L’absence de Foxn1 n’affecte pas la formation des follicules pileux [
3,
4], mais la rigidité globale du poil. Les poils des souris nude se courbent, vrillent et cassent rapidement. L’expression de Foxn1 est restreinte à la partie corticale des follicules pileux servant au maintien de la structure, mais la protéine n’est produite ni par les mélanocytes ni par les kératinocytes interfolliculaires. Weiner et al. ont analysé la pigmentation des follicules pileux des souris nude. Les mélanocytes sont présents et pigmentés, les cellules de la medulla du bulbe pileux sont également pigmentées mais les cellules du cortex ne le sont pas (Figure 1). Ces résultats indiquent que les mélanocytes ne sont pas responsables du défaut de pigmentation, mais que ce défaut est attribuable aux cellules épithéliales réceptrices du pigment dans la partie corticale. Ces cellules épithéliales ne seraient donc pas aussi passives pour recevoir la mélanine que nous pouvions le croire.
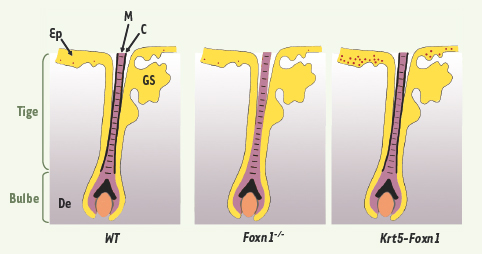
 | Figure 1.
Distribution de la pigmentation dans un follicule pileux d’une souris sauvage (WT), nude (Foxn1−/−) et transgénique (Krt5-Foxn1). La mélanine (représentée par des points rouges) est présente dans le cortex et la medulla des follicules pileux des souris sauvages ; dans la medulla uniquement et pas dans le cortex des folllicules des souris Foxn1−/−
et dans le cortex, la medulla et dans l’épiderme (où l’expression est forte) des souris transgéniques Krt5-Foxn1 qui expriment de façon ectopique Foxn1 dans les kératinocytes de la partie basale de l’épiderme. GS : glande sébacée ; M : medulla ; C : cortex ; Ep : épiderme ; De : derme. |
Le défi, pour démontrer cette hypothèse, impliquait d’induire l’accumulation de mélanine dans des kératinocytes qui en étaient dépourvus dans la situation normale. Les kératinocytes épidermiques de la région interfolliculaire des souris sauvages possèdent cette caractéristique. Weiner et al. ont alors produit des souris transgéniques (Krt5-Foxn1) dans lesquelles le promoteur Krt5 (keratin 5) induit l’expression ectopique du gène Foxn1, et de la protéine correspondante, dans les kératinocytes interfolliculaires de la couche basale. Le résultat observé fut une accumulation de mélanine à cet endroit. Par quel intermédiaire Foxn1, un facteur de transcription exprimé par certains kératinocytes, instruit-il les mélanocytes à délivrer le pigment dans les cellules exprimant Foxn1 ? De manière simplifiée, Foxn1 peut induire/réprimer l’expression d’un gène contrôlant l’adhésion entre les kératinocytes et les mélanocytes ou/et l’induction et le transfert des pigments. Un candidat potentiel était FGF2 ou bFGF (basic fibroblast growth factor). FGF2 est un facteur de croissance soluble impliqué dans la prolifération, la différenciation, la survie et le chimiotactisme des mélanocytes [
5–
8]. Effectivement, les auteurs montrent que l’expression de FGF2 est plus importante dans les cultures de kératinocytes établies à partir des souris Krt5-Foxn1 que les souris sauvages. L’injection d’anticorps bloquants dirigés contre cette protéine FGF2 entraîne une dépigmentation dans l’épiderme des souris Krt5-Foxn1, ce qui prouve la fonction de FGF2 sur la pigmentation. Toutefois, les auteurs ne montrent pas l’effet inverse, la diminution de l’expression de FGF2 en réponse à la répression de Foxn1, aussi bien in vitro que in vivo. N’aurait-il pas été plus judicieux de croiser les souris FGF2−/−
, qui n’ont pas de phénotype de pigmentation, avec les souris Krt5-Foxn1 ? |
Le premier gène, mais pas le seul… De multiples gènes sont impliqués dans la pigmentation, plus de 150 gènes chez la souris d’après le dernier recensement [
9]. Ces gènes peuvent affecter le devenir des mélanocytes (prolifération, survie, migration, etc.), la biogenèse des mélanines et le transport/transfert des mélanosomes.
Foxn1 est le premier gène impliqué dans la fonction réceptrice de pigment, mais il ne représente que l’un des protagonistes : en effet, Foxn1 n’est exprimé que dans la moitié des cellules réceptrices de pigment, son action n’est donc pas universelle mais limitée à une catégorie de kératinocytes. D’autre part, lors de la formation du poil, les mélanocytes sont en contact avec sept types différents de cellules épithéliales mais ils ne délivrent le pigment qu’à deux d’entre eux, les précurseurs du cortex et de la medulla de la tige pilaire. Enfin, Foxn1 est présent dans les cellules réceptrices de pigment dans le cortex mais pas dans la medulla. D’autres mécanismes doivent donc intervenir pour conférer ce statut de cellules réceptrices de pigment, et pourraient impliquer Kitl, Nog, Egfr, F2rl1, et des dérivés de Pomc1 (pro-opiomelanocortin-alpha) que les auteurs citent, mais également Par2 et Kgf (keratinocyte growth factor 7, ou Fgf7). Un grand nombre de conclusions émises par le groupe de J. Brissette restent à démontrer. Cependant, ce travail a le mérite de poser des questions fondamentales, et d’ouvrir une porte vers l’identification de quelques secrets sur les mécanismes de la pigmentation. |
Footnotes |
1. Weiner L, Han R, Scicchitano BM, et al. Dedicated epithelial recipient cells determine pigmentation patterns. Cell 2007; 130 : 932–42. 2. Nehls M, Pfeifer D, Schorpp M, et al. New member of the winged-helix protein family disrupted in mouse and rat nude mutations. Nature 1994; 372 : 103–7. 3. Bernard BA. La vie révélée du follicule de cheveu humain. Med Sci (Paris) 2006; 22 : 138–43. 4. Aberdam D. Réparer ou régénérer, il faut choisir… Med Sci (Paris) 2007; 23 : 791–3. 5. Halaban R, Ghosh S, Baird A. bFGF is the putative natural growth factor for human melanocytes. In Vitro Cell Dev Biol 1987; 23 : 47–52. 6. Herlyn M, Mancianti ML, Jambrosic J, et al. Regulatory factors that determine growth and phenotype of normal human melanocytes. Exp Cell Res 1988; 179 : 322–31. 7. Horikawa T, Norris DA, Yohn JJ, et al. Melanocyte mitogens induce both melanocyte chemokinesis and chemotaxis. J Invest Dermatol 1995; 104 : 256–9. 8. Pla P, Solov’eva O, Moore R, et al. Dct::lacZ ES cells: a novel cellular model to study melanocyte determination and differentiation. Pigment Cell Res 2004; 17 : 142–9. 9. Bennett DC, Lamoreux, ML. The color loci of mice: a genetic century. Pigment Cell Res 2003; 16 : 333–44. |