| |
| Med Sci (Paris). 2008 March; 24(3): 231–233. Published online 2008 March 15. doi: 10.1051/medsci/2008243231.Rôle néfaste du récepteur CD16 dans le sepsis
Meryem Aloulou,1 Fabiano Pinheiro da Silva,2 David Skurnik,3 Marc Benhamou,1 and Renato C. Monteiro1* 1Inserm U699, Université Paris 7, Faculté de Médecine Paris 7, Denis Diderot-Xavier Bichat, 16, rue Henri Huchard, 75870 Paris Cedex 18, Paris, France 2Emergency Medicine Department, University of São Paulo, São Paulo, Brésil 3Département de Microbiologie, Hôpital Bichat-Claude Bernard (APHP) et EA 6934, Université Paris 7, Paris, France MeSH keywords: Animaux, Antigènes CD, Cytokines, Multirésistance bactérienne, Escherichia coli, Infections à Escherichia coli, France, Protéines liées au GPI, Humains, Incidence, Sous-unité gamma commune des récepteurs aux interleukines, Souris, Phagocytose, Liaison aux protéines, Récepteurs du fragment Fc des IgG, Récepteurs immunologiques, Sepsie, Choc septique, Récepteurs de type Toll, Facteur-alpha de nécrose tumorale |
Le choc septique ou septicémie, est un syndrome clinique complexe qui résulte d’une réponse nocive de l’organisme infecté par un pathogène. Causé par une réponse exagérée des défenses immunitaires de l’individu face à une infection, le sepsis se manifeste par une réaction inflammatoire généralisée, et de graves troubles de la coagulation. Cette pathologie infectieuse aiguë grave peut notamment provoquer une défaillance progressive de certains organes menant au décès du patient. En France, en 2003, sur les 25 000 morts dues aux maladies infectieuses, environ 4 000 décès l’ont été par les septicémies, soit quatre fois plus que le Sida (source InVS). L’incidence du sepsis est en augmentation, avec 83 cas pour 100 000 en 1979 et 240 cas pour 100 000 en 2001. L’augmentation de l’incidence de cette pathologie est préoccupante également par la résistance croissante des bactéries aux traitements par antibiotiques. De nouvelles stratégies thérapeutiques doivent donc être recherchées.
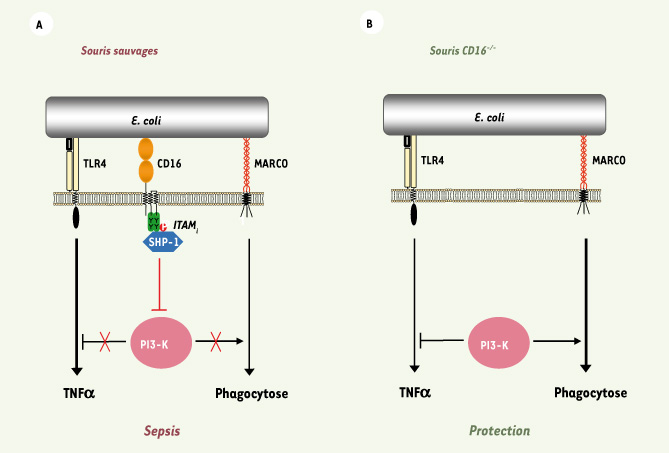
 | Figure 1.
Schéma hypothétique du rôle néfaste du CD16 au cours du choc septique. A. E. coli induit la phosphorylation partielle du motif ITAM de la chaîne γ-associée au CD16 et le recrutement de SHP-1, ainsi que la co-agrégation du CD16, du TLR4 et de MARCO. Cela induit l’inhibition de la PI3 kinase résultant en l’inhibition de la phagocytose par le récepteur scavenger MARCO et la libération de la voie du TLR4 avec une augmentation de la production du TNF-α facilitant le développement du choc septique. B. L’absence de CD16 permet le maintien de l’activation de la voie PI3 kinase résultant dans l’augmentation de la phagocytose et la suppression de production de TNF-α par le TLR4. |
|
Réponse inappropriée du système immunitaire inné au cours du sepsis Chez l’individu normal, les anticorps circulants assurent la défense anti-infectieuse en deux temps. Dans un premier temps, ils se lient aux micro-organismes permettant l’activation des voies du complément. Dans un deuxième temps, les complexes immuns bactéries-anticorps se fixent sur les cellules du système immunitaire par l’intermédiaire des récepteurs aux immunoglobulines (Ig) induisant leur agrégation. Cela induit l’activation de ces cellules et la phagocytose de l’agent infectieux. D’autres mécanismes indépendants des anticorps permettent la capture et la phagocytose des bactéries. Ceux-ci impliquent d’autres récepteurs comme les récepteurs scavengers. Chez les patients atteints de sepsis, les composantes du système immunitaire inné qui normalement contribuent à la défense de l’hôte contre l’agent infectieux, provoquent des dommages tissulaires, contribuant à la perte de fonction des organes touchés. Cela représente l’indice clinique de la septicémie. Cette autodestruction est due au moins en partie à une production excessive de cytokines pro-inflammatoires comme le TNF-α (tumor necrosis factor-α), en réponse à l’activation de récepteurs du système immunitaire tels que les récepteurs toll like (TLR) et TREM [
1–
3]. La réponse anti-infectieuse est contrôlée par la balance entre des signaux activateurs et des signaux inhibiteurs. Un des mécanismes qui contrôle l’inflammation implique le motif ITAM (immunoreceptor tyrosine-based activation motif) présent dans la chaîne γ, une sous-unité commune à plusieurs récepteurs pour les immunoglobulines (RFc, récepteur pour le fragment Fc), et dans l’adaptateur DAP12, tous deux connus comme médiateurs de signaux activateurs. Récemment une nouvelle fonction leur a été attribuée : ils sont également capables d’induire un signal inhibiteur. Dans le cas du RFcαI, récepteur du fragment Fc des IgA qui est associé à la sous-unité γ, le ciblage de ce récepteur par une IgA monomérique inhibe l’inflammation [
4]. De manière similaire et dans certaines conditions, DAP12 associé à TREM-2 inhibe la signalisation des récepteurs TLR [
5]. |
E. coli et son récepteur CD16, un couple délétère dans le sepsis
La chaîne γ pouvant jouer un rôle activateur ou inhibiteur, nous avons cherché à déterminer lequel de ces rôles elle assurait lors du sepsis [
6]. Nous avons observé que les souris déficientes pour la sous-unité γ sont résistantes au choc septique induit par une péritonite. L’étude du mécanisme en jeu a mis en évidence une forte augmentation de la phagocytose des E. coli, indépendante de la présence d’anticorps et, de façon opposée, une plus faible sécrétion de TNF-α dans la circulation et dans la cavité péritonéale chez les souris déficientes en chaîne γ. Parmi plusieurs récepteurs candidats associés à γ, le CD16 (RFcγIII) a été identifié comme un récepteur pour E. coli en l’absence d’anticorps. Cela a été également montré chez l’homme [
7]. Confirmant l’implication de CD16, les souris déficientes en CD16 sont également résistantes au choc septique. La liaison E. coli-CD16 induit un signal délétère via la sous-unité γ, aboutissant à l’inhibition de la phagocytose par d’autres récepteurs comme le récepteur scavenger MARCO. Cette inhibition est due à une phosphorylation partielle du motif ITAM de la chaîne γ associée au CD16. Nous définissons cette configuration comme ITAM inhibiteur ou ITAMi. Cette configuration ITAMi induit le recrutement de la tyrosine kinase Syk et surtout de la tyrosine phosphatase SHP-1. En conséquence, les voies d’activation de la phagocytose, comme la voie de la PI3-kinase sont inhibées. La PI3-kinase étant un régulateur négatif du TLR-4 [
8], une autre conséquence de son inhibition est une production excessive de TNF-α, après stimulation par E. coli. Ces travaux dévoilent un mécanisme par lequel E. coli échappe au système immunitaire en détournant à son profit des mécanismes régulateurs de ce système. D’autres études ont montré que des récepteurs associés à DAP12 jouent également un rôle délétère lors du sepsis [
9]. Ainsi, ces données expliquent pourquoi le système immunitaire se montre, chez certains patients, incapable d’assurer une défense efficace contre E. coli. Le développement de médicaments bloquant l’interaction entre E. coli et le CD16 devrait donc prévenir une inhibition indésirable permettant ainsi à la défense anti-infectieuse d’assurer sa fonction et d’éviter le choc septique. C’est là une nouvelle voie, complémentaire aux antibiotiques, qui devrait permettre d’améliorer considérablement le traitement de cette maladie grave et importante en santé publique. |
1. Cohen J. The immunopathogenesis of sepsis. Nature 2002; 420 : 885–91. 2. Nathan C. Points of control in inflammation. Nature 2002; 420 : 846–52. 3. Gibot S. Nouveaux acteurs de l’immunité innée : les récepteurs TREM. Med Sci (Paris) 2004; 20 : 503–5. 4. Pasquier B, Launay P, Kanamaru Y et al. Identification of FcaRI as an inhibitory receptor that controls inflammation: dual role of FcRγ ITAM. Immunity 2005; 22 : 31–42. 5. Hamerman JA, Tchao NK, Lowell CA, et al. Enhanced Toll-like receptor responses in the absence of signaling adaptor DAP12. Nat Immunol 2005; 6 : 579–86. 6. Pinheiro da Silva F, Aloulou M, Skurnik D, et al. D16 promotes Escherichia coli sepsis through an FcRgamma inhibitory pathway that prevents phagocytosis and facilitates inflammation. Nat Med 2007; 13 :1368–74. 7. Salmon JE, Kapur S, Kimberly RP. Opsonin-independent ligation of Fc gamma receptors. The 3G8-bearing receptors on neutrophils mediate the phagocytosis of concanavalin A-treated erythrocytes and nonopsonized Escherichia coli. J Exp Med 1987; 166 : 1798–813. 8. Liew FY, Xu D, Brint EK, O’Neill LA. Negative regulation of toll-like receptor-mediated immune responses. Nat Rev Immunol 2005; 5 : 446–58. 9. Turnbull IR, McDunn JE, Takai T, et al. DAP12 (KARAP) amplifies inflammation and increases mortality from endotoxemia and septic peritonitis. J Exp Med 2005; 202 : 363–9. |