| |
| Med Sci (Paris). 2008 March; 24(3): 297–300. Published online 2008 March 15. doi: 10.1051/medsci/2008243297.L’ampk : un lien entre métabolisme et reproduction ? Lucie Tosca,1* Christine Chabrolle,1,2* and Joëlle Dupont1* 1Unité de Physiologie de la Reproduction et des Comportements, UMR 6175 Inra-CNRS-Université François Rabelais de Tours, 37380 Nouzilly, France 2Unité d’Endocrinologie, de Diabétologie et des Maladies Métaboliques, CHRU Bretonneau, 37000 Tours, France |
La protéine kinase activée par l’AMP (AMPK) est une sérine/thréonine kinase hétérotrimérique. Elle est composée d’une sous-unité catalytique α et de deux sous-unités régulatrices β et γ, codées par des gènes différents et dont il existe pour chacune 2 ou 3 isoformes [
1,
2]. Ces différentes isoformes permettent ainsi la formation de 12 complexes possibles (αβγ). La prépondérance de chacun de ces complexes dépend du tissu. Par ailleurs, la localisation cellulaire de chaque sous-unité de l’AMPK est variable. Par exemple, la sous-unité α1 est présente surtout dans le cytosol alors que la sous-unité α2 est localisée à la fois dans le cytosol et le noyau. L’activité de l’AMPK est régulée allostériquement par la liaison de l’AMP ou de l’ATP sur la sous-unité régulatrice γ, par la phosphorylation de la sous-unité α sur la thréonine 172 par une AMPK kinase (STK11 : sérine/thréonine kinase 11 [LKB1] ou CaMKKβ [calmodulin-dependent kinase kinase-b] et par sa déphosphorylation via une phosphatase [protéine phosphatase-1] et -2A [PP2A et PP2C]). Le principal mécanisme d’activation de l’AMPK est la diminution du rapport ATP/AMP intracellulaire. L’AMPK est activée au cours de situations physiopathologiques (exercice, stress), par des hormones (leptine, adiponectine…) ou par des agents pharmacologiques (5-aminoimidazole-4-carboxamide-1-β-D-riboside [AICAR], metformine, thiazolidinediones [TZD]). Elle régule l’homéostasie énergétique en maintenant constante la concentration intracellulaire d’ATP par une stimulation des voies cataboliques et une inhibition des voies anaboliques. L’AMPK contrôle la prolifération et la survie cellulaires mais aussi les fonctions reproductrices telles que la stéroïdogenèse ovarienne et la maturation ovocytaire. Dans cet article, nous décrirons brièvement les rôles connus de l’AMPK dans le métabolisme énergétique et la reproduction femelle, puis le lien qu’elle pourrait représenter entre ces deux fonctions. |
Rôle de l’AMPK dans la régulation du métabolisme énergétique L’AMPK constitue un détecteur métabolique de l’état énergétique de la cellule et joue un rôle clé dans la régulation des métabolismes lipidique, protéique et glucidique au niveau des tissus périphériques et centraux [1–
4]. Elle intervient également dans l’action de certaines hormones comme la leptine, l’adiponectine et la résistine (trois adipokines), ou encore la ghréline (d’origine gastrique). Par exemple, la leptine, en activant l’AMPK, diminue la lipogenèse, augmente l’oxydation des acides gras (AG) et module la sécrétion de l’insuline. Au niveau central, la leptine, en inhibant l’AMPK, est responsable d’effets anorexigènes, via vraisemblablement un mécanisme impliquant le neuropeptide Y (NPY). Ainsi, l’AMPK s’ajoute à d’autres voies de signalisation de la leptine qui ont déjà été décrites comme par exemple la voie JAK (janus kinase)/STAT (signal transducers and activators of transcription). Second exemple, l’adiponectine augmente l’utilisation du glucose et l’oxydation des AG dans le muscle squelettique, la sensibilité à l’insuline (foie, muscle, tissu adipeux) et diminue la néoglucogenèse hépatique [2]. Ces effets sont dépendants de l’AMPK [2]. La résistine, quant à elle, en inhibant l’AMPK, augmente la production hépatique de glucose et inhibe l’utilisation des AG par le muscle squelettique [2]. Enfin, la ghréline inhibe l’AMPK, ce qui expliquerait ses effets positifs sur la néoglucogenèse et le stockage des AG. En revanche, dans l’hypothalamus, la ghréline augmente l’activité de l’AMPK et la prise alimentaire. Ainsi, par leur action centrale et périphérique, ces hormones peuvent contrôler le métabolisme énergétique via, en partie, une régulation de l’activité de l’AMPK. |
Rôle de l’AMPK dans la reproduction chez la femelle Contrôle ovarien de la reproduction L’implication potentielle de l’AMPK dans la reproduction et plus particulièrement dans le fonctionnement ovarien est récente. Dans trois espèces (poule, rate et vache), l’AMPK a été identifiée dans les différents types cellulaires du follicule (ovocyte, cumulus oophorus, cellules de la granulosa et de la thèque) et dans le corps jaune [
5–
7]. Son rôle a été étudié en détail in vitro dans la stéroïdogenèse des cellules de la granulosa [ 5– 7] de ces trois espèces et dans la maturation ovocytaire chez la souris, la vache et la truie [
8–
10]. L’AMPK inhibe la sécrétion de la progestérone et/ou celle de l’œstradiol en réponse à l’AICAR ou à la metformine [5–7]. Cette diminution s’explique par une inhibition de l’expression de certains facteurs de la stéroïdogenèse (3βHSD [3β-hydroxysteroid-deshydrogenase], p450scc [p450 side chain cleavage] ou StAR [steroidogenic acute regulatory protein]) et par une inhibition de la voie MAPK/ERK (mitogen-activated protein kinase/extracellular-regulated kinase). Chez la poule, l’activation de l’AMPK diminue dans les cellules de la granulosa au cours de la folliculogenèse terminale, ce qui suggère un rôle de la kinase dans la période pré-ovulatoire dans cette espèce. Quelques études ont par ailleurs établi un lien entre l’AMPK et la maturation méiotique de l’ovocyte [
25]. Chez la souris, l’AMPK améliore la reprise de la méiose (accélération du processus de rupture de la membrane nucléaire ou GVBD (germinal vesicle breack down) [8]) alors que chez le porc ou le bovin, une activation pharmacologique de l’AMPK bloque la maturation nucléaire de l’ovocyte (blocage en prophase de première division de méiose ou vésicule germinative (VG) [
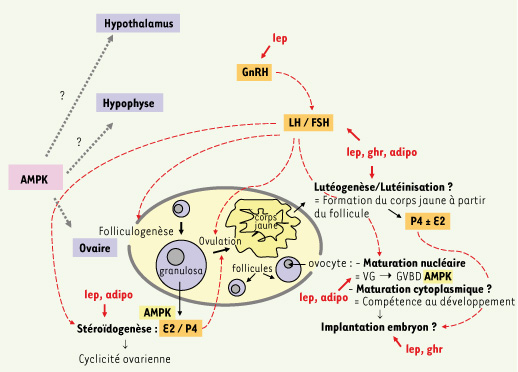
9, 10]). Bien qu’il existe des différences entre les espèces, l’AMPK semble être importante dans la transition VG-GVBD au cours de la maturation nucléaire des ovocytes. La qualité du développement de l’ovocyte et sa compétence s’acquièrent au cours de sa croissance pendant la folliculogenèse et pendant sa maturation cytoplasmique. Le rôle de l’AMPK au cours de la maturation nucléaire pourrait donc conditionner le développement embryonnaire précoce. Cependant il reste à déterminer si l’enzyme intervient dans la maturation cytoplasmique des ovocytes. Enfin, chez la rate, l’AMPK a été retrouvée dans le corps jaune. Elle pourrait à ce niveau contrôler le processus de lutéinisation, par exemple en phosphorylant PPARγ (peroxisome proliferator-activated receptor γ). Chez la vache, l’activation de PPARγ augmente la production de progestérone par le corps jaune. Ainsi, l’AMPK pourrait contrôler dans l’ovaire la stéroïdogenèse des cellules de la granulosa et la maturation ovocytaire mais aussi être impliquée dans les fonctions du corps jaune (Figure 1).  | Figure 1.
Schéma hypothétique de l’implication de l’AMPK dans le contrôle ovarien et central de la fonction de reproduction chez la femelle. L’AMPK pourrait être la cible des effets de certaines hormones (lep : leptine ; ghr : ghréline ; adipo : adiponectine) aux différents étages de l’axe hypothalamo-hypophysaire-ovarien. P4 : progestérone ; E2 : œstradiol ; LH : luteinizing hormone (d’origine hypophysaire) ; FSH : follicle stimulating hormone (d’origine hypophysaire) ; GnRH : gonadotropin-releasing hormone (d’origine hypothalamique) ; NPY : neuropeptide Y, VG : vésicule germinale, GVBD : germinal vesicle breakdown. |
Contrôle central de la reproduction Pour contrôler les fonctions de la reproduction, l’AMPK pourrait également agir sur l’axe hypothalamo-hypophysaire (Figure 1). En effet, l’AMPK est localisée dans l’hypothalamus où elle contrôle la prise alimentaire et la dépense énergétique [
11]. Or, les neurones à GnRH (g onadotropin-releasing hormone) sont aussi présents dans cette région et l’AMPK pourrait contrôler cette sécrétion. Par ailleurs, une étude montre que l’AMPK est présente dans les cellules de la lignée corticotrope hypophysaire AtT20 [
12]. L’AMPK pourrait donc être aussi présente dans l’hypophyse et y contrôler la sécrétion des gonadotropines LH ( luteinizing hormone) et FSH ( follicle stimulating hormone) qui régulent elles-mêmes les sécrétions de progestérone et d’œstradiol (Figure 1). Ainsi, une hypothétique régulation centrale de la fonction de reproduction par l’AMPK n’est pas à exclure et reste encore à être entièrement explorée. |
AMPK : un lien entre métabolisme et reproduction ? De nombreuses études ont souligné l’importance d’un statut nutritionnel adéquat dans le maintien de la fonction de reproduction. L’enjeu est de comprendre les moyens de communication existant entre le statut nutritionnel, le métabolisme énergétique et le système de reproduction. Certaines hormones (adipokines, ghréline, insuline/IGF-1 [insulin-like growth factor-1]) et certains métabolites (AG libres, glucose) ont été impliqués. Cependant les molécules signal dans la transmission de tels effets ont été peu étudiées. L’AMPK pourrait en faire partie comme cela a été suggéré pour PPARγ [
13–
15], une cible des TZD (thiazolidinediones). En effet, elle est activée par la metformine et pourrait l’être par les TZD. Nous décrirons successivement les arguments qui étayent cette hypothèse. Nous avons évoqué précédemment l’implication de l’AMPK dans le mécanisme d’action de certaines hormones du métabolisme. Or, ces hormones sont aussi impliquées, directement ou indirectement, dans le contrôle des fonctions de reproduction (Figure 1) [
16]. Leptine Les souris portant une mutation naturelle du gène ob/ob sont obèses, diabétiques et stériles. La leptine activerait l’axe hypothalamo-hypophysaire chez les rongeurs au moment de la puberté par une régulation de l’activité des neurones à GnRH et de la réponse hypophysaire (LH et FSH). Ses récepteurs ont été localisés dans les neurones hypothalamiques à NPY, eux-mêmes capables d’agir sur la sécrétion pulsatile du GnRH. La transduction de ce signal pourrait impliquer l’AMPK car la voie leptine/AMPK/NPY régule la prise alimentaire à ce niveau. Par ailleurs, la leptinémie varie au cours du cycle en fonction de la progestérone chez la femme. En particulier, elle pourrait intervenir lors de la formation du corps jaune, ce qui expliquerait la présence de l’AMPK dans cette structure. Par un mécanisme dépendant de l’AMPK, la leptine pourrait inhiber la stéroïdogenèse des cellules de la granulosa [
17] et réguler la maturation ovocytaire [
18]. Adiponectine Son mode d’action implique plusieurs voies: AMPK, MAPK, PPARα. L’adiponectine et ses récepteurs sont exprimés dans l’hypophyse (régulation de la sécrétion de LH [
19]) et dans l’ovaire de rate : corps jaune et cellules de la granulosa où elle régule la stéroïdogenèse comme l’AMPK [
20]. Par ailleurs, chez la truie, l’adiponectine induit l’expression de gènes associés à l’ovulation, et elle est présente dans l’ovocyte où elle pourrait réguler la maturation via l’AMPK [
21]. Enfin, chez la femme et la rate, le système adiponectine est présent dans l’utérus et le placenta [
22]. Résistine Son expression augmente dans l’hypophyse au cours de la puberté en réponse à un signal hypothalamique [ 16]. Chez le rongeur, la résistine est localisée dans les neurones contrôlant le comportement alimentaire [ 16]. À ce niveau, l’AMPK pourrait transmettre ses effets métaboliques et/ou reproducteurs. Ghréline Elle inhibe la sécrétion de LH/FSH en réponse au GnRH [
23] et est exprimée dans l’ovaire (expression cyclique). Son expression très prononcée dans le corps jaune est fonction de la progestérone [ 23]. Ainsi, l’AMPK pourrait être l’un des senseurs énergétiques à l’interface métabolisme/reproduction, pouvant expliquer les effets doubles (métaboliques et reproductifs) de certaines hormones telles la ghréline et les adipokines. |
Contrôle ovarien de la reproduction D’autres études seront nécessaires pour mieux caractériser l’implication de l’AMPK et de ses cibles dans les effets de certaines hormones sur le contrôle central et ovarien de la fonction de reproduction chez la femelle. En particulier, il est maintenant indispensable de préciser le degré de fertilité des souris dont les gènes codant pour certaines des sous-unités de l’AMPK sont mutés, les altérations du métabolisme énergétique ayant déjà été rapportées. Ces connaissances faciliteraient la compréhension de situations physiopathologiques pouvant impliquer l’AMPK, comme le syndrome des ovaires polykystiques chez la femme. Ce syndrome associe des troubles de la fertilité et des troubles du métabolisme, et la metformine, un activateur de l’AMPK, améliore la fertilité des femmes qui en sont atteintes. L’AMPK pourrait peut-être devenir une cible thérapeutique dans le traitement de l’infertilité d’une manière plus générale. Enfin, on ne peut pas exclure le rôle de l’AMPK dans la fertilité chez le mâle. En effet, une étude récente propose une implication directe de l’AMPK au cours de la spermatogenèse [
24]. |
1. Hardie DG. The AMP-activated protein kinase pathway: new players upstream and downstream. J Cell Sci 2004; 117 : 5479–87. 2. Kola B, Boscaro M, Rutter GA, et al. Expanding role of AMPK in endocrinology. Trends Endocrinol Metab 2006; 17 : 205–15. 3. Andreelli F, Viollet B, Vaulont S. Rôles physiologiques de l’AMP-activated protein kinase (AMPK). Med Sci (Paris) 2003; 19 : 541–2. 4. Foretz M, Taleux N, Guigas B, et al. Régulation du métabolisme énergétique par l’AMPK : une nouvelle voie thérapeutique pour le traitement des maladies métaboliques et cardiaques. Med Sci (Paris) 2006; 22 : 381–8. 5. Tosca L, Froment P, Solnais P, et al. Adenosine 5’-monophosphate-activated protein kinase regulates progesterone secretion in rat granulosa cells. Endocrinology 2005; 146 : 4500–13. 6. Tosca L, Crochet S, Ferre P, et al. AMP-activated protein kinase activation modulates progesterone secretion in granulosa cells from hen preovulatory follicles J Endocrinol 2006; 190 : 85–97. 7. Tosca L, Chabrolle C, Uzbekova S, et al. Effects of metformin on bovine granulosa cells steroidogenesis: possible involvement of adenosine 5’ monophosphate-activated protein kinase (AMPK). Biol Reprod 2007; 76 : 368–78. 8. Downs SM, Chen J. Induction of meiotic maturation in mouse oocytes by adenosine analogs. Mol Reprod Dev 2006; 73 : 1159–68. 9. Mayes MA, Laforest MF, Guillemette C, et al. Adenosine 5’ monophosphate kinase-activated protein kinase (PRKA) activators delay meiotic resumption in porcine oocytes. Biol Reprod 2007; 76 : 589–97. 10. Tosca L, Uzbekova S, Chabrolle C, Dupont J. Possible role of 5’AMP-activated protein kinase in the metformin-mediated arrest of bovine oocytes at the germinal vesicle stage during in vitro maturation. Biol Reprod 2007; 77 : 452–65. 11. Mountjoy PD, Bailey SJ, Rutter GA. Inhibition by glucose or leptin of hypothalamic neurons expressing neuropeptide Y requires changes in AMP-activated protein kinase activity. Diabetologia 2007; 50 : 168–77. 12. Iwasaki Y, Nishiyama M, Taguchi T et al. Activation of AMP-activated protein kinase stimulates proopiomelanocortin gene transcription in AtT20 corticotroph cells. Am J Physiol Endocrinol Metab 2007; 292 : E1899–905. 13. Froment P, Gizard F, Staels B, et al. Un rôle pour PPARgamma dans la reproduction ? Med Sci (Paris) 2005; 21 : 507–11. 14. Froment P, Gizard F, Defever D, et al. Peroxisome proliferator-activated receptors in reproductive tissues: from gametogenesis to parturition. J Endocrinol 2006; 189 : 199–209. 15. Komar CM. Peroxisome proliferator-activated receptors (PPARs) and ovarian function : implications for regulating steroidogenesis, differentiation, and tissue remodeling. Reprod Biol Endocrinol 2005; 3 : 41. 16. Mitchell M, Armstrong DT, Robker RL, Norman RJ. Adipokines: implications for female fertility and obesity. Reproduction 2005; 130 : 583–97. 17. Spicer LJ, Francisco CC. Adipose obese gene product, leptin, inhibits bovine ovarian thecal cell steroidogenesis. Biol Reprod 1998; 8 : 207–12. 18. Craig J, Zhu H, Dyce PW, et al. Leptin enhances oocyte nuclear and cytoplasmic maturation via the mitogen-activated protein kinase pathway. Endocrinology 2004; 145 : 5355–63. 19. Rodriguez-Pacheco F, Martinez-Fuentes AJ, Tovar S, et al. Regulation of pituitary cell function by adiponectin. Endocrinology 2007; 148 : 401–10. 20. Chabrolle C, Tosca L, Dupont J. Regulation of adiponectin and its receptors in rat ovary by human chorionic gonadotrophin treatment and potential involvement of adiponectin in granulosa cell steroidogenesis. Reproduction 2007; 133 : 719–31. 21. Ledoux S, Campos DB, Lopes FL, et al. Adiponectin induces periovulatory changes in ovarian follicular cells. Endocrinology 2006; 147 : 5178–86. 22. Caminos JE, Nogueiras R, Gallego R, et al. Expression and regulation of adiponectin and receptor in human and rat placenta. J Clin Endocrinol Metab 2005; 90 : 4276–86. 23. Garcia MC, Lopez M, Alvarez CV, et al. Role of ghrelin in reproduction. Reproduction 2007; 133 : 531–40. 24. Galardo MN, Riera MF, Pellizzari EH, et al. The AMP-activated protein kinase activator, 5-aminoimidazole-4-carboxamide-1-b-D-ribonucleoside, regulates lactate production in rat Sertoli cells. J Mol Endocrinol 2007; 39 : 279–88. 25. Terret E, Wassmann K. Le point faible méiotique : la première division. Med Sci (Paris) 2008; 24 : 197–204. |