| |
| Med Sci (Paris). 2008 April; 24(4): 369–371. Published online 2008 April 15. doi: 10.1051/medsci/2008244369.Un nouveau mode de régulation de FoxO1 par O-glycosylation Implication dans le phénomène de glucotoxicité MeiShiue Kuo, Vladimir Zilberfarb, Nicolas Gangneux, Névéna Christeff, and Tarik Issad* Institut Cochin, Université Paris Descartes, CNRS (UMR 8104), Inserm, U567, 22, rue Méchain, 75014 Paris, France MeSH keywords: Acétyl-glucosamine, Complications du diabète, Facteurs de transcription Forkhead, Glucose, Glycogène, Glycolyse, Glycosylation, Hexosamine, Homéostasie, Humains, Modèles biologiques, Obésité |
O-glycosylations des protéines et disponibilité en glucose La mono-O-glycosylation des protéines, découverte en 1984, correspond à l’addition, via une réaction enzymatique, de N-acétyl glucosamine (GlcNAc) sur le résidu hydroxyl d’une sérine ou d’une thréonine [
1,
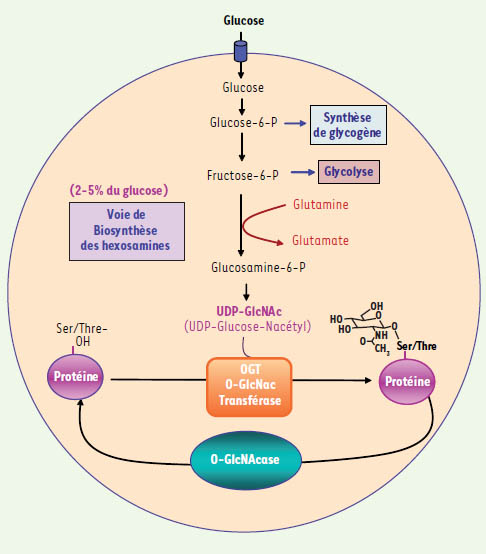
2]. Cette modification réversible, qui peut se faire dans le cytoplasme ou le noyau, doit être distinguée des glycosylations complexes qui, dans le réticulum endoplasmique et le Golgi, modifient de façon stable les protéines membranaires ou sécrétées. De façon analogue aux phosphorylations, les O-glycosylations cytosoliques ou nucléaires peuvent moduler l’activité, la localisation ou la stabilité des protéines. Cependant, contrairement à la pléïade de kinases et phosphatases qui régulent les phosphorylations, seules deux enzymes sont impliquées dans le contrôle de ces O-glycosylations (Figure 1). L’enzyme permettant la réaction de O-glycosylation est la O-linked N-acetyl-glucosamine transferase (OGT). Les protéines O-glycosylées peuvent être rapidement déglycosylées par une autre enzyme, la β-N-acétylglucosaminidase (OGlcNAcase) (Figure 1).
 | Figure 1.
Régulation de l’activité fonctionnelle des protéines par O-glycosylation/déglycosylation sur sérine ou thréonine.
|
Une fraction (2-5 %) du glucose entrant dans la cellule est converti en UDP–N-acétyl glucosamine (UDP-GlcNAc), par la voie de biosynthèse des hexosamines. Le niveau d’UDP-GlcNAc dans la cellule reflète le flux de glucose à travers cette voie. L’OGT peut donc être considérée comme un « senseur métabolique du glucose », capable de modifier les protéines en fonction des changements de disponibilité en glucose. Un raffinement supplémentaire dans les possibilités de régulation des protéines est introduit par le fait qu’un même résidu sérine ou thréonine peut être soit O-glycosylé, soit phosphorylé, les deux modifications étant mutuellement exclusives (phénomène de Yin-Yang). Ce mode de régulation des protéines constitue un domaine de recherche fascinant, qui pourrait bouleverser de nombreux champs de la biologie. En effet, dans la mesure où le glucose représente le substrat énergétique le plus largement utilisé par les êtres vivants, une régulation fine de l’activité des protéines en fonction de sa disponibilité constitue certainement un aspect majeur, encore relativement peu exploré, du fonctionnement normal de la cellule. En outre, ces mécanismes de O-glycosylation pourraient être particulièrement importants dans les situations où les concentrations de glucose sont chroniquement altérées, comme c’est le cas chez les patients obèses ou diabétiques. |
O-glycosylation de FoxO1 et induction de la glucose-6-phosphatase FoxO1 appartient à une famille de facteurs de transcription contrôlant l’expression de gènes impliqués dans des processus cellulaires fondamentaux, comme l’apoptose, la réponse au stress oxydant, la prolifération cellulaire, la différenciation cellulaire et la régulation du métabolisme énergétique [
3]. Plusieurs modifications post-traductionnelles (phosphorylations, acétylations, ubiquitinylations) peuvent moduler l’activé de ce facteur de transcription. Dans la mesure où FoxO1 joue un rôle majeur dans la régulation du métabolisme énergétique, nous avons émis l’hypothèse que ce facteur pourrait également être régulé par O-glycosylation. Nous avons ainsi montré, pour la première fois, que les traitements qui augmentent la O-glycosylation des protéines (fortes concentrations en glucose, glucosamine) ou qui inhibent leur déglycoyslation (inhibiteur de l’enzyme O-GlcNAcase), induisent la O-glycosylation de FoxO1 [
4]. Nous avons également montré, dans les cellules HEK293 et dans les cellules hépatocytaires HepG2, que ces traitements stimulent l’expression d’un gène rapporteur comprenant le promoteur de la glucose 6-phosphatase (G6Pase) en amont d’une luciférase, sans aucune modification de la concentration intracellulaire (stabilité) ou de la localisation sub-cellulaire de FoxO1 (noyau versus cytoplasme). Les effets de ces traitements sont augmentés par la surexpression de FoxO1 ou de l’OGT et sont abolis par des siRNA inhibant l’expression de FoxO1 suggérant un lien causal direct avec FoxO1 [4]. Nous avons par ailleurs montré, par RT-PCR en temps réel, que l’expression endogène du gène de la G6Pase est augmentée par les traitements induisant la O-glycosylation de FoxO1 dans les cellules HepG2 [4]. L’expression d’autres gènes cibles de FoxO1 (insulin- like growth factor binding protein 1, peroxisome proliferator activated receptor γ co-activator 1) est également stimulée par ces traitements, alors que celle de gènes ne portant pas d’éléments de réponse à FoxO1 ne varie pas (résultats non publiés). |
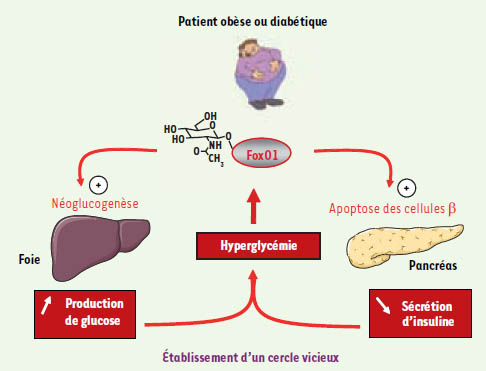
Hyperglycémie chronique et O-glycosylation de FoxO1 : conséquences chez le patient diabétique Nous avons donc mis en évidence un nouveau mode de régulation post-traductionnel de l’activité de FoxO1, dépendant de la disponibilité en glucose dans la cellule. Cette observation pourrait être importante vis-à-vis du phénomène de glucotoxicité observé chez les patients obèses ou diabétiques. Chez ces patients, l’hyperglycémie per se a des effets délétères sur les cellules pancréatiques et sur les tissus cibles de l’insuline, ce qui conduit à une aggravation de l’intolérance au glucose. Une production excessive de glucose par néoglucogénèse dans le foie est une des causes majeures de l’hyperglycémie de ces patients [
5,
6]. L’hydrolyse du glucose-6-phosphate en glucose par la G6Pase constitue l’étape finale et obligatoire pour la libération du glucose dans la circulation. Dans la mesure où la O-glycosylation de FoxO1 stimule son activité transcriptionnelle vis-à-vis du gène de la G6Pase, il est possible que l’hyperglycémie chronique induise une O-glycosylation anormale de FoxO1, conduisant à une surexpression de la G6Pase, une production accrue de glucose et donc une aggravation de l’hyperglycémie. Un cercle vicieux s’établirait, dans lequel le glucose entretiendrait l’hyperglycémie chronique en induisant la O-glycosylation de FoxO1 (Figure 2). Il faut en outre rappeler que l’hyperglycémie chronique a également des effets délétères au niveau pancréatique, en diminuant la survie et en augmentant l’apoptose des cellules β du pancréas. Dans la mesure où FoxO1 joue un rôle central dans les mécanismes de mort cellulaire [
7], en particulier dans la cellule β-pancréatique [
8], une augmentation de son activité transcriptionnelle par O-glycosylation pourrait aussi expliquer certains effets toxiques du glucose sur la fonction pancréatique (Figure 2).
 | Figure 2.
Implication potentielle de FoxO1 dans le phénomène de glucotoxicité.
|
|
Conclusion et perspectives Au-delà de son rôle dans la régulation du métabolisme énergétique et dans le phénomène de glucotoxicité, la O-glycosylation de FoxO1 pourrait aussi être importante dans des processus pathologiques impliquant la prolifération et la survie cellulaires. FoxO1, considéré comme un facteur anti-prolifératif et pro-apoptotique, pourrait en particulier constituer une cible thérapeutique intéressante pour le traitement du cancer. En effet, dans la mesure où les cellules cancéreuses sont connues pour être de très grosses consommatrices de glucose, des manipulations pharmacologiques visant à réorienter une partie de ce glucose vers la voie de biosynthèse des hexosamines pourrait constituer des pistes de recherche intéressantes pour tenter d’inhiber la croissance tumorale par le biais d’une O-glycosylation accrue de FoxO1. |
1. Comer FI, Hart GW. O-Glycosylation of nuclear and cytosolic proteins. Dynamic interplay between O-GlcNAc and O-phosphate. J Biol Chem 2000; 275 : 29179–82. 2. Hanover JA. Glycan-dependent signaling: O-linked N-acetylglucosamine. Faseb J 2001; 15 : 1865–76. 3. Brunet A. Les multiples actions des facteurs de transcription FOXO. Med Sci (Paris) 2004; 20 : 856–9. 4. Kuo M, Zilberfarb V, Gangneux N, Christeff N, Issad T. Oglycosylation of FoxO1 increases its transcriptional activity towards the glucose 6-phosphatase gene. FEBS Lett 2008; 582 : 829–34. 5. Bell PM, Firth RG, Rizza RA. Assessment of insulin action in insulin-dependent diabetes mellitus using [6(14)C]glucose, [3(3)H]glucose, and [2(3)H]glucose. Differences in the apparent pattern of insulin resistance depending on the isotope used. J Clin Invest 1986; 78 : 1479–86. 6. DeFronzo RA. Lilly lecture 1987. The triumvirate: beta-cell, muscle, liver. A collusion responsible for NIDDM. Diabetes 1988; 37 : 667–87. 7. Huang H, Tindall DJ. Dynamic FoxO transcription factors. J Cell Sci 2007; 120 : 2479–87. 8. Glauser DA, Schlegel W. The emerging role of FOXO transcription factors in pancreatic beta cells. J Endocrinol 2007; 193 : 195–207. |