| |
| Med Sci (Paris). 2008 April; 24(4): 383–389. Published online 2008 April 15. doi: 10.1051/medsci/2008244383.Cibler les télomères pour forcer les cellules cancéreuses à rentrer en sénescence Arturo Londoño-Vallejo,1 Christelle Lenain,2 and Eric Gilson2* 1Laboratoire Télomères et Cancer, UMR7147, Institut Curie-CNRS-UPMC, 26, rue d’Ulm, 75248 Paris, France 2Laboratoire de Biologie Moléculaire de la Cellule, CNRS UMR5239, IFR128, École Normale Supérieure de Lyon, Faculté de Médecine Lyon-Sud, 165, Chemin du Grand Revoyet, 69495 Pierre Bénite, France |
La sénescence cellulaire est définie comme un arrêt permanent dans le cycle, généralement à la transition G1/S, dans lequel les cellules sont réfractaires à toute stimulation mitogénique [
1]. Après un nombre défini de divisions, les cellules primaires humaines entrent en sénescence, suggérant qu’un mécanisme « compte » le nombre de divisions. L’érosion télomérique, rythmée par le nombre de divisions, est le principal mécanisme responsable de cette forme de sénescence, appelée sénescence réplicative. Néanmoins, d’autres voies, généralement liées à la réponse à un stress exogène, peuvent déclencher un arrêt cellulaire similaire à celui de la sénescence réplicative. C’est ce que l’on appelle la sénescence prématurée, qui peut être déclenchée par une activation mitogénique supraphysiologique, en réponse par exemple à l’expression d’un oncogène, par un stress génotoxique ou par une modification de la chromatine, par exemple par des agents déméthylants. Tous les types de sénescence cellulaire ont en commun des voies de signalisation et des caractéristiques morphologiques. Ainsi, l’activation de p53 apparaît très importante pour l’entrée en sénescence. Il est bien documenté que la mort cellulaire peut servir à limiter la prolifération tumorale [
2]. Plus récemment, une série d’articles a montré que la sénescence, lorsqu’elle est induite par des oncogènes, constitue aussi une barrière très efficace contre la formation de tumeurs malignes [
3]. Dans ce contexte, deux articles viennent de démontrer que, chez la souris, la perte excessive d’ADN télomérique bloque le développement tumoral en induisant la sénescence réplicative [
4,
5]. Ces résultats confirment le rôle de la sénescence dans la suppression tumorale, indiquent que le dysfonctionnement télomérique peut forcer les cellules cancéreuses à rentrer en sénescence et attestent de l’intérêt pour des stratégies thérapeutiques anti-cancéreuses qui cibleraient la télomérase et les télomères. |
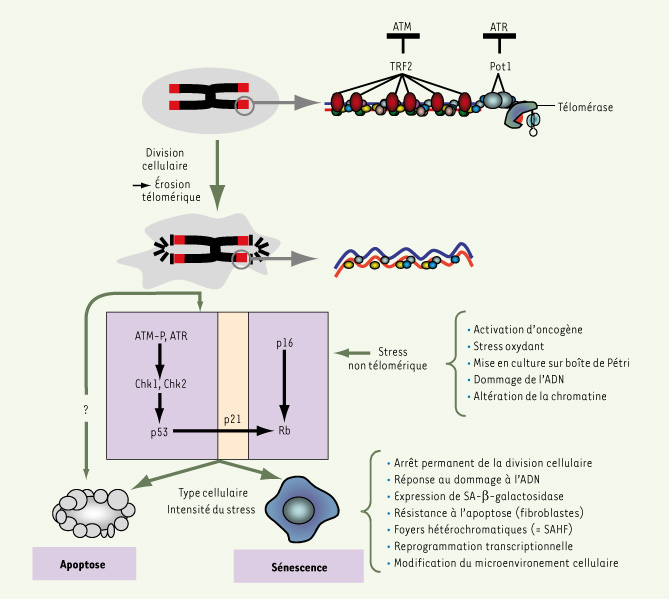
Structure et fonctions des télomères Les télomères préservent l’intégrité du matériel génétique au cours du cycle cellulaire et participent à l’architecture fonctionnelle des chromosomes. L’ADN télomérique est de nature répétée. Il est raccourci à chaque division cellulaire car la réplication des extrémités d’une molécule d’ADN linéaire est incomplète [
6] (Figure 1). L’érosion réplicative des télomères peut être compensée par l’action de la télomérase, une transcriptase inverse spécialisée qui se sert d’un ARN matrice spécifique pour allonger le brin 3’ des extrémités chromosomiques. Il existe aussi des mécanismes d’allongement des télomères indépendants de la télomérase et fondés sur des événements de recombinaison homologue appelés ALT (alternative lengthening of telomeres) [
7]. De plus, les télomères empêchent les extrémités de chromosomes d’être reconnues comme des dommages de l’ADN. La division des cellules en l’absence d’un mécanisme efficace de maintenance des télomères a pour conséquence la formation de télomères courts qui perdent une partie de leur fonction de protection et qui vont donc être signalés à la cellule comme un ADN endommagé, ce qui va aboutir à un arrêt de la prolifération suite à l’activation des voies p53 et pRb/p16 [
8]. Cet arrêt correspond, selon les types cellulaires et l’intensité du dommage télomérique, à une entrée en sénescence ou à une mort par apoptose (Figure 1).  | Figure 1.
Structure des télomères et conséquences de leur dysfonctionnement. L’extrémité des chromosomes forme une structure nucléoprotéique particulière. Dans les cellules où l’activité télomérase est insuffisante pour compenser l’érosion réplicative de l’ADN télomérique, un raccourcissement excessif des télomère va désorganiser cette structure qui ne sera plus capable de protéger l’extrémité chromosomique correspondante contre la réponse à l’ADN endommagé [ 6]. Cela a pour conséquence d’activer les voies p53/p21 et p16/pRb. Suivant le contexte cellulaire ou le degré de dysfonctionnement télomérique, cette signalisation provoque l’apoptose ou la sénescence. Le dysfonctionnement télomérique peut aussi entraîner une apoptose dans des cellules dépourvues de p53 par une voie encore inconnue. Les modèles actuels de l’entrée en sénescence réplicative reposent sur une perte critique du nombre de protéines Pot1 et TRF2 localisées aux télomères. Les principales caractéristiques de la cellule sénescente sont indiquées sur la figure. Les cellules sénescentes accumulent des foyers héterochromatiques appelés SAHF ( senescence associated heterochromatin foci) qui semblent jouer un rôle dans le verrouillage de l’expression de gènes favorisant l’entrée en phase S, comme ceux régulés par E2F. La sénescence peut être déclenchée indépendamment d’un dysfonctionnement télomérique, à la suite d’une série de stress listé sur la figure. ATM ( ataxia-telangiectasia mutated), ATR ( ataxia-telangiectasia-like and Rad-3 homolog) sont 2 kinases activées en présence de coupures de l’ADN. Chk1 et Chk2 sont 2 sérine-thréonine kinases activées par ATM et ATR. p16 : inhibiteur du cycle de la famille INK4 ; p21 : inhibiteur du cycle de la famille Cip/Kip ; Rb : protéine du rétinoblastome (voir [
48]). |
Comment les télomères fonctionnels empêchent l’entrée en sénescence ? Deux protéines affines de l’ADN télomérique, TRF2 et Pot1, orchestrent toute une série d’activités qui vont réprimer la réponse à l’ADN endommagé et inhiber la réparation par recombinaison [
9]. C’est ainsi que des télomères dépourvus de TRF2 sont reconnus comme des cassures de la double hélice entraînant une accumulation de facteurs de réponse au dommage, une activation de la kinase ATM, l’apparition de fusions entre extrémités de chromosomes et une entrée accélérée en sénescence alors qu’un surdosage de TRF2 va retarder la sénescence [
10,
11]. Ces rôles multiples de TRF2 peuvent s’expliquer par des propriétés intrinsèques de la protéine qui modifient la conformation de l’ADN télomérique, par une interaction directe avec ATM qui va inhiber l’activité kinase de cette dernière et par le recrutement de nombreux facteurs impliqués dans la réplication de l’ADN télomérique ainsi que dans l’anti-recombinaison entre télomères, comme Apollon, les hélicases Werner et Bloom, et Rap1 [6]. Pot1, qui se fixe sur la partie simple-brin des télomères, les protège contre l’activation de la kinase ATR probablement en contrôlant la maturation de l’extrémité 3’ sortante [11]. On peut donc imaginer que le raccourcissement des télomères entraîne une perte excessive des protéines TRF2 et Pot1, ce qui permettrait aux kinases ATM et ATR de signaler les télomères comme des cassures double-brin et d’activer la voie p53/p21 (Figure 1). Cependant, la nature précise du ou des complexes télomériques qui protègent les télomères est encore en grande partie méconnue. L’activation de la voie p16/pRb par les télomères dysfonctionnels reste également énigmatique. De manière inattendue, il a été récemment mis en évidence que les télomères sont transcrits, suggérant l’implication d’un ARN dans les mécanismes de protection télomérique [
12]. |
L’érosion télomérique comme mécanisme oncosuppressif Chez l’homme, l’activité de la télomérase est régulée par l’expression de la sous-unité catalytique appelée Tert. Elle est active dans les cellules germinales et embryonnaires, mais elle est exprimée très faiblement dans la plupart des cellules somatiques. Cependant, une plus grande activité télomérase est détectée dans certaines cellules souches adultes, comme les cellules souches hématopoïétiques (CSH) et intestinales [
13,
14]. Cette activité dans les cellules souches est importante pour leur auto-renouvellement, mais n’apparaît pas suffisante pour compenser complètement l’érosion télomérique survenant pendant le vieillissement, au moins pour les CSH [
15,
49] (→). L’expression de la télomérase est augmentée lors de l’activation de cellules immunitaires, mais n’apparaît pas suffisante pour prévenir la sénescence des lymphocytes [
16]. Enfin, une perte de la fonction de la télomérase est la cause de certaines pathologies, tels la dyskératose congénitale [
47] (→), l’aplasie médullaire et la fibrose pulmonaire idiopathique, qui associent une érosion excessive des télomères et des dysfonctionnements sévères de nombreux organes à renouvellement rapide (insuffisance médullaire, troubles gastro-intestinaux, fibrose pulmonaire, dystrophie unguéale, alopécie, hypogonadisme…) [
17,
18]. La réserve d’ADN télomérique apparaît donc limitante pendant l’ontogénie et pourrait contribuer au vieillissement de certains tissus.
(→) m/s 2008, n° 4, p. 340
(→) m/s 2008, n° 4, p. 390
Il peut donc apparaître paradoxal qu’une perte progressive de l’ADN télomérique soit normalement programmée pendant le développement. De ce fait, il a été suggéré qu’une érosion excessive des télomères, déclenchant un arrêt de la prolifération par sénescence ou apoptose, puisse constituer un mécanisme oncosuppressif [
19]. En accord avec cette hypothèse, la télomérase est surexprimée dans la plupart des cancers humains [
20] et elle est nécessaire à la transformation in vitro de cellules humaines normales en cellules tumorigènes [
21]. En effet, l’inactivation des voies oncosuppressives p53/p21 et pRb/p16 supprime l’arrêt prolifératif causé par l’érosion des télomères et augmente le potentiel réplicatif des cellules en culture [
22], mais de telles cultures finissent par succomber à la crise caractérisée par une forte instabilité chromosomique et une perte de nombreux télomères. |
Un modèle souris du dysfonctionnement télomérique Pour étudier les conséquences d’une perte excessive d’ADN télomérique, les laboratoires de C. Greider et de R. DePinho ont créé un modèle de souris invalidées pour le gène codant pour l’ARN de la télomérase (mTR−/−) [
23]. Si l’invalidation de mTR aboutit à une disparition immédiate et complète de l’activité de la télomérase, l’impact sur la taille des télomères n’est que progressif : les souris de première génération ont encore des télomères longs, proches de ceux des parents mTR+/+
tandis qu’au bout de 5 ou 6 générations l’érosion télomérique est si importante que la fonction de nombreux organes est compromise, généralement en association avec une apoptose importante ou un arrêt du cycle cellulaire [
24]. On peut donc conclure, qu’à la différence de l’espèce humaine, la réserve télomérique des souris utilisées dans ces expériences de transgenèse n’est pas limitante pour le développement et le renouvellement des tissus. De ce fait, les souris mTR−/−
de génération tardive, ayant déjà perdu une part importante de leur ADN télomérique et présentant des signes de souffrance tissulaire, apparaissent comme un meilleur modèle du rôle de la dynamique des télomères chez l’homme. Il est d’ailleurs frappant de constater que les dysfonctionnements tissulaires des souris de génération tardive sont très proches de ceux qui sont observés chez les patients atteint de la maladie dyskératose congénitale [17] (→).
(→) voir ce numéro, p. 390
En accord avec un rôle oncosuppressif du dysfonctionnement télomérique chez l’homme, les souris de génération tardive, présentant des télomères courts, sont résistantes à certains processus de cancérisation [
25–
28]. Ces effets oncosuppressifs apparaissent comme étant dépendants de p53. De plus, des souris mTR−/−
héterozygotes pour p53 présentent une augmentation importante du nombre de carcinomes avec l’âge [
29]. |
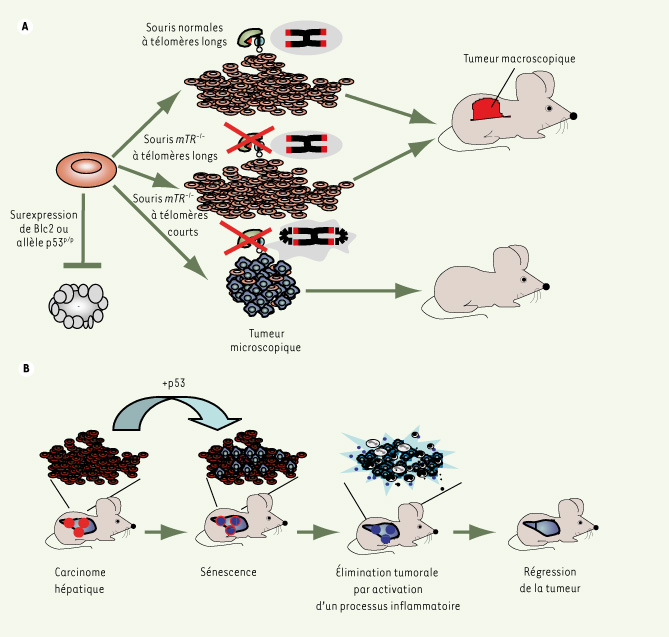
La sénescence induite par un dysfonctionnement télomérique est un mécanisme oncosuppressif chez la souris Pour étudier le mécanisme par lequel les télomères courts empêchent le développement tumoral chez la souris, D. Feldser et C. Greider ont combiné l’invalidation de la télomérase avec un modèle de lymphomagenèse B par expression du transgène Eµ-myc1 [4] (Figure 2A). Ce modèle avait été utilisé précédemment pour montrer que l’inhibition de l’apoptose sensibilisait les lymphomes à la chimiothérapie par un mécanisme de sénescence dépendant de p53 et p16(INK4a) [
30]. Si les souris Eµ-myc mTR−/−
à télomères longs développent autant de tumeurs que les parentales Eµ-myc mTR+/+
, les souris Eµ-myc mTR−/−
à télomères courts deviennent en partie résistantes à la formation de lymphomes B. Ces résultats montrent que ce n’est pas l’absence de télomérase mais bien l’apparition de télomères courts qui protège les souris de la formation de lymphomes. L’effet oncosuppressif du dysfonctionnement télomérique n’est plus détectable lorsque p53 est compromis et les rares tumeurs qui sont formées à partir des cellules à télomères courts semblent avoir sélectionné la perte fonctionnelle de p53.
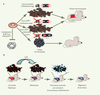 | Figure 2.
La sénescence est oncosuppressive chez la souris. A. Des cellules cancéreuses de souris dans lesquelles l’apoptose est inhibée (soit par la surexpression de Bcl2 soit par l’expression d’un allèle « séparation » de fonction de p53) perdent leur propriété tumorigène lorsqu’elle subissent une érosion excessive de leurs télomères [ 4, 5]. En fait, des microtumeurs de cellules sénescentes sont formées, mais elles ne progressent pas vers des tumeurs macroscopiques. B. Dans un modèle d’hépatocarcinome murin, la restauration de p53 entraîne la régression tumorale en déclenchant une sénescence massive [
32]. L’élimination des cellules sénescentes dépend de l’activation d’un processus inflammatoire déclenché par un programme sécrétoire des cellules sénescentes. |
Il semble donc que l’apparition de télomères courts limite la lymphomagenèse dans des cellules à télomères courts, mais comment ? Pour étudier le rôle de l’apoptose, des CSH surexprimant le gène anti-apoptotique Bcl2 ont été transplantées dans des animaux syngéniques irradiés. Comme attendu, le pourcentage de cellules apoptotiques dans les tumeurs surexprimant Bcl2 est bas. Les souris reconstituées avec des cellules mTR−/−
à télomères longs et surexprimant Bcl2, développent des lymphomes très agressifs. En revanche, les animaux transplantés avec des cellules mTR−/−
surexprimant Bcl2 mais possédant des télomères courts, ne développent pas de tumeur palpable. L’apoptose ne paraît donc pas être la cause de l’effet oncosuppressif du dysfonctionnement télomérique dans ce modèle. En fait, des microlymphomes sont formés à partir des cellules à télomères courts surexprimant Bcl2, mais ils n’aboutissent pas à la formation de tumeurs macroscopiques (Figure 2A). Ces microtumeurs sont composées de nombreuses cellules sénescentes, exprimant la β-galactosidase associée à la sénescence (ou SA-β-galactosidase) et le gène suppresseur de tumeur p16. Ces résultats indiquent que des télomères courts peuvent déclencher une sénescence dépendante de p53 qui limite la progression tumorale in vivo (Figure 3).
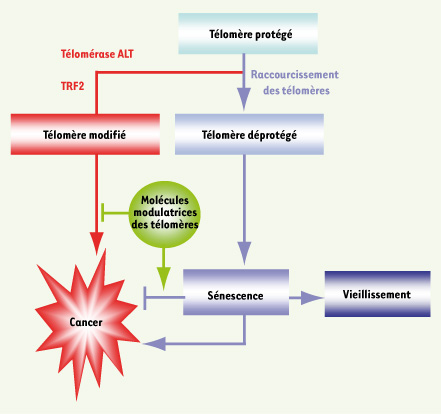
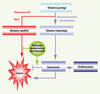 | Figure 3.
Modèle du rôle des télomères dans le cancer et de la modulation pharmacologique de la sénescence. La voie en bleue résume les principales conséquences, parfois antagonistes, de la sénescence induite par l’érosion télomérique : effet oncosuppressif, effet paracrine favorisant la carcinogenèse et contribution au vieillissement de certains tissus. La voie en rouge représente les modifications télomériques qui accompagnent la formation des cancers et qui ont pour effet de renforcer les fonctions télomériques, soit en augmentant la taille de l’ADN télomérique (télomérase ou ALT), soit en surexprimant certaines protéines télomériques qui retardent la sénescence (par exemple TRF2). La voie en vert propose une stratégie thérapeutique de modulation pharmacologique des fonctions télomériques qui pourrait agir à deux niveaux : en bloquant les mécanismes de renforcement des fonctions télomériques qui sont mis en place lors de la cancérisation et en déclenchant une « sénescence sélective » qui ne correspondrait qu’au programme oncosuppressif. La possibilité de séparer les effets pro-carcinogènes, accélérateurs du vieillissement et oncosuppressifs de la sénescence reste à démontrer, mais représente certainement un enjeu majeur pour développer de nouvelles thérapies plus efficaces et mieux tolérées par le patient. |
Dans une série de travaux indépendants, W. Cosme-Blanco et al. ont combiné l’invalidation de la télomérase avec un allèle dit « séparation » de fonction de p53 (p53p), qui empêche p53 d’induire l’apoptose mais maintient sa compétence dans le déclenchement de la sénescence [5]. La présence de télomères courts chez des souris p53p/p
mTR−/−
est associée à une forte suppression de la formation des tumeurs spontanées, avec une claire accumulation de cellules sénescentes dans différents compartiments cellulaires (intestin, poumon, rein, foie, etc.). Ces résultats indiquent que, comme dans le modèle de lymphomagenèse, des télomères dysfonctionnels peuvent être oncosuppressifs en induisant la sénescence (Figure 2A). |
Ces deux études démontrent que l’apoptose n’est pas nécessaire pour s’opposer à un processus tumoral lorsqu’existe un raccourcissement des télomères. En fait, une autre barrière de prolifération, la sénescence dépendante de la voie p53, est associée à un mécanisme alternatif d’oncosuppression. Il est encore difficile de savoir si ce processus est généralisable à un grand nombre de tumeurs ou de types d’organes. Par exemple, la sénescence n’est pas la cause de la résistance des souris mTR−/−
à la formation de cancers de la peau induite par l’application de carcinogènes [5]. Il faut souligner que la barrière de prolifération que constitue la sénescence ne permet pas d’expliquer la disparition des cellules tumorales car ce processus cellulaire est par définition cytostatique. Des mécanismes différents de l’arrêt du cycle pourraient donc jouer un rôle. Dans cette perspective, des études récentes ont établi des liens inattendus entre sénescence et modifications extracellulaires. Par exemple, un dysfonctionnement télomérique chez la souris induit une réponse sécrétoire qui modifie la fonction des cellules souches hématopoïétiques [
31] et la sénescence déclenchée par la réexpression de p53 dans un modèle d’hépatocarcinome murin est accompagnée par une stimulation du système immunitaire inné qui conduit à l’élimination des cellules tumorales [32] (Figure 2B). De manière intéressante, il semble que la réponse au dommage à l’ADN ne conduit pas uniquement à un arrêt du cycle et à un renforcement des fonctions de réparation, mais aussi à la stimulation du système immunitaire inné [
33]. L’ensemble de ces études suggère que l’oncosuppression liée à la sénescence peut résulter, au moins en partie, de l’activation de processus extracellulaires. Ces mécanismes sécrétoires ont toutes les chances d’être conservés dans l’espèce humaine car des fibroblastes et des kératinocytes humains en sénescence réplicative sécrètent des molécules respectivement pro-inflammatoires et antiangiogéniques [
34,
35]. |
Potentiel thérapeutique de la sénescence induite par ciblage des télomères Les résultats obtenus chez la souris montrent que la sénescence induite par des télomères courts est une barrière efficace contre le développement tumoral, confortant l’idée que la sénescence peut supprimer le développement tumoral au même titre que la mort cellulaire. D’autre part, et de manière inattendue, la sénescence n’apparaît pas uniquement comme une barrière cytostatique pour la prolifération tumorale, mais comme un phénomène paracrine d’élimination de cellules cancéreuses [32]. Cette notion est particulièrement importante en clinique car les chimiothérapies et radiothérapies standard fonctionnent déjà en partie par l’induction de la sénescence dans la masse tumorale [
36]. Un déclenchement encore plus important de la sénescence pourrait donc être une stratégie anti-cancéreuse particulièrement efficace. Cependant, la sénescence fibroblastique est également associée à des effets paracrines favorisant la carcinogenèse in vitro et in vivo [
37]. Il faut donc garder à l’esprit que la sénescence peut avoir des effets antagonistes vis-à-vis de la cancérogenèse selon les contextes cellulaires et les conditions physiologiques (Figure 3). De manière idéale, on peut imaginer des stratégies pharmacologiques qui activeraient sélectivement les programmes anti-cancéreux de la sénescence. De tels traitements devraient diminuer le risque pour les tissus sains exposés d’entrer en sénescence, de vieillir précocement et d’induire des cancers secondaires. Dans cette perspective, le fait que, chez la souris, le ciblage de p21 ralentisse le vieillissement sans augmenter la formation de cancers [24] montre qu’il est possible d’engager sélectivement certains des programmes cellulaires liés à la sénescence. Il devient donc particulièrement attractif de développer de nouvelles molécules qui cibleraient les télomères pour induire sélectivement les programmes oncosuppressifs de la sénescence (Figure 3). Il est donc nécessaire de mieux connaître l’organisation fonctionnelle des télomères et les voies de signalisation modulées par un dysfonctionnement télomérique. La télomérase et les protéines télomériques qui sont surexprimées lors de la transformation maligne sont des cibles intéressantes [20,
38–
40]. Il faut noter que des résultats encourageants ont été obtenus avec des molécules qui stabilisent une conformation particulière de l’ADN télomérique (les structures quadruplexes de G ou G4) [
41]. En particulier, ces molécules inhibent la croissance de xénogreffes, modifient la composition protéique des télomères, induisent aussi un raccourcissement des télomères (double brin ou extrémité simple brin) et montrent une toxicité plus élevée pour les cellules tumorales que pour les cellules saines [
42,
43]. Ces stratégies sont-elles limitées au traitement de tumeurs préservant une voie p53 intacte ? Il faut noter que dans certains cas la sénescence peut être provoquée en l’absence de p53 [
44,
45]. De plus, les conséquences d’un dysfonctionnement télomérique en l’absence de p53 sont encore mal connues. Il est notamment intéressant qu’en l’absence de p53, la télomérase limite l’activation de voies supprimant la carcinogenèse hépatique [
46]. |
Les travaux effectués dans le laboratoire d’EG sont principalement soutenus par la Ligue Nationale contre le Cancer (équipe labellisée) et l’Institut National contre le Cancer (INCa) et ceux menés par celui d’ALV par l’Association pour la recherche contre le cancer (ARC) et l’INCa.
|
1. Gire V. La sénescence : une barrière télomérique à l’immortalité ou une réponse cellulaire aux stress physiologiques ? Med Sci (Paris) 2005; 21 : 491–7. 2. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100 : 57–70. 3. Sharpless NE, DePinho RA. Cancer: crime and punishment. Nature 2005; 436 : 636–7. 4. Feldser DM, Greider CW. Short telomeres limit tumor progression in vivo by inducing senescence. Cancer Cell 2007; 11 : 461–9. 5. Cosme-Blanco W, Shen MF, Lazar AJ, et al. Telomere dysfunction suppresses spontaneous tumorigenesis in vivo by initiating p53-dependent cellular senescence. EMBO Rep 2007; 8 : 497–503. 6. Gilson E, Geli V. How telomeres are replicated. Nat Rev Mol Cell Biol 2007; 8 : 825–38. 7. Nittis T, Guittat L, Stewart SA. Alternative lengthening of telomeres (ALT) and chromatin: is there a connection ? Biochimie 2008; 90 : 5–12. 8. D’Adda di Fagagna F, Reaper PM, Clay-Farrace L, et al. A DNA damage checkpoint response in telomere-initiated senescence. Nature 2003; 426 : 194–8. 9. De Lange T. Shelterin: the protein complex that shapes and safeguards human telomeres. Genes Dev 2005; 19 : 2100–10. 10. Karlseder J, Smogorzewska A, de Lange T. Senescence induced by altered telomere state, not telomere loss. Science 2002; 295 : 2446–9. 11. Denchi EL, de Lange T. Protection of telomeres through independent control of ATM and ATR by TRF2 and POT1. Nature 2007; 448 : 1068–71. 12. Azzalin CM, Reichenback P, Khoriauli L, et al. Telomeric repeat containing RNA and RNA surveillance factors at mammalian chromosome ends. Science 2007; 318 : 798–801. 13. Broccoli D, Young JW, de Lange T. Telomerase activity in normal and maligant hematopoietic cells. Proc Natl Acad Sci USA 1995; 92 : 9082–6. 14. Yasui W, Tahara E, Tahara H, et al. Immunohistochemical detection of human telomerase reverse transcriptase in normal mucosa and precancerous lesions of the stomach. Jpn J Cancer Res 1999; 90 : 589–95. 15. Morrison SJ, Prowse KR, Ho P, Weissman IL. Telomerase activity in hematopoietic cells is associated with self-renewal potential. Immunity 1996; 5 : 207–16. 16. Rufer N, Nabholz M. Télomérase, élixir de jouvence des cellules humaines ? Med Sci (Paris) 2003; 19 : 345–50. 17. Vulliamy TJ, Dokal I. Dyskeratosis congenita: the diverse clinical presentation of mutations in the telomerase complex. Biochimie 2008; 90 : 122–30. 18. Gilson E, Londono-Vallejo A. Telomere length profiles in humans: all ends are not equal. Cell Cycle 2007; 6 : 2486–94. 19. Brunori M, Gilson E. Télomère et cancer : quoi de plus à la fin ? Med Sci (Paris) 2005; 21 : 37–42. 20. Kim NW, Piatyszek MA, Prowse KR, et al. Specific associations of human telomerase activity with immortal cells and cancer. Science 1994; 266 : 2011–4. 21. Hahn WC, Counter CM, Lundberg AS, et al. Creation of human tumour cells with defined genetic elements. Nature 1999; 400 : 464–8. 22. Counter CM, Avilion AA, Le Feuvre CE, et al. Telomere shortening associated with chromosome instability is arrested in immortal cells wich express telomerase activity. EMBO J 1992; 11 : 1921–9. 23. Blasco MA, Lee HW, Hande MP, et al. Telomere shortening and tumor formation by mouse cells lacking telomerase RNA. Cell 1997; 91 : 25–34. 24. Choudhury AR, Ju Z, Djojosubroto MW, et al. Cdkn1a deletion improves stem cell function and lifespan of mice with dysfunctional telomeres without accelerating cancer formation. Nat Genet 2007; 39 : 99–105. 25. Greenberg RA, Chin L, Femino A, et al. Short dysfunctional telomeres impair tumorigenesis in the INK4a(delta2/3) cancer-prone mouse. Cell 1999; 97 : 515–25. 26. Gonzalez-Suarez E, Samper E, Flores JM, Blasco MA. Telomerase-deficient mice with short telomeres are resistant to skin tumorigenesis. Nat Genet 2000; 26 : 114–7. 27. Rudolph KL, Millard M, Bosenberg MW, DePinho RA. Telomere dysfunction and evolution of intestinal carcinoma in mice and humans. Nat Genet 2001; 28 : 155–9. 28. Qi L, Strong MA, Karim BO, et al. Telomere fusion to chromosome breaks reduces oncogenic translocations and tumour formation. Nat Cell Biol 2005; 7 : 706–11. 29. Artandi SE, Chang S, Lee SL, et al. Telomere dysfunction promotes non-reciprocal translocations and epithelial cancers in mice. Nature 2000; 406 : 641–5. 30. Schmitt CA, Fridman JS, Yang M, et al. A senescence program controlled by p53 and p16INK4a contributes to the outcome of cancer therapy. Cell 2002; 109 : 335–46. 31. Ju Z, Jiang H, Jaworski M, et al. Telomere dysfunction induces environmental alterations limiting hematopoietic stem cell function and engraftment. Nat Med 2007; 13 : 742–7. 32. Xue W, Zender L, Miething C, et al. Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas. Nature 2007; 445 : 656–60. 33. Gasser S, Orsulic S, Brown EJ, Raulet DH. The DNA damage pathway regulates innate immune system ligands of the NKG2D receptor. Nature 2005; 436 : 1186–90. 34. Shelton DN, Chang E, Whittier PS, et al. Microarray analysis of replicative senescence. Curr Biol 1999; 9 : 939–45. 35. Nickoloff BJ, Lingen MW, Chang BD, et al. Tumor suppressor maspin is up-regulated during keratinocyte senescence, exerting a paracrine antiangiogenic activity. Cancer Res 2004; 64 : 2956–61. 36. Roninson IB. Tumor cell senescence in cancer treatment. Cancer Res 2003; 63 : 2705–15. 37. Krtolica A, Parrinello S, Lockett S, et al. Senescent fibroblasts promote epithelial cell growth and tumorigenesis: a link between cancer and aging. Proc Natl Acad Sci USA 2001; 98 : 12072–7. 38. Biroccio A, Rizzo A, Elli R, et al. TRF2 inhibition triggers apoptosis and reduces tumourigenicity of human melanoma cells. Eur J Cancer 2006; 42 : 1881–8. 39. Nakanishi K, Kawai T, Kumaki F, et al. Expression of mRNAs for telomeric repeat binding factor (TRF)-1 and TRF2 in atypical adenomatous hyperplasia and adenocarcinoma of the lung. Clin Cancer Res 2003; 9 : 1105–11. 40. Munoz P, Blanco R, Flores JM, Blasco MA. XPF nuclease-dependent telomere loss and increased DNA damage in mice overexpressing TRF2 result in premature aging and cancer. Nat Genet 2005; 37 : 1063–71. 41. De Cian A, Lacroix L, Douarre C, et al. Targeting telomeres and telomerase. Biochimie 2008; 90 : 131–55. 42. Gomez D, O’Donohue MF, Wenner T, et al. The G-quadruplex ligand telomestatin inhibits POT1 binding to telomeric sequences in vitro and induces GFP-POT1 dissociation from telomeres in human cells. Cancer Res 2006; 66 : 6908–12. 43. Salvati E, Leonetti C, Rizzo A, et al. Telomere damage induced by the G-quadruplex ligand RHPS4 has an antitumor effect. J Clin Invest 2007; 117 : 3236–47. 44. Jacobs JJ, de Lange T. Significant role for p16INK4a in p53-independent telomere-directed senescence. Curr Biol 2004; 14 : 2302–8. 45. Ha L, Ichikawa T, Anver M, et al. ARF functions as a melanoma tumor suppressor by inducing p53-independent senescence. Proc Natl Acad Sci USA 2007; 104 : 10968–73. 46. Lechel A, Holstege H, Begus Y, et al. Telomerase deletion limits progression of p53-mutant hepatocellular carcinoma with short telomeres in chronic liver disease. Gastroenterology 2007; 132 : 1465–75. 47. Hoareau-Aveilla C, Henry Y, Leblanc T. La dyskératose congénitale, une maladie méconnue due à un maintien défectueux des télomères. Med Sci (Paris) 2008; 24 : 390–8. 48. Pommier Y, Kohn KW. Cycle cellulaire et points de contrôle : nouvelles cibles thérapeutiques. Med Sci (Paris) 2003; 19 : 173–86. 49. Coulombel L. Traquer les télomères des cellules souches dans leur niche. Med Sci (Paris) 2008; 24 : 340. |