-
Roger Pedersen (Cambridge, Royaume-Uni) discutait l’origine effective des cellules ESh. En effet, alors que ESm (cellules ES murines) et ESh sont toutes deux dérivées de la masse interne du blastocyste (ICM), elles diffèrent par leur réponse aux signaux biochimiques (LIF, BMP chez la souris ; IGF, bFGF, Nodal et Activine chez l’homme), la morphologie des colonies et la technique de dissociation des colonies (enzymatique chez la souris, mécanique chez l’homme pour limiter l’émergence d’anomalies chromosomiques). Le labo de R. Pedersen a récemment suggéré la similitude des ESh avec les cellules ESm issues de l’épiblaste tardif (un des deux feuillets individualisés de la masse interne) chez la souris [
1]. De façon intéressante, les cellules de l’ICM et les cellules de l’épiblaste répondent différemment aux signaux cytokiniques : l’ICM de souris cultivée dans des conditions humaines (Activine et bFGF) ne donne naissance à aucune lignée ES et se différencie ; au contraire, l’épiblaste tardif requiert l’Activine et le bFGF pour engendrer des lignées pluripotentes, et se différencie en présence de LIF et BMP. Pour R. Pedersen, il est illusoire de penser qu’en sélectionnant des embryons humains plus précoces, on obtiendrait des lignées ayant les propriétés des cellules ES « murines ». Pour lui, les cellules ESm représentent probablement une exception, idée corroborée par la difficulté d’obtention d’autres cellules ES de mammifères.
Un des projets de l’équipe de Pedersen, issu des observations ci-dessus, est de comprendre comment des molécules de la famille du TGF-β (BMP4, Activine), qui induisent l’activation de la même cascade de signalisation intracellulaire, celle des Smad, sont impliquées à la fois dans la différenciation vers l’endoderme et le maintien de la pluripotence, deux destins antinomiques. Il démontre que cette dichotomie est contrôlée en aval des Smad2/3. L’équipe a mis en évidence que le facteur de transcription FOXh1 régule la transcription des gènes Lefty, Nodal, mais ni Nanog ni Oct4, contrairement aux Smad, dont l’inhibition abolit l’expression des 4 gènes mentionnés, confirmant la divergence tardive des voies gouvernant la pluripotence et la différenciation.
- Niall Dillon (Londres, Royaume-Uni) s’attaquait à la dissection des déterminants de l’état pluripotent : combinaison de facteurs de transcription (FT), de marques épigénétiques, et d’organisation chromatinienne permettant d’activer et réprimer de multiples gènes. Combinaison et non pas marques uniques de cellules ES, comme on pouvait le croire initialement. Pour lui, le succès de la reprogrammation de fibroblastes murins et humains en cellules souches pluripotentes induites (iPS) avec les « 4 facteurs de Yamanaka » [ 2, 3] prouve que les fondements de la pluripotence sont les mêmes chez la souris et l’homme. On a souvent dit que les cellules ES était « dans les starting blocks » les locus étant pré-activés, mais pas encore transcrits. Dans ce cadre, N. Dillon rappelle que les marques bivalentes (présence simultanée sur l’histone H3 d’une méthylation de la lysine 4, marque activatrice, et de la lysine 27, marque répressive) contribuent à la pluripotence, mais ne sont pas spécifiques des cellules ES ; il décrit ensuite la cinétique de l’activation génique et propose l’intervention d’un ETCM, ou enhancer transcription competence mark : l’ETCM fait intervenir la fixation d’un facteur de transcription (FT) non pas sur le promoteur, mais sur un enhancer ; ce recrutement, et celui d’autres protéines, prépare le locus, mais il n’y a pas encore transcription [ 4]. L’exemple pris était celui des deux gènes λ5 et VpreB, co-activés lors du développement B précoce, et produisant des composants du complexe pré-BCR. Un enhancer intergénique fixe les FT et l’ARN polymérase II avant l’initiation de la transcription, créant ce que Dillon appelle ETCM. Dans les cellules ES, Sox2 et FoxD3 sont liés à cet enhancer dont l’histone H3 est méthylée en K4, une marque d’activation. Lors de la différenciation pro-B, il y a un relais de Sox2 à d’autres FT comme Sox4 et FoxP1 et un transfert (ou une extension) de ces facteurs sur le promoteur, dont résulte la transcription du gène. Ces ETCM seraient ainsi les principaux modulateurs de l’activation génique, permettant l’adaptation temporelle de la transcription.
- L’exposé de Michel Pucéat (Évry, France) s’avérait complémentaire et présentait des résultats non publiés sur le mécanisme moléculaire de l’engagement de cellules ESh dans la voie cardiogénique. La molécule BMP2 est suffisamment puissante pour induire à elle seule l’engagement mésodermique des cellules ES, ce qui est encore facilité par l’ajout d’un inhibiteur du FGF [ 5]. Or, M. Pucéat a découvert que BMP2 rompt l’équilibre d’un complexe moléculaire incluant Oct4 (l’isoforme Oct4iA du facteur Oct4, tandis que l’isoforme iB restant invariante). Dans les cellules ESh indifférenciées, Sox2 est liée à Oct4 ; BMP2 déplace cette liaison, Sox17 remplaçant Sox2, ce qui engagerait la différenciation cardiogénique. Dans le modèle proposé par M. Pucéat, une colonie de cellules ESh organiserait sa propre « niche » en domaines : au centre de la colonie les cellules pluripotentes, et en périphérie, en réponse à la sécrétion locale de BMP2, Sox17 déplacerait Sox2 sur Oct4, induisant la voie cardiogénique (Figure 1).
- Un autre exemple de modélisation a été donné par Peter Andrews (Sheffield, Royaume-Uni), dans le cadre de sa présentation du programme Européen EStools. Il utilise les cellules ES comme modèle de compréhension du processus d’instabilité génétique et de développement tumoral via une approche génétique, mais aussi une modélisation mathématique : en culture, les cellules ESh peuvent évoluer vers un phénotype tumoral, en particulier par l’acquisition d’anomalies des chromosomes 12, 17 et X, des cellules porteuses de ces anomalies prenant plus ou moins rapidement le dessus. Peut-être les mécanismes présidant à cette dominance sont-ils proches de ceux qui contrôlent la progression tumorale.
- Chad Cowan (New York, États-Unis) rappelait ensuite la variabilité entre lignées de cellules ESh (45 ESh dérivées à Harvard) [ 6], que ce soit dans leur potentiel ou leur profil transcriptionnel (avec parfois des variations d’expression de transcrits atteignant un facteur > 103), écueil dans le cadre d’une thérapie « autologue » où il serait nécessaire d’évaluer plusieurs lignées pour chaque patient. Il explore cette variabilité par l’analyse des SNP à large échelle dans 28 lignées, mais doute que le problème soit uniquement génétique, et envisage également une analyse épigénétique à large échelle (CHIP on ChIP, et CHIP/séquence).
- Michal Amit (Technion, Israël) rappelait que ce n’est qu’en 2001 que fut remplacé le sérum et les cellules nourricières (feeders) murines dans les cultures de cellules ESh, et en 2007 que l’on a pu éliminer les protéines animales et les feeders, remplacés par des protéines matricielles [ 7]. Elle montrait de très spectaculaires résultats d’adaptation de la culture des cellules ESh indifférenciées en suspension. Les ESh s’agrègent en sphères qui sont désagrégées par pipetage une fois par semaine pour éviter l’apparition de sphères de taille trop importante au cœur desquelles on observe une forte apoptose. L’activation de la voie de signalisation gp130, via l’ajout au milieu de culture de l’IL-6 et de son récepteur soluble IL-6R, semble être un paramètre important. Quatre lignées différentes ont ainsi été cultivées de manière prolongée depuis un an sans altération du caryotype ni de la pluripotence des cellules ES. Cette nouvelle méthode de culture des ESh est une étape importante vers l’utilisation de bioréacteurs pour l’amplification à large échelle de ces cellules.
- N. Nakatsuji (Kyoto, Japon), directeur du seul groupe à avoir dérivé des cellules ESh au Japon depuis 2003 (3 lignées), rappelait les contraintes imposées par son gouvernement à l’exportation des lignées japonaises. Il plaidait pour l’établissement d’une banque de cellules ESh et iPS dont le typage HLA serait défini, et soulignait que 100 lignées ESh obtenues d’ovocytes parthénogénétiques (une alternative aux lignées obtenues par transfert nucléaire) pourraient suffire pour refléter la diversité immunologique (compatibilité complète ou partielle) des patients japonais [ 8].
- Stuart Orkin (Boston, États-Unis) soulignait l’intérêt potentiel des cellules ESh pour modéliser certaines maladies humaines pour lesquelles il n’existe pas de modèles animaux. C’est le cas par exemple des leucémies mégacaryocytaires de type M7 qui se développent chez les enfants trisomiques 21. Ces leucémies sont associées à une mutation du gène gata-1, à l’origine d’une protéine tronquée GATA1ΔN [ 9]. L’exemple est unique en ce qu’il associe une mutation somatique, en elle-même peut-être silencieuse (anomalies mégacaryocytaires discrètes au stade fœtal), mais qui, dans le contexte de l’avantage prolifératif peut-être conféré par la trisomie 21, provoque une leucémie. Or cette synergie n’est pas reproduite en croisant des souris transgéniques GATA1ΔN et des souris reproduisant partiellement le syndrome de Down, Ts65Dn ou TC1 (ayant incorporé une séquence du chromosome 21 humain). L’équipe a donc établi plusieurs lignées de cellules ESh à partir d’embryons dont la biopsie avait révélé une trisomie 21, et explore leur différenciation hématopoïétique, et envisage de transduire la forme GATA1ΔN. Comme le chromosome 21 contient 220 gènes dont 100 sont exprimés dans les cellules hématopoïétiques, un criblage biologique à la recherche des gènes impliqués dans la prolifération mégacaryocytaire anormale est envisagé.
- Dans cette même optique de modélisation de maladies humaines, Chad Cowan (Boston, États-Unis) présentait son projet sur la maladie de Parkinson. Rappelant qu’aucun modèle animal ne reproduit la maladie avec les mutations des gènes impliqués dans le Parkinson humain (six gènes impliqués dans les formes familiales), il développe une stratégie consistant à surexprimer l’α-synucléine (produit d’un des six gènes impliqués) sous forme inductible (pTRE2-Myc-α synucléine) dans des cellules ESh. De fait, ses résultats préliminaires montrent la formation d’agrégats d’a-synucléine et la présence de corps de Lewy dans les neurones dopaminergiques issus de la différenciation de ces cellules ES, ce qui entraîne leur mort, modèle qui sera utilisé pour le criblage pharmacologique. Mais les agrégats semblent aussi être présents dans les cellules ES indifférenciées.
- Eric Bouhassira (New York, États-Unis), Igor Slukvin (Madison, États-Unis) et Georges Daley (Boston, États-Unis) décrivaient leur expérience d’induction de la différenciation hématopoïétique des cellules ESh : tous trois se heurtent à une difficulté récurrente, celle d’induire une hématopoïèse « définitive », caractérisée par une population de cellules souches hématopoïétiques multipotentes, et la production d’érythrocytes énucléés exprimant une hémoglobine de type adulte.
- Igor Slukvin essaie de définir des sous-populations de progéniteurs hématopoïétiques de potentiel varié, en analysant la cinétique d’apparition de trois marqueurs classiques de l’hématopoïèse fœtale et adulte, CD34, CD43 et CD31, lors de l’induction de hématopoïèse dans des cellules ESh cultivées sur la lignée stromale OP9 [ 10].
- Eric Bouhassira utilise un protocole complexe, fondé sur l’induction séquentielle du mésoderme, puis de l’hématopoïèse, enfin de l’érythropoïèse à partir de cellules triées sur l’expression de CD34+. À chaque étape correspond une combinaison spécifique de facteurs inducteurs (activine A, Wnt 3, puis BMP4, puis IL3, VEGF, IHH, puis jagged), mais aussi la culture sur des feeders de foie fœtal.
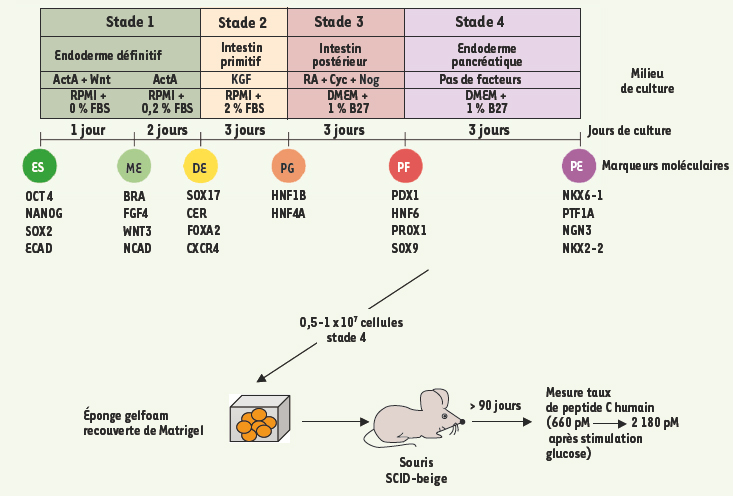
L’importance de ces morphogènes, et d’autres facteurs inducteurs comme HoxB4 ou Cdx4/1, est aussi soulignée par G. Daley [ 11], et A.J. Lewis (Novocell, San Diego, États-Unis) rapportera également, dans le cas de la différenciation pancréatique, l’importance de mimer les interactions inductives des étapes embryonnaires normales. Les résultats actuels n’aboutissent qu’à la production de globules rouges porteurs d’hémoglobines embryonnaires Gower I puis Gower II, ou d’hémoglobine fœtale, mais aucune hémoglobine adulte (globine b) n’est induite [ 12]. Eric Bouhassira émet l’hypothèse selon laquelle les transitions de l’hémoglobine seraient en partie sous le contrôle d’ARN non codants dits « hétérochroniques » (lin-4, let-7) similaires à ceux qui régulent chez C. elegans la transition des stades larvaires à adulte, et que peut-être la manipulation de ces facteurs pourrait permettre de franchir in vitro ces transitions à partir des cellules ESh [ 13] (Figure 2).
- Oliver Brüstle (Bonn, Allemagne), montrait que les cellules pouvaient répondre aux molécules contrôlant l’établissement de la régionalisation des neurones chez l’embryon : acide rétinoïque pour une spécialisation postérieure, Shh/FgF8 pour une induction de type tronc cérébral ventral (ventral midbrain). L’analyse fonctionnelle est malaisée : si les cellules ES murines s’intègrent bien dans les tranches de tissu hippocampique cultivées in vitro, ce n’est pas le cas des cellules ESh, la culture dégénérant avant que les cellules aient pu s’intégrer ; les cellules peuvent aussi être injectées dans le cerveau de souris SCID nouveau-nés, où elles migrent dans de nombreuses régions et forment des synapses, toutefois la persistance de connexions à long-terme reste à démontrer. S’assurer de l’absence de contamination par des cellules indifférenciées résiduelles est un prérequis pour une utilisation thérapeutique. O. Brüstle procède par tri des précurseurs neuronaux, en utilisant comme gène rapporteur l’expression de la doublecortine. Les précurseurs ainsi triés peuvent être congelés en vue d’une utilisation ultérieure, et le transgène peut être éliminé car le gène rapporteur est inséré dans une construction « loxée » excisable par l’expression transitoire de l’enzyme cre (via un peptide perméant). Suggestion d’utilisation par exemple pour une supplémentation locale en adénosine dans l’épilepsie ?
- Mark Mercola (La Jolla, CA, États-Unis) a montré l’utilisation du criblage à haute densité pour tester des chimiothèques sur les cellules ESh à la recherche de candidats-médicaments (druggables) [ 14]. Il a illustré cette stratégie avec le couplage du criblage à haute densité et de l’imagerie cellulaire utilisé depuis 4 ans au Burhnam Institute (La Jolla).
-
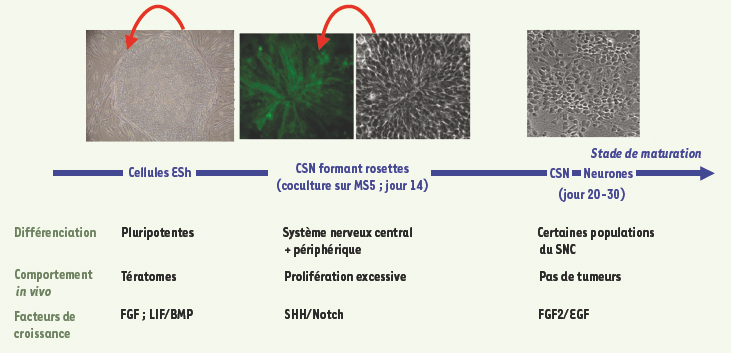
Lorenz Studer (New York, États-Unis) s’intéresse à la dissection, à partir de cellules ESh, de la hiérarchie d’acquisition de l’identité des différentes populations du système nerveux. Les cellules souches neurales (NSC) isolées jusqu’à présent de ESh ou de tissu primaire ont un potentiel relativement limité, et L. Studer décrit l’identification d’une nouvellle population appelée R-NSC, pour rosette-neural stem cells, qui peut être isolée de façon prospective (via l’expression de l’antigène de surface reconnu par l’anticorps Forse-1) quelques jours après l’induction de la différenciation de ESh [
15]. Dans la hiérarchie, ces R-NSC sont en amont des cellules souches neurales (NSC) ou des progéniteurs de la crête neurale (que cette équipe a précédemment isolés indépendamment), sur les critères suivants : capacité d’autorenouvellement importante - en présence de ligands de Notch et de Shh -, potentiel extrêmement large, puisque ces R-NSC donnent naissance, en présence d’inducteurs appropriés, aux populations de neurones des deux systèmes nerveux, central mais aussi périphérique (Figure 3). Reste à déterminer dans cette hiérarchie, quels progéniteurs seront les plus utiles - et les moins nocifs (les R-NSC ont un potentiel tumoral) - en transplantation.
Figure 3. Hiérarchie d’établissement des progéniteurs neuraux à partir des cellules ESh. CSN : cellules souches neurales ; SHH : sonic hedgehog ; FGF : fibroblast growth factor ; EGF : epidermal growth factor ; LIF : leukemia inhibiting factor ; BMP : bone morphogenetic protein. Flèche rouge : autorenouvellement (cette figure est adaptée d’après [15]). - Marisa Jaconi (Genève, Suisse) rappelait en introduction ses essais de dérivation de lignées à partir de blastomères de 78 embryons arrêtés ; une seule lignée obtenue, polyploïde, et fonctionnellement très éloignée d’une lignée ES. L’exposé était surtout consacré à l’amélioration des conditions de transplantation et de survie des cellules puisque environ 90 % des cellules greffées sont perdues par apoptose, un problème déjà connu pour les cellules souches adultes. Plusieurs possibilités ont été testées pour y remédier : feuillets cellulaires, fils de collagène, ou matrices 3D à base de fibrine. Ces dernières offrent plusieurs avantages, biodégradabilité, neutralité immunologique, possibilité de coupler la fibrine de ces matrices à des facteurs comme le VEGF, facilitant l’établissement de structures vasculaires dérivées de l’hôte.
- Georges Daley décrivait sa stratégie de dérivation des iPS [ 16], en mentionnant que dans son expérience, l’efficacité de reprogrammation diminuait avec l’âge des cellules somatiques utilisées. Une des questions posées dans toutes ces expériences de reprogrammation est celle du rôle putatif d’un hot-spot d’intégration virale dans la reprogrammation. Mais le séquençage des sites d’intégration ne semble pas démasquer de sites d’intégration communs [ 17], excluant que la reprogrammation soit due à l’activation d’un gène endogène par l’intégration virale.
- Eric Bouhassira dérive ses cellules iPS à partir de cellules souches mésenchymateuses, et a obtenu 16 colonies représentant 3 clones distincts. Pour lui, une des difficultés est celle de l’évaluation de la pluripotence des iPS, puisqu’on ne dispose pas, comme chez la souris, de la possibilité de créer des chimères après injection dans un blastocyste ensuite réimplanté.