La vitamine C existe sous trois formes selon le degré d’oxydoréduction : la forme réduite ou acide ascorbique, la forme semi-réduite mono-oxydée ou acide monodéhydroascorbique, et la forme oxydée ou acide déshydroascorbique (DHA). Chaque étape d’oxydation est réversible et permet de redonner de l’acide ascorbique. Celui-ci est transporté à travers les membranes cellulaires par les co-transporteurs spécialisés sodium-ascorbate SVCT1 et SVCT2, alors que le DHA, forme oxydée, entre dans les cellules par l’intermédiaire de GLUT1, GLUT3 ou GLUT4, transporteurs du glucose de la superfamille des GLUT qui comprend 14 membres.
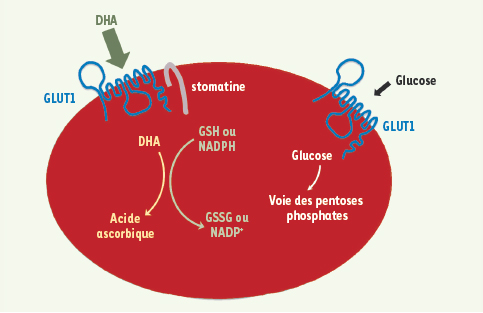
Dans le sang, l’acide ascorbique plasmatique est oxydé en DHA. Le DHA est capté par les érythrocytes par l’intermédiaire de GLUT1 et y est immédiatement réduit en acide ascorbique (Figure 1). Ce cycle induit la formation d’un gradient d’acide ascorbique à travers la membrane de l’érythrocyte et permet sa rediffusion vers le plasma [
7].
 | Figure 1.
GLUT1 et stomatine dans le recyclage du DHA en acide ascorbique par les érythrocytes humains. Lors de sa captation par GLUT1 dans les érythrocytes, le DHA piégé à l’intérieur de la cellule est instantanément converti en acide ascorbique. Cette réduction du DHA en acide ascorbique dans les érythrocytes est dépendante du GSH et du NADPH. Cela génère, au moins de façon transitoire, un gradient d’acide ascorbique à travers la membrane de l’érythrocyte, favorisant la diffusion de l’ascorbate vers l’extérieur de la cellule (adapté de [ 7]). |
GLUT1 est présent à la surface des globules rouges humains à raison de plus de 200 000 molécules par cellule [
9]. Pour autant, la régulation de son expression restait méconnue, en grande partie du fait de l’absence d’anticorps fiables dirigés contre sa partie extracellulaire, partie peu immunogène et très conservée parmi les espèces [
2]. L’identification de GLUT1 comme récepteur de l’enveloppe du rétrovirus de la leucémie T humaine (HTLV, human T-cell leukemia virus) [
4,
6], a permis de contourner ce problème grâce au développement d’un nouveau ligand de surface de GLUT1, dérivé de la glycoprotéine d’enveloppe de HTLV [
1]. Ce ligand, qui lie la boucle extérieure carboxy-terminale de GLUT1 [
3] et est utilisable en cytométrie en flux, représente un outil unique pour la détection des molécules de GLUT1 présentes à la surface cellulaire [2,
5,
10].
Grâce à ce nouveau ligand, nous avons suivi l’expression en surface de GLUT1 dans un modèle ex vivo de l’érythropoïèse humaine [
8]. Nous avons observé que GLUT1 est exprimé dès le stade érythroblaste, avec une augmentation de l’expression au cours de la différenciation, pour atteindre un pic d’expression dans les érythrocytes matures énucléés. Nous avons découvert que cette augmentation corrélait avec une augmentation de la captation du DHA alors que, curieusement, le transport même du glucose diminuait. De fait, nous avons montré que contrairement à ce qui se passe dans les cellules nucléées, le glucose n’entre pas en compétition avec le DHA pour le transport par GLUT1 dans les érythrocytes. Cette prédilection des globules rouges pour le transport de la vitamine C, même en présence d’une concentration importante de glucose (5 mM dans le plasma), permet ainsi la captation immédiate de doses même très faibles de DHA et concorde avec le processus de recyclage de l’acide ascorbique.
Nous avons mis en évidence que cette particularité des globules rouges humains était liée à la présence d’une autre protéine membranaire associée à GLUT1 : la stomatine. Cette protéine apparaissait en effet au cours de l’érythropoïèse, en parallèle avec la perte de l’effet compétitif du glucose sur la captation de DHA (Figure 1). De plus, la surexpression de stomatine dans une lignée cellulaire entraîne une diminution de la captation de glucose et une augmentation de celle du DHA. De fait, les érythrocytes de patients atteints de stomatocytose ont des niveaux d’expression très réduits de stomatine et montrent une augmentation du transport du glucose et une diminution de celui du DHA. Ces observations arguent en faveur d’un rôle de la stomatine dans le transport préférentiel de DHA [8].
Les érythrocytes de la souris adulte n’expriment pas GLUT1 mais GLUT4
Les mesures de transport de glucose dans les globules rouges humains ont toujours montré une captation significativement plus élevée par rapport à celle des autres espèces. Par extrapolation, on supposait que cela était dû à la densité plus importante de GLUT1 observée sur les érythrocytes humains. Mais, de façon inattendue, nous avons aussi découvert que les érythrocytes de souris, qui expriment GLUT1 juste après la naissance, perdent cette propriété en quelques jours. En fait, nous avons montré que la capture de glucose par les érythrocytes murins adultes était assurée par GLUT4, et non GLUT1 [
8].
GLUT1 érythrocytaire et captation de DHA sont caractéristiques des espèces incapables de synthétiser la vitamine C
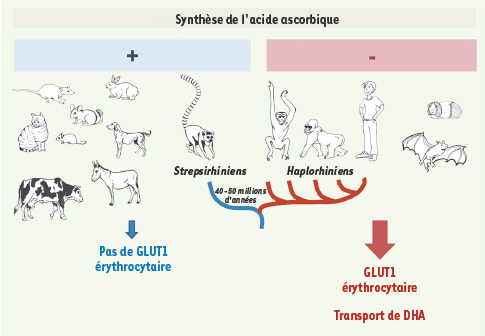
C’est cette grande disparité d’expression entre globules rouges humains et murins qui nous a conduits à chercher les pressions de sélection qui auraient permis de maintenir l’expression de GLUT1 dans les érythrocytes humains. Nous avons ainsi émis l’hypothèse que la captation de DHA par le GLUT1 des globules rouges humains pouvait être liée à l’incapacité de l’homme à synthétiser la vitamine C. Effectivement, nous avons observé que seules les espèces dont le gène de la GLO est muté (humains, primates supérieurs, chauve-souris frugivores, et cobaye) exprimaient GLUT1 à la surface de leurs érythrocytes, alors que nous n’avons détecté aucune expression de GLUT1 sur les globules rouges de nombreuses espèces qui synthétisent la vitamine C
(Figure 2). En accord avec ces observations, nous avons déterminé que bien que le transport de glucose soit équivalent dans les érythrocytes de souris et de cobaye, seuls ces derniers montrent une captation efficace du DHA [
8].
 | Figure 2.
GLUT1 érythrocytaire et captation de DHA chez les espèces incapables de synthétiser la vitamine C. Chez les mammifères, seules les espèces dont le gène de la GLO (gulonolactone oxydase) est muté (cobaye, chauve-souris frugivores, humains et primates haplorhiniens) expriment GLUT1 à la surface de leurs globules rouges. Chez l’homme, nous avons montré que la stomatine est impliquée dans la captation efficace du DHA par GLUT1 [ 8]. |
Notre hypothèse s’est vérifiée plus avant : l’inactivation de la GLO est apparue à la divergence entre les strepsirhiniens (dont font partie les lémuriens) qui synthétisent la vitamine C, et les haplorhiniens (dont font partie les primates supérieurs et les humains) qui ont perdu cette capacité. Aussi avons-nous montré que les érythrocytes des lémuriens n’expriment pas GLUT1 à leur surface et ne transportent pas significativement le DHA, contrairement à tous les autres primates haplorhiniens testés (Figure 2).
Le maintien d’un GLUT1 érythrocytaire chez l’adulte, accompagné d’un mécanisme de recyclage préférentiel de l’acide ascorbique au lieu du glucose, semble donc avoir émergé parallèlement à la perte de capacité de synthèse de la vitamine C au cours de l’évolution, conférant une propriété commune inattendue aux primates supérieurs, aux cobayes et aux chauve-souris frugivores.