| |
| Med Sci (Paris). 2008 May; 24(5): 462–463. Published online 2008 May 15. doi: 10.1051/medsci/2008245462.Le signal eat-me des exosomes de réticulocytes Lionel Blanc* and Michel Vidal* UMR 5235, Université Montpellier II cc 107, place E. Bataillon, 34095 Montpellier, France MeSH keywords: Animaux, Apoptose, Humains, Phagocytose, Réticulocytes, Transduction du signal |
Sécrétion exosomale lors de la maturation du réticulocyte en globule rouge Les exosomes sont de petites vésicules membranaires (environ 50 nm) libérées par des cellules lors de la fusion d’endosomes multivésiculaires avec la membrane plasmique [
1]. On pourrait oser faire un parallèle, du point de vue fonctionnel, entre apoptose et sécrétion exosomale dans le réticulocyte. L’apoptose est un processus de mort cellulaire programmée qui permet la maintenance de l’homéostasie tissulaire chez l’organisme adulte ; elle permet également de façonner les organes et d’éliminer des structures vestigiales lors de l’embryogenèse [
2]. Dans le réticulocyte, la libération d’exosomes contribue également à façonner, non pas un organe, mais le globule rouge dans sa phase de différenciation terminale. La perte de membrane entre le stade réticulocyte et le globule rouge mature représente 10 à 15 % de la surface cellulaire [
3]. Cette perte de membrane se produit principalement par la sécrétion d’exosomes. De plus, l’aspect quantitatif de ce processus est doublé d’une caractéristique qualitative. La libération d’exosomes permet, en effet, l’élimination de certaines protéines obsolètes de la surface du globule rouge, par leur tri spécifique dans les vésicules internes des endosomes multivésiculaires, puis leur expulsion dans le milieu extracellulaire. Le récepteur de la transferrine (RTf), dont environ 100 000 copies sont présentes dans un réticulocyte, disparaît totalement de la surface érythrocytaire via la voie exosomale [1]. L’intégrine α4β1, impliquée dans la rétention de la cellule érythroïde dans l’îlot érythroblastique1, est également évacuée de la surface des globules rouges matures par son tri exosomal, évitant ainsi une interaction des érythrocytes avec les cellules endothéliales et la formation de bouchons vasculaires [
4]. |
Similitude de signaux eat me exprimés par les corps apoptotiques et les exosomes Des travaux publiés récemment montrent un autre point de similitude entre apoptose et sécrétion d’exosomes à partir de réticulocytes [
5]. Les corps apoptotiques résultant de la mort programmée des cellules sont rapidement éliminés par phagocytose sans occasionner de lésion inflammatoire. En effet, contrairement au phénomène de nécrose, l’intégrité de la membrane cellulaire est conservée lors de l’apoptose, permettant d’éviter la libération de molécules (par exemple heat shock proteins, ADN…) capables de provoquer une immuno-stimulation. La présence de signaux de mort (ou signaux « eat-me ») à la surface de la cellule apoptotique entraîne sa reconnaissance par des phagocytes professionnels ou occasionnels. Le premier signal de mort décrit a été la phosphatidylsérine (PS). Normalement présent exclusivement dans le feuillet interne de la membrane, ce phospholipide est exposé à la surface des cellules apoptotiques [
6]. Plus récemment, l’exposition d’un autre phospholipide, la lysophosphatidylcholine (LPC), a été décrite comme un autre signal de mort. La LPC est produite dans les cellules apoptotiques par l’activation d’une iPLA2 (phospholipase A2 indépendante du calcium) par la caspase-3 [
7]. L’exposition de ces deux phospholipides (PS et LPC) à la surface des cellules apoptotiques permet le recrutement d’opsonines spécifiques qui peuvent interagir avec des récepteurs membranaires de phagocytes et entraîner leur ingestion [7]. Or, MFG-E8 (milk fat globule-EGF factor 8 protein), une opsonine spécifiquement recrutée par la présence de PS à la surface de la membrane, a été retrouvée associée à des exosomes [
8]. Par ailleurs, il est remarquable de noter que l’aminophospholipide translocase (flippase), l’enzyme en charge du maintien de l’asymétrie de la PS dans le feuillet interne de la membrane, n’est pas retrouvée dans les exosomes de réticulocytes [
9]. De plus, Tim4, identifié récemment comme le récepteur de la PS impliqué dans la phagocytose des cellules apoptotiques, est capable de lier des exosomes [
10]. Il a maintenant été montré que les exosomes de réticulocytes recrutent à leur surface des anticorps naturels de classe IgM spécifiques de la LPC [5]. Comme pour les cellules apoptotiques, la production de LPC dans les exosomes de réticulocytes met en jeu une iPLA2 sensible à un inhibiteur spécifique : la bromo-enolactone (BEL). Une activité caspase-3, mise en évidence dans les exosomes de réticulocyte [
11], clive l’iPLA2 en une forme de 30 kDa comme décrit précédemment [7]. Les IgM reconnaissent la LPC et peuvent initier l’activation du complément en permettant la liaison de C1q, puis le dépôt de C3b/bi à la surface membranaire, qui devient alors « identifiable » par les phagocytes exprimant les récepteurs CR3 et CR4. C1q peut également, par l’intermédiaire de sa liaison à la calréticuline [
12], entraîner l’interaction avec CD91 [7]. La Figure 1 présente un schéma des différentes possibilités d’exposition de signaux eat-me à la surface des exosomes de réticulocyte.
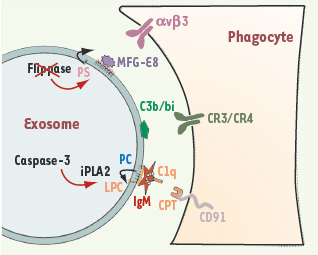
 | Figure 1.
Possibilités d’interactions entre exosomes de réticulocyte et cellules. Les exosomes de réticulocyte peuvent recruter différentes opsonines spécifiques du phospholipide (PS et/ou LPC) exposé à la surface des vésicules. Des récepteurs à la surface de cellules sont alors capables de provoquer l’internalisation des exosomes opsonisés. Note : en parfait accord avec une libération des exosomes de réticulocyte dans la circulation systémique, nous avons mis en évidence une association de l’apolipoprotéine H (ou β2-glycoprotéine I), opsonine majeure du sérum reconnaissant la PS (résultats non publiés). |
|
Réaction immunitaire à l’ingestion d’exosomes ? L’ingestion de cellules apoptotiques est capable de supprimer la production de cytokines pro-inflammatoires (comme l’IL-12) et d’augmenter celle de cytokines anti-inflammatoires (comme l’IL-10, le TGF-β). Il est possible qu’une telle régulation de médiateurs inflammatoires se produise également lors de l’internalisation des exosomes de réticulocytes par les cellules et favorise une réaction de tolérance, minimisant un effet d’HSP70, une protéine systématiquement retrouvée dans les exosomes. La liaison d’HSP70 à des peptides antigéniques et sa capacité à activer les récepteurs Toll-like (TLR2-TLR4) en font une molécule à fort potentiel immunogène. La présence d’ARN dans les exosomes [
13] pourrait également être considérée comme facteur potentiel susceptible d’activer les récepteurs TLR3. Il est tentant d’imaginer que les phagocytes de la rate, en charge de l’élimination des érythrocytes âgés, soient également impliqués dans la clairance des exosomes de réticulocytes. Le fer héminique est recyclé lors de la phagocytose et du catabolisme des globules rouges sénescents par les macrophages tissulaires. Cette voie produit environ 95 % des besoins journaliers en fer nécessaires pour l’érythropoïèse. Les acteurs principaux de cette érythrophagocytose sont les macrophages de la rate (dans la pulpe rouge) et de la moelle osseuse. Les acteurs cellulaires de la clairance des exosomes de réticulocyte restent à définir, les récepteurs impliqués et les réponses immunorégulatrices en résultant devront être caractérisés pour confirmer ou infirmer ces différentes hypothèses. |
Footnotes |
1. Pan BT, Teng K, Wu C, et al. Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes. J. Cell Biol. 1985; 101 : 942–8. 2. Pradel J, Graba Y, Aragnol D. Gènes homéotiques et apoptose, d’architecte à sculpteur. Med Sci (Paris) 2003; 19 : 271–3. 3. Waugh RE, McKenney JB, Bauserman RG, et al. Surface area and volume changes during maturation of reticulocytes in the circulation of the baboon. J Lab Clin Med 1997; 129 : 527–35. 4. Rieu S, Géminard C, Rabesandratana H, et al. Exosomes released during reticulocyte maturation bind to fibronectin via integrin a4b1. Eur J Biochem 2000; 267 : 583–90. 5. Blanc L, Barres C, Bette-Bobillo P, et al. Reticulocyte-secreted exosomes bind natural IgM antibodies: involvement of a ROS-activatable endosomal phospholipase iPLA2. Blood 2007; 110 : 3407–16. 6. Chimini G. Le récepteur des phosphatidylsérines, une arlésienne qui nous surprend toujours. Med Sci (Paris) 2004; 20 : 501–2. 7. Lauber K, Blumenthal SG, Waibel M, et al. Clearance of apoptotic cells: getting rid of the corpses. Mol Cell 2004; 14 : 277–87. 8. Thery C, Boussac M, Veron P, et al. Proteomic analysis of dendritic cell-derived exosomes: a secreted subcellular compartment distinct from apoptotic vesicles. J Immunol 2001; 166 : 7309–18. 9. Vidal M, Sainte-Marie J, Philippot J, et al. Asymmetric distribution of phospholipids in the membrane of vesicles released during in vitro maturation of guinea pig reticulocytes: evidence precluding a role for « aminophospholipid translocase ». J Cell Physiol 1989; 140 : 455–62. 10. Miyanishi M, Tada K, Koike M, et al. Identification of Tim4 as a phosphatidylserine receptor. Nature 2007; 450 : 435–9. 11. De Gassart A, Géminard C, Février B, et al. Lipid raft-associated proteins sorting in exosomes. Blood 2003; 102 : 4336–44. 12. Apetoh L, Ghiringhelli F, Zitvogel L. Calreticulin dictates the immunogenicity of anti- cancer chemotherapy and radiotherapy. Med Sci (Paris) 2007; 23 : 257–8. 13. Valadi H, Ekstrom K, Bossios A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol 2007; 9 : 654–9. |