| |
| Med Sci (Paris). 2008 May; 24(5): 467–469. Published online 2008 May 15. doi: 10.1051/medsci/2008245467.De macro à micro : l’histoire de la plaquette Najet Debili* and William Vainchenker* Inserm UMR 790, université Paris XI, Institut Gustave Roussy, 39, rue Camille Desmoulins, 94805 Villejuif, France MeSH keywords: Antigènes CD, Antigènes CD34, Plaquettes, Humains, Mégacaryocytes |
Petites, mais talentueuses Les plaquettes sont les cellules du sang les plus petites. Spécialisées dans l’hémostase, par leurs propriétés d’adhérence et d’agrégation, elles sont capables dans un premier temps d’assurer l’arrêt rapide d’un saignement. Cependant les études récentes montrent que la fonction des plaquettes ne se limite pas à ce « clou plaquettaire », car elles interviennent dans l’angiogenèse, l’inflammation et la réaction immunitaire innée. Elles sont en effet impliquées dans le développement de l’athérosclérose, du processus métastatique, et de maladies infectieuses virales. La plaquette est une cellule anucléée, particulière par le développement d’un grand réseau de membranes, et par la présence de granules de sécrétion très spécialisés comme les granules alpha, qui contiennent des molécules impliquées dans l’hémostase, des facteurs de croissance, des facteurs pro- et anti-angiogéniques, et des médiateurs de l’inflammation (Figure 1).  | Figure 1.
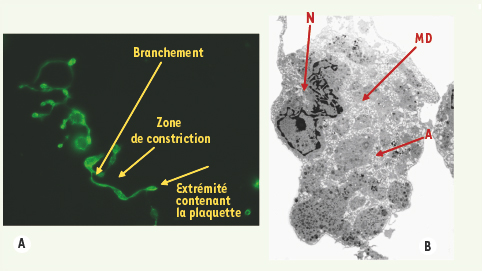
Structure mégacaryocytaire et formation de proplaquettes. A. Formation de proplaquettes à partir de mégacaryocytes obtenus en culture via la différenciation de cellules progénitrices immatures CD34+ de sang humain : les cellules sont déposées sur des lames recouvertes de polylysine, fixées, perméabilisées puis immuo-marquées avec un anticorps dirigé contre la tubuline. B. Ultrastructure d’un mégacaryocyte typique obtenu in vitro : le mégacaryocyte est de grande taille, présente un noyau polylobulé (N), des membranes de démarcation bien développées (MD) ainsi que de nombreux granules alpha (A). |
La production des plaquettes est assurée, comme celle de la totalité des cellules du sang, par la différenciation des cellules souches hématopoïétiques. Entre autres voies de différenciation, celles-ci s’engagent dans la voie mégacaryocytaire pour donner naissance, plusieurs divisions plus tard, en fin de différenciation, aux mégacaryocytes, précurseurs directs des plaquettes. La production plaquettaire est régulée par une cytokine principale, la thrombopoïétine, qui est synthétisée essentiellement par le foie et plus accessoirement par le rein et le stroma médullaire. La prolifération des progéniteurs, qui régule le nombre de mégacaryocytes, contrôle la production plaquettaire, mais celle-ci fait aussi intervenir deux mécanismes biologiques quasiment uniques parmi les différents modèles de différenciation chez les mammifères : (1) une polyploïdisation du mégacaryocyte par un processus appelé endomitose ; et (2) une fragmentation du cytoplasme du mégacaryocyte, un mécanisme dynamique qui donne naissance aux plaquettes. |
Un processus de formation unique dans les mégacaryocytes La polyploïdisation du mégacaryocyte, contrairement à celle d’autres cellules, fait partie intégrante du processus de différenciation et a pour objectif majeur de faire du mégacaryocyte une cellule géante, ce qui augmente la production plaquettaire. À la fin du processus d’endomitoses, le mégacaryocyte commence à synthétiser un nombre important de membranes qui, comme on l’observe en microscopie électronique, délimitent des territoires plaquettaires qui semblaient être à l’origine des futures plaquettes, expliquant le terme de « membranes de démarcation » donné à ces membranes. L’hypothèse initiale défendue par plusieurs auteurs jusqu’à récemment stipulait en effet que les plaquettes étaient préformées dans le cytoplasme du mégacaryocyte et libérées lors de la rupture de la membrane plasmique du mégacaryocyte [
1]. Les membranes de démarcation sont en fait en continuité avec la membrane plasmique, le mégacaryocyte produisant un large excès de membrane plasmique qui s’invagine dans le cytoplasme du mégacaryocyte. Déjà en 1956, J.P. Thierry et M. Bessis observaient qu’in vitro des mégacaryocytes étaient capables de prendre l’aspect de pieuvres en émettant de nombreux pseudopodes [
2], et J.M. Radley et son équipe ont identifié dans la moelle ces longs pseudopodes, traversant la barrière endothéliale, appelés proplaquettes [
3]. Ces résultats ont été confirmés ensuite par plusieurs autres équipes, mais ils se fondent sur l’observation d’un nombre limité de mégacaryocytes. La découverte de la thrombopoïétine a changé la donne en facilitant l’approche expérimentale de ces processus, car l’obtention d’un grand nombre de mégacaryocytes in vitro à partir de progéniteurs mégacaryocytaires est maintenant possible. En culture, les mégacaryocytes forment spontanément des proplaquettes avant de libérer de vraies plaquettes, et les données initiales de J.M. Radley ont été confirmées par l’observation que les proplaquettes correspondent à des déroulements des membranes de démarcation [
4–
6]. Les microtubules en glissant les uns sur les autres procurent la force de protrusion [
5–
8] et régulent le trafic des organites comme les mitochondries et les granules, du corps du mégacaryocyte vers les proplaquettes [
9]. Autre argument confirmant le rôle des proplaquettes dans la formation des plaquettes, l’invalidation du facteur de transcription NF-E2 entraîne une thrombopénie profonde parce que les mégacaryocytes sont incapables de former des proplaquettes [
10]. Or NF-E2 contrôle au niveau transcriptionnel l’expression de la tubuline β1, principale tubuline du mégacaryocyte mature. L’équipe d’Italiano et al. a montré qu’au bout des proplaquettes, les microtubules s’enroulaient pour « préformer » une plaquette qui était ensuite libérée à l’extrémité de la proplaquette [6]. Les plaquettes peuvent naître différemment : d’autres équipes ont ainsi montré que les proplaquettes se cassaient en culture au niveau de zones rétrécies et se détachaient du mégacaryocyte pour se fragmenter secondairement [5] (Figure 1). Mais une des limites de ces descriptions de la « naissance » des plaquettes est que les observations se faisaient in vitro dans des systèmes de culture très artificiels. |
Le film de la naissance d’une pro-plaquette in vivo
Ce qui fait tout l’interêt du travail de T. Junt et al., dont les résultats ont été récemment publiés dans Science, c’est la démonstration que ces auteurs font, par une approche très innovante technologiquement, de la production plaquettaire in vivo, qui est bien liée à la formation de proplaquettes dans les sinusoïdes de la moelle [
11]. Grâce à l’utilisation d’un microscope biphotonique permettant une visualisation par microscopie intravitale, ils ont pu observer des mégacaryocytes formant des proplaquettes in vivo chez des souris ayant des mégacaryocytes spontanément fluorescents, par knock in du gène codant la GPIIb plaquettaire (CD41) par la EYFP (extended yellow fluorescent protein). Les auteurs montrent que les mégacaryocytes étendent les proplaquettes dans la circulation vasculaire et que ces proplaquettes se cassent dans les sinusoïdes sous l’effet du flux sanguin, en libérant parfois des fragments de très grande taille qui ensuite se fragmentent à nouveau dans la circulation. La formation directe de plaquettes, sans passer par une étape intermédiaire de proplaquettes, semble plus rare, mais elle est techniquement difficile à visualiser. Ces résultats confirment ceux de O. Behnke qui avait identifié dans le sang circulant chez l’homme, la présence de proplaquettes capables de se fragmenter in vitro en plaquettes [
12]. T. Junt et al. ont également observé la migration d’un mégacaryocyte qui, momentanément, obstrue la circulation dans les sinusoïdes. L’une des observations les plus curieuses de ce travail concerne la présence d’extensions, et peut être la présence de fragments de cytoplasme, voire de plaquettes, dans l’insterstitium de la moelle. Or, il est fondamental que la plaquettogenèse ait lieu dans la circulation et non à l’intérieur de la moelle, car les plaquettes n’ont pas la propriété de traverser la barrière endothéliale. Il est donc possible que ces fragments détectés dans l’environnement médullaire ne soient pas de vraies plaquettes, mais représentent des particules qui assurent la régulation du stroma médullaire. On pourrait spéculer sur le rôle de ce processus en pathologie : par exemple, l’augmentation de ces fragments interstitiels pourrait faciliter le développement d’une myélofibrose, via une sécrétion excessive de TGF-β1 (dont les mégacaryocytes sont un réservoir important) dans l’environnement médullaire. |
Mégacaryocyte et cellules endothéliales : ça passe ou ça casse Le déroulement d’une plaquettogenèse efficace exige que le mégacaryocyte mature migre d’un environnement ostéoblastique vers les sinusoïdes. Il existe des arguments impliquant la chimiokine SDF-1/CCL12 dans ce processus de chimio-attraction, bien que des résultats très contradictoires aient été rapportés et que des souris receveuses ayant reçu une greffe de moelle osseuse de souris donneuses CXCR4−/−
ne soient pas thrombopéniques [
13]. On ne sait pas si une molécule régule la formation de proplaquettes, mais en tous les cas la thrombopoïétine n’est pas directement impliquée dans ce processus, expliquant que son effet sur la production plaquettaire soit retardé. Il existe des arguments in vitro pour penser que l’environnement intra-médullaire, en particulier le collagène, inhibe la formation des proplaquettes [
14]. En revanche, lorsque le mégacaryocyte migre à proximité des cellules endothéliales il entre en contact avec un autre environnement contenant du facteur von Willebrand et du fibrinogène, deux facteurs capables d’induire la formation des proplaquettes [
15]. La migration du mégacaryocyte dans un environnement approprié serait donc le mécanisme régulateur de la formation de proplaquettes, et le flux sanguin contrôlerait la libération des plaquettes par cassure des proplaquettes. On peut penser que des altérations de ce mécanisme de régulation par le stroma médullaire pourrait être à l’origine de thrombopénies [
16]. De macro à micro : beaucoup reste à découvrir. |
1. Zucker-Franklin D, Petursson S. Thrombocytopoiesis: analysis by membrane tracer and freeze-fracture studies on fresh human and cultured mouse megakaryocytes. J Cell Biol 1984; 99 : 390–402. 2. Thiery JP, Bessis M. Mécanisme de la plaquettogenèse. Rev Hematol 1956; 11: 162–74. 3. Radley JM, Haller CJ. The demarcation membrane system of the megakaryocyte: a misnomer ? Blood 1982; 60 : 213–9. 4. Choi ES, Nichol JL, Hokom MM, et al. Platelets generated in vitro from proplatelet-displaying human megakaryocytes are functional. Blood 1995; 85 : 402–13. 5. Cramer EM, Norol F, Guichard J, et al. Ultrastructure of platelet formation by human megakaryocytes cultured with the Mpl ligand. Blood 1997; 89 : 2336–46. 6. Italiano JE Jr, Lecine P, Shivdasani RA, Hartwig JH. Blood platelets are assembled principally at the ends of proplatelet processes produced by differentiated megakaryocytes. J Cell Biol 1999; 147 : 1299–312. 7. Tablin F, Castro M, Leven RM. Blood platelet formation in vitro. The role of the cytoskeleton in megakaryocyte fragmentation. J Cell Sci 1990; 97 : 59–70. 8. Patel SR, Richardson JL, Schulze H, et al. Differential roles of microtubule assembly and sliding in proplatelet formation by megakaryocytes. Blood 2005; 106 : 4076–85. 9. Richardson JL, Shivdasani RA, Boers C, et al. Mechanisms of organelle transport and capture along proplatelets during platelet production. Blood 2005; 106 : 4066–75. 10. Lecine P, Villeval JL, Vyas P, et al. Mice lacking transcription factor NF-E2 provide in vivo validation of the proplatelet model of thrombocytopoiesis and show a platelet production defect that is intrinsic to megakaryocytes. Blood 1998; 92 : 1608–16. 11. Junt T, Schulze H, Chen Z, et al. Dynamic visualization of thrombopoiesis within bone marrow. Science 2007; 317 : 1767–70. 12. Behnke O, Forer A. From megakaryocytes to platelets: platelet morphogenesis takes place in the bloodstream. Eur J Haematol 1998; 61 (suppl) : 3–23. 13. Foudi A, Jarrier P, Zhang Y, et al. Reduced retention of radioprotective hematopoietic cells within the bone marrow microenvironment in CXCR4−/−
chimeric mice. Blood 2006; 107 : 2243–51. 14. Sabri S, Jandrot-Perrus M, Bertoglio J, et al. Differential regulation of actin stress fiber assembly and proplatelet formation by alpha2beta1 integrin and GPVI in human megakaryocytes. Blood 2004; 104 : 3117–25. 15. Larson MK, Watson SP. Regulation of proplatelet formation and platelet release by integrin alpha IIb beta3. Blood 2006; 108 : 1509–14. 16. Sabri S, Foudi A, Boukour S, et al. Deficiency in the Wiskott-Aldrich protein induces premature proplatelet formation and platelet production in the bone marrow compartment. Blood 2006; 108 : 134–40. |