| |
| Med Sci (Paris). 2008 May; 24(5): 470–472. Published online 2008 May 15. doi: 10.1051/medsci/2008245470.In mito veritas ? Jean-Claude Kaplan* Institut Cochin, Université Paris Descartes, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Cyclophilines, Humains, Dystrophies musculaires, Sarcolemme |
 Faute de pouvoir attaquer les maladies génétiques monogéniques par la racine, dans une démarche étiologique de thérapie génique, on s’efforce à présent de développer des stratégies d’aval visant à lutter contre les conséquences plus ou moins distales du défaut primaire. Deux articles, parus simultanément en mars 2008, illustrent ce type de démarche en proposant de traiter certaines dystrophies musculaires par une thérapeutique ciblée sur la mitochondrie [
2,
3]. Faute de pouvoir attaquer les maladies génétiques monogéniques par la racine, dans une démarche étiologique de thérapie génique, on s’efforce à présent de développer des stratégies d’aval visant à lutter contre les conséquences plus ou moins distales du défaut primaire. Deux articles, parus simultanément en mars 2008, illustrent ce type de démarche en proposant de traiter certaines dystrophies musculaires par une thérapeutique ciblée sur la mitochondrie [
2,
3]. |
Les dystrophies musculaires Les dystrophies musculaires (DM) sont des maladies génétiques monogéniques affectant principalement le tissu musculaire strié, qui est progressivement détruit, entraînant une faiblesse musculaire croissante dont la progression est plus ou moins rapide, pouvant à la longue entraîner la mort par insuffisance cardiaque et respiratoire [
4]. En fait, cette dénomination recouvre plusieurs dizaines d’entités cliniques distinctes sous-tendues par des défauts siégeant dans une trentaine de gènes déjà identifiés [
5], qui spécifient des protéines de fonctions et de topographie subcellulaire très variées. Schématiquement, on distingue les DM se manifestant après la naissance (une trentaine de phénotypes cliniques différents, et 20 gènes identifiés), et les DM congénitales (une vingtaine de phénotypes, 12 gènes identifiés). Dans les deux catégories figurent des maladies où le défaut protéique affecte l’intégrité du sarcolemme et entraîne une perturbation des flux calciques [
6–
8]. |
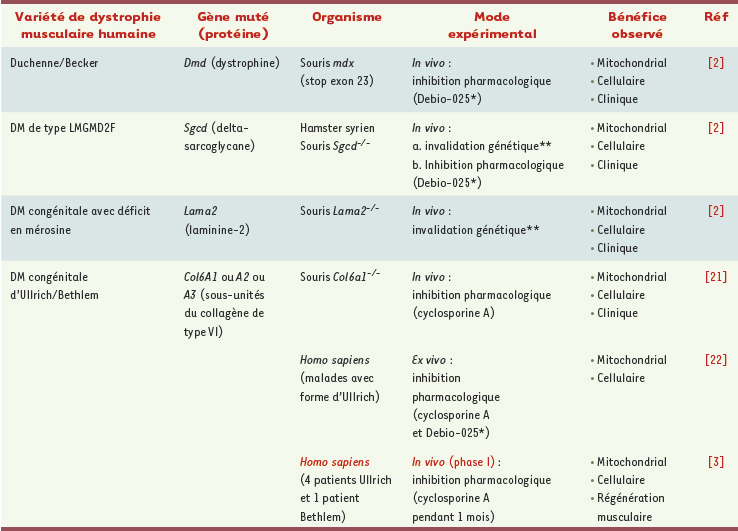
Cyclophiline-D et dystrophies musculaires par anomalie du sarcolemme Millay et al. [2] et Merlini [3] et al. proposent d’enrayer le processus dystrophique dans quatre de ces maladies du sarcolemme (Tableau I) en agissant sur la mitochondrie, qui est le maillon terminal commun de la cascade physiopathologique liée à l’anomalie membranaire génératrice d’une augmentation du Ca2+ intracellulaire. Celle-ci induit une perméation anormale des mitochondries qui gonflent et éclatent, provoquant un processus de nécrose et/ou d’apoptose. On sait que cette pathologie mitochondriale est caractérisée par la constitution d’un pore non spécifique appelé PTP (permeability transition pore), ou MPT (mitochondrial permeability transition) [
9–
12]. Ce pore est constitué par l’assemblage de trois protéines : la protéine VDAC (voltage-dependent transporter) située dans la membrane mitochondriale externe, la protéine ANT (adenine nucleotide translocase) dans la membrane mitochondriale interne et la protéine CypD (cyclophiline-D) dans l’espace mitochondrial interne [
13,
14]. CypD est une peptidyl prolyl-isomérase qui, en se liant à ANT, maintient le pore PTP sous forme ouverte, ce qui met directement en communication l’espace mitochondrial interne avec le cytosol et aboutit à la mort cellulaire, soit par apoptose s’il ne s’ouvre que par intermittence, soit par nécrose s’il demeure ouvert en permance [
15]. Le rôle de CypD dans la pathologie mitochondriale induite par stress oxydatif ou par le Ca2+ a été élégamment élucidé par des expériences de génomique fonctionnelle, utilisant des souris dont le gène correspondant (Ppif) a été invalidé [
16,
17]. Mais, puisqu’il s’agit d’une cyclophiline, il existe un autre moyen de neutraliser CypD, c’est la voie pharmacologique par la cyclosporine A (CsA). Rappelons que la CsA est un undécapeptide naturel utilisé depuis 25 ans pour son effet immunosuppresseur. Celui-ci résulte du blocage des cyclophilines cytosoliques qui sont nécessaires pour l’activation de la calcineurine, prélude au déclenchement de la production de certaines interleukines. Or la CypD, qui est strictement mitochondriale, est également une cible pour la CsA. Ceci permet d’envisager un second impact pharmacologique du médicament qui bloquerait la formation du pore PTP, par un mécanisme indépendant de la calcineurine [
18]. En substituant sur la molécule de CsA le résidu sarcosine en position 3 par une N-méthyle-D-ala, et le résidu N-méthyle-leucine en position 4 par un reste N-éthyle-val, les chimistes de la firme DebioPharm de Lausanne (Suisse) sont justement parvenus à obtenir un analogue (Debio-025) qui ne cible plus que CypD, ce qui en fait un médicament purement mitochondrial, dépourvu de tout effet immunosuppresseur [
19]. Pour démontrer que CypD est une cible thérapeutique intéressante dans certaines DM, Millay et al. [2] ont dans un premier temps croisé des souris Scgd−/−
ou des souris Lama2−/−
(voir Tableau I) avec des souris dont le gène de CypD a été invalidé par KO (souris Ppif−/−
). Chez les doubles-mutants obtenus, le processus dystrophique lié à l’absence soit de la delta-sarcoglycane, soit de la mérosine est considérablement ralenti. Ils en déduisent que des petites molécules inhibant CypD pourraient avoir un effet thérapeutique. Ils le démontrent ensuite en administrant Debio-025 à des souris mdx et à des souris sgcd−/−
(voir Tableau I), avec un effet bénéfique in vivo fondé sur des critères histologiques. L’article de Merlini et al. [3] porte sur les DM congénitales d’Ullrich et de Bethlem, dues à un déficit en collagène VI par des mutations siégeant dans les gènes Col6A1 ou A2 ou A3 (voir Tableau I). Il s’agit d’un essai clinique de phase I effectué sur 5 patients qui ont reçu de la cyclosporine A pendant 1 mois (dose quotidienne de 5 mg/kg). Ce traitement a entraîné une atténuation de la pathologie mitochondriale et de l’apoptose, caractéristique de ces affections. Le bien-fondé de cet essai clinique reposait sur une remarquable suite de preuves expérimentales obtenues par l’équipe de Bernardi (Padoue, Italie) qui a successivement créé un modèle murin de collagénopathie de type VI par KO du gène Col6a1 [
20], démontré la physiopathologie mitochondriale via le pore PTP, avec effet correcteur de la cyclosporine chez ces souris [
21], corrigé ex vivo par la cyclosporine et son analogue Debio-025 la pathologie mitochondriale dans des fragments biopsiques de muscle et des cultures de myoblastes de patients [
22].
 | Tableau I.
Les dystrophies musculaires améliorées par manipulation de la cyclophiline-D.
|
|
Le retour de la pharmacothérapie Les deux articles commentés ci-dessus [2, 3] convergent sur une proposition thérapeutique commune pour quatre dystrophies musculaires génétiquement et phénotypiquement différentes (Tableau I) : le blocage de la cyclophiline-D par la cysclosporine A ou mieux par son dérivé très ciblé Debio-025. L’intérêt d’un ciblage pharmacologique de la mitochondrie dans nombre d’affections, non seulement génétiques mais acquises (insuffisance cardiaque, syndrome d’ischémie/reperméation, neurodégénérescences), a été récemment souligné par Armstrong [
23]. Si les essais cliniques qui vont s’ensuivre confirment le bénéfice d’un traitement qui n’est après tout que symptomatique1, il s’agirait d’une véritable révolution. En effet, puisque les molécules thérapeutiques sont diffusibles, elles peuvent atteindre l’ensemble des muscles affectés. On peut même chercher à étendre les indications à d’autres DM où il existe une mitochondriopathie latente induite par le Ca2+. De plus, la tolérance pharmacologique pourrait être acceptable, car, avec un recul de 25 ans, on connaît les risques de la cyclosporine. En fait, ce composé est depuis longtemps envisagé pour lutter contre la composante inflammatoire importante dans la myopathie de Duchenne. Son potentiel thérapeutique a été découvert par hasard à l’occasion de greffes de myoblastes hétérologues chez des patients DMD sous couverture d’un traitement immunosuppresseur par la cyclosporine, car les minimes effets bénéfiques observés ont finalement été attribués à ce médicament et non à une prise de la greffe [
24]. La cyclosporine A a été administrée à des souris mdx avec quelques effets sur le plan histologique, biochimique et fonctionnel, encourageants mais non véritablement probants [
25]. Par ailleurs, un essai clinique par la cysclosporine A a été entrepris en Allemagne en 2006, portant sur une cohorte de 150 enfants atteints de DMD, dont les conclusions sont programmées pour 2008 [
26]. Or nous avons vu que l’impact de ce composé est double. D’une part, via les cyclophilines cytosoliques il bloque la calcineurine et la mise en branle des systèmes immuno-activateurs ; d’autre part, via la cyclophiline-D il bloque la formation du pore PTP et empêche la mort cellulaire et le processus dystrophique. Mais c’est une arme à double tranchant, car on sait maintenant que la calcineurine est nécessaire à la régénération musculaire [
27,
28] et que les bénéfices incontestables de la corticothérapie passent par une activation de cette voie [
29]. D’où l’intérêt de molécules comme Debio-025 qui n’agissent que sur la cible mitochondriale. La pharmacopée a des chances de s’enrichir rapidement car ces molécules sont essentiellement développées comme inhibiteurs de la réplication des virus VHC et VIH [
30,
31]. Pour l’anecdote, signalons que, dans le même numéro de mars 2008 de Nature Medicine où se trouve l’article de Millay et al. [2], on apprend qu’un pas important a été franchi dans le traitement symptomatique de la mucoviscidose [
32]. Il s’agit de l’éradication de la surinfection de l’arbre respiratoire par le Pseudomonas, en empêchant l’accumulation de céramide grâce à un inhibiteur de la sphingomyélinase, qui n’est autre que l’amitriptyline, jusqu’ici utilisé comme antidépresseur majeur… Au-delà de l’anecdote, il est réconfortant de voir que le traitement de ces maladies génétiques graves est enfin envisagé sous l’angle de la physiopathologie moléculaire. Traiter les conséquences d’un défaut génique quand on ne peut s’attaquer au défaut primaire n’a rien de déshonorant. Autrement dit, la pharmacothérapie pourrait réussir là où la génothérapie a jusqu’à présent échoué. Après le leurre de l’« ADN-médicament », il y a de l’espoir pour les « médicaments-médicaments ». |
Je remercie vivement Elizabeth Vroom, Pat Furlong et Urs Ruegg pour leur aide amicale et efficace.
|
Footnotes |
1. Wrogemann K, Pena SD. Mitochondrial calcium overload: a general mechanism for cell-necrosis in muscle diseases. Lancet 1976; 1 : 672–4. 2. Millay DP, Sargent MA, Osinska H, et al. Genetic and pharmacologic inhibition of mitochondrialdependent necrosis attenuates muscular dystrophy. Nat Med 2008; 14 : 442–7. 3. Merlini L, Angelin A, Tiepolo T, et al. Cyclosporin A corrects mitochondrial dysfunction and muscle apoptosis in patients with collagen VI myopathies. Proc Natl Acad Sci USA 2008; 105 : 5225–9. 4. Karpati G, Hilton-Jones D, Griggs R. Disorders of voluntary muscle, 7e ed. Cambridge : Cambridge University Press, 2001 : 776 p. 5. Kaplan JC. The 2008 version of the gene table of neuromuscular disorders. Neuromuscul Disord 2008; 18 : 99–129. ( http://194.167.35.195/). 6. Allard B. Sarcolemmal ion channels in dystrophin-deficient skeletal muscle fibres. J Muscle Res Cell Motil 2006; 27 : 367–73. 7. Constantin B, Sébille S, Cognard C. New insights in the regulation of calcium transfers by muscle dystrophin-based cytoskeleton: implications in DMD. J Muscle Res Cell Motil 2006; 27 : 375–86. 8. Ruegg UT, Nicolas-Metral V, Challet C, et al. Pharmacological control of cellular calcium handling in dystrophic skeletal muscle. Neuromuscul Disord 2002; 12 (suppl 1) : S155–61. 9. Bernardi P, Colonna R, Costantini P, et al. The mitochondrial permeability transition. Biofactors 1998; 8 : 273–81. 10. Bernardi P. Mitochondria in muscle cell death. Ital J Neurol Sci 1999; 20 : 395–400. 11. Bernardi P, Krauskopf A, Basso E, et al. The mitochondrial permeability transition from in vitro artifact to disease target. FEBS J 2006; 273 : 2077–99. 12. Bernardi P, Rasola A. Calcium and cell death: the mitochondrial connection. Subcell Biochem 2007; 45 : 481–506. 13. Crompton M. The mitochondrial permeability transition pore and its role in cell death. Biochem J 1999; 341 : 233–49. 14. Halestrap AP. The mitochondrial permeability transition: its molecular mechanism and role in reperfusion injury. Biochem Soc Symp 1999; 66 : 181–203. 15. Halestrap A. Biochemistry: a pore way to die. Nature 2005; 434 : 578–9. 16. Baines CP, Kaiser RA, Purcell NH, et al. Loss of cyclophilin D reveals a critical role for mitochondrial permeability transition in cell death. Nature 2005; 434 : 658–62. 17. Nakagawa T, Shimizu S, Watanabe T, et al. Cyclophilin D-dependent mitochondrial permeability transition regulates some necrotic but not apoptotic cell death. Nature 2005; 434 : 652–8. 18. Waldmeier PC, Zimmermann K, Qian T, et al. Cyclophilin D as a drug target. Curr Med Chem 2003; 10 : 1485–506. 19. Hansson MJ, Mattiasson G, Mansson R, et al. The nonimmunosuppressive cyclosporin analogs NIM811 and UNIL025 display nanomolar potencies on permeability transition in brain derived mitochondria. J Bioenerg Biomembr 2004; 36 : 407–13. 20. Bonaldo P, Braghetta P, Zanetti M, et al. Collagen VI deficiency induces early onset myopathy in the mouse: an animal model for Bethlem myopathy. Hum Mol Genet 1998; 7 : 2135–40. 21. Irwin WA, Bergamin N, Sabatelli P, et al. Mitochondrialdysfunction and apoptosis in myopathic mice with collagen VI deficiency. Nat Genet 2003; 35 : 367–71. 22. Angelin A, Tiepolo T, Sabatelli P, et al. Mitochondrial dysfunction in the pathogenesis of Ullrich congenital muscular dystrophy and prospective therapy with cyclosporins. Proc Natl Acad Sci USA 2007; 104 : 991–6. 23. Armstrong JS. Mitochondrial medicine: pharmacological targeting of mitochondria in disease. Br J Pharmacol 2007; 151 : 1154–65. 24. Miller RG, Sharma KR, Pavlath GK, et al. Myoblast implantation in Duchenne muscular dystrophy: the San Francisco study. Muscle Nerve 1997; 20 : 469–78. 25. De Luca A, Nico B, Liantonio A, et al. A multidisciplinary evaluation of the effectiveness of cyclosporine A in dystrophic mdx mice. Am J Pathol 2005; 166 : 477–89. 27. Stupka N, Gregorevic P, Plant DR, Lynch GS. The calcineurin signal transduction pathway is essential for successful muscle regeneration in mdx dystrophic mice. Acta Neuropathol 2004; 107 : 299–310. 28. Stupka N, Schertzer JD, Bassel-Duby R, et al. Stimulation of calcineurin A (alpha) activity attenuates muscle pathophysiology in mdx dystrophic mice. Am J Physiol Regul Integr Comp Physiol 2008; 294 : R983–92. 29. St-Pierre SJ, Chakkalakal JV, Kolodziejczyk SM, et al. Glucocorticoid treatment alleviates dystrophic myofiber pathology by activation of the calcineurin/NF-AT pathway. FASEB J 2004; 18 : 1937–9. 30. Paeshuyse J, Kaul A, De Clercq E, et al. The non-immunosuppressive cyclosporin DEBIO-025 is a potent inhibitor of hepatitis C virus replication in vitro. Hepatology 2006; 43 : 761–70. 31. Ptak RG, Gallay PA, Jochmans D, et al. Inhibition of human immunodeficiency virus type 1 replication in human cells by Debio-025, a novel cyclophilin binding agent. Antimicrob Agents Chemother 2008; 52 : 1302–17. 32. Teichgraber V, Ulrich M, Endlich N, et al. Ceramide accumulation mediates inflammation, cell death and infection susceptibility in cystic fibrosis. Nat Med 2008; 14 : 382–91. |
 Faute de pouvoir attaquer les maladies génétiques monogéniques par la racine, dans une démarche étiologique de thérapie génique, on s’efforce à présent de développer des stratégies d’aval visant à lutter contre les conséquences plus ou moins distales du défaut primaire. Deux articles, parus simultanément en mars 2008, illustrent ce type de démarche en proposant de traiter certaines dystrophies musculaires par une thérapeutique ciblée sur la mitochondrie [
2,
3].
Faute de pouvoir attaquer les maladies génétiques monogéniques par la racine, dans une démarche étiologique de thérapie génique, on s’efforce à présent de développer des stratégies d’aval visant à lutter contre les conséquences plus ou moins distales du défaut primaire. Deux articles, parus simultanément en mars 2008, illustrent ce type de démarche en proposant de traiter certaines dystrophies musculaires par une thérapeutique ciblée sur la mitochondrie [
2,
3].