| |
| Med Sci (Paris). 2008 May; 24(5): 511–520. Published online 2008 May 15. doi: 10.1051/medsci/2008245511.Intérêt des lignanes dans la prévention et le traitement de cancers Frédéric Lamblin,1* Christophe Hano,1 Ophélie Fliniaux,2 François Mesnard,2 Marc-André Fliniaux,2 and Éric Lainé1 1Laboratoire de Biologie des Ligneux et des Grandes Cultures, UPRES EA 1207, Centre Universitaire de Chartres, 21, rue de Loigny la Bataille, 28000 Chartres, France 2Laboratoire de phytotechnologie, UPRES EA 3900, Faculté de Pharmacie d’Amiens, Université de Picardie Jules Verne, 80037 Amiens, France |
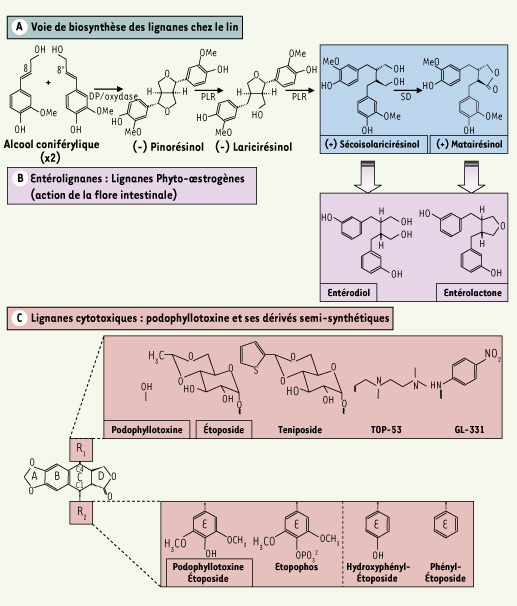
Généralités sur les lignanes Les lignanes et les néolignanes constituent un vaste groupe de substances naturelles de nature polyphénolique très répandu chez les végétaux supérieurs. Le terme lignane a été introduit pour décrire un groupe de dimères de phénylpropanoïdes dans lesquels les unités phénylpropanes sont liées par le carbone central (C8) de chaque chaîne propyle (Figure 1A). Des centaines de molécules ont déjà été identifiées dans plusieurs dizaines de familles de plantes. Leur structure chimique se caractérise par le couplage de deux unités dérivées du 1-phénylpropane, provenant elles-mêmes du métabolisme de la phénylalanine et de précurseurs appelés monolignols, ce qui les rapproche des lignines qui entrent dans la composition de la paroi des cellules végétales. Chez les lignanes, le mode de liaison des deux unités est unique, en 8 et 8’ (Figure 1A), alors qu’il est variable, impliquant d’autres atomes de carbone, chez les néolignanes. Il en résulte une plus grande diversité moléculaire des néolignanes par rapport aux lignanes. Chez les plantes vasculaires, les lignanes peuvent être isolés à partir de tiges (bois de cœur notamment), de rhizomes, d’écorces, de racines, mais aussi de graines. Ils sont rarement présents en concentration élevée. La présence de carbones asymétriques chez les lignanes est à l’origine des différents mésomères rencontrés selon les végétaux. De nombreux lignanes induisent des effets physiologiques chez l’homme. Beaucoup sont cytotoxiques, avec fréquemment des propriétés anti-mitotiques, le plus souvent non exploitables en thérapeutique en raison d’une trop grande toxicité. Ainsi, seuls des dérivés hémi-synthétiques de la podophyllotoxine (Figure 1C) sont aujourd’hui largement utilisés dans des protocoles de chimiothérapie anticancéreuse. Enfin, dans plusieurs plantes alimentaires on trouve des lignanes tels que le sécoisolaricirésinol et le matairésinol (Figure 1A), doués de propriétés phyto-œstrogènes et susceptibles de prévenir et de limiter le développement de pathologies cardiovasculaires et de certains cancers. C’est à ces derniers lignanes particulièrement abondants dans la graine du lin oléagineux, ainsi qu’à la podophyllotoxine et ses dérivés (Figure 1C) que sera consacré cet article.
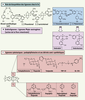 | Figure 1.
Structures des lignanes de plantes et de leurs dérivés métabolisés par les bactéries de la flore intestinale ou obtenus par hémi-synthèse. A. Voie de biosynthèse des lignanes phyto-œstrogènes chez le lin cultivé (Linum usitatissimum) aboutissant à l’accumulation de sécoisolaricirésinol (sous sa forme glycosylée) et de matairésinol dans les téguments de la graine. DP : protéine dirigeante, PLR : pinorésinol-laricirésinol réductase, SD : sécoisolaricirésinol déshydrogénase. B. Structures des entérolignanes. Certains lignanes, comme le sécoisolaricirésinol ou le matairésinol sont des phyto-œstrogènes et sont métabolisés par les bactéries de la flore intestinale en entérolignanes (entérodiol et entérolactone). Ces entérolignanes présentent des caractéristiques structurales communes avec les œstrogènes, c’est-à-dire l’œstradiol : ils vont moduler l’action des hormones sexuelles endogènes. C. Structure de la podophyllotoxine (PTOX) et de ses dérivés semi-synthétiques. La PTOX, extraite de Podophyllum hexandrum, est un lignane « cytotoxique » utilisé pour combattre les verrues plantaires, et qui présente aussi des propriétés antimitotique et antivirale. La modification chimique des cycles C et E de la PTOX par semi-synthèse permet l’obtention de molécules actives pouvant être utilisées en chimiothérapie, en tant qu’inhibiteurs de la TopII. L’étoposide, le téniposide, TOP-53 et GL-331 possèdent le même type de substitution du noyau aromatique E que la PTOX mais se distinguent par la substitution du carbone 4 (C4) du cycle C. Il est également possible de modifier le cycle E afin de rendre la molécule plus soluble (c’est le cas de l’étopophos avec l’ajout d’un groupement phosphate) ou afin de modifier l’affinité pour la TopII (c’est le cas de l’hydroxyphényl-étoposide ou du phényl-étoposide). Ces dérivés semi-synthétiques sont employés en chimiothérapie afin de lutter contre de nombreux cancers, dont ceux du poumon et les leucémies. |
|
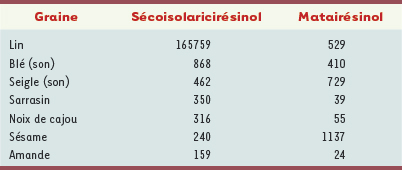
Les lignanes du lin : des phyto-œstrogènes Le lin est utilisé en pharmacie pour sa graine dont le mucilage agit comme laxatif de lest. L’huile de la graine renferme une forte proportion d’acide alpha linolénique (C18 :3, ω3 ; de 35 % à 65 % des acides gras totaux) qui joue un rôle important dans la prévention des maladies cardio-vasculaires, en régulant la cholestérolémie et en limitant la constitution des plaques d’athérome. Enfin, la graine du lin oléagineux (Figure 2A-C) est à ce jour la matière première végétale contenant le plus de lignanes phyto-œstrogènes (PE), le sécoisolaricirésinol sous forme de diglucoside (SDG) y est largement plus abondant que dans toutes les autres graines comestibles (Tableau I) [
1].
 | Figure 2.
Sources de lignanes phyto-œstrogènes et cytotoxiques. A. Le lin cultivé Linum usitatissimum, principale source de lignanes phyto-œstrogènes : le SDG (sécoisolaricirésinol diglucoside) peut représenter plus de 1 % de la masse des graines et 5 % de celle des téguments. B. Capsules et graines à maturité, lieu d’accumulation des lignanes chez le lin cultivé. C. Capsule immature en coupe transversale faisant apparaître les graines à cotylédons (c) riches en lipides, entourés de téguments protecteurs (t) accumulant les lignanes. D.
Podophyllum peltatum, originaire du continent nord-américain, accumulant de la PTOX dans ses rhizomes. E.
Linum flavum, lin sauvage à fleurs jaunes, originaire d’Europe centrale, accumulant de la 6-methoxy-PTOX, potentiellement utilisable pour l’hémisynthèse des agents anticancéreux dérivant habituellement de la PTOX |
 | Tableau I.
Concentration en sécoisolaricirésinol et matairésinol (µg/100 g matière sèche) d’extraits de divers graines comestibles (d’après [ 1]). |
Les effets bénéfiques des lignanes du lin (SDG en particulier) dans la prévention de cancers hormono-dépendants ont été largement documentés ces dernières années par des études épidémiologiques identifiant une relation entre la présence de lignanes dans la ration alimentaire et le taux d’incidence de certains cancers. Ces travaux, révélant parfois certaines contradictions, ont été recensés récemment par Hall et al. [
2] et Lainé et al. [
3]. Rôle des propriétés phyto-œstrogènes des lignanes Plusieurs études ont révélé l’action protectrice et préventive de ces molécules vis-à-vis de certains cancers, notamment les cancers hormono-dépendants (sein, prostate). Par ailleurs, si l’on se réfère aux expérimentations tant in vitro que chez l’animal [
4], ainsi qu’à des données épidémiologiques [
5], ces actions résulteraient de leurs propriétés phyto-œstrogènes. En effet, le sécoisolaricirésinol et le matairésinol sont métabolisés par les bactéries de la flore intestinale des mammifères en entérolignanes, respectivement l’entérodiol et l’entérolactone (Figure 1B). En raison de leur structure apparentée à celle de l’œstradiol (en particulier au niveau des noyaux aromatiques ; Figure 3B), les entérolignanes agissent comme modulateurs sélectifs des récepteurs des œstrogènes (récepteurs nucléaires ER). Ils sont qualifiés de SERM (specific estrogen receptor modulators). Selon la nature du PE, et en fonction du rapport des concentrations PE/œstrogènes, les entérolignanes peuvent alors agir :
-
comme agonistes, en simulant la fixation d’œstrogènes, mais avec des effets différents en fonction de l’interaction ultérieure avec des activateurs ou des inhibiteurs de transcription de certains gènes (Figure 3C).
-
comme antagonistes, en empêchant la fixation de l’œstrogène et en inhibant ainsi son action médiée par la fixation au récepteur (Figure 3C).
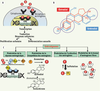 | Figure 3.
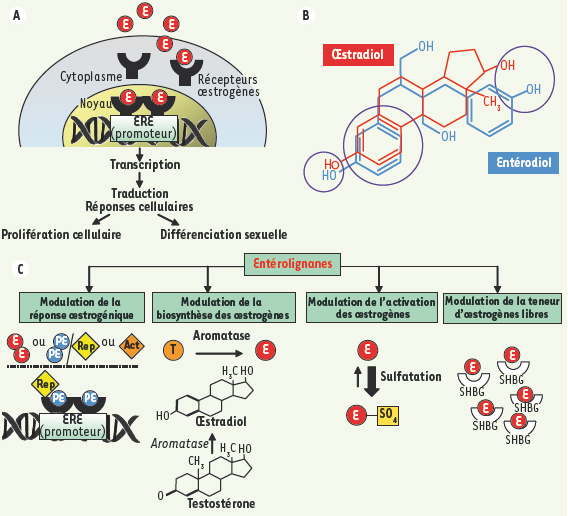
Mécanismes d’action des lignanes phyto-œstrogènes. A. Mode d’action classique de l’œstrogène : Les œstrogènes se fixent sur des récepteurs intracellulaires α (ERα) et β (ERβ) appartenant à la famille des récepteurs nucléaires. Ils sont codés par deux gènes distincts chez l’homme. Les œstrogènes agissent sur leurs cellules/tissus cibles par l’intermédiaire de ces récepteurs suivant deux mécanismes distincts : (1) les effets génomiques, c’est-à-dire sur l’expression des gènes : après fixation des œstrogènes, les récepteurs se dimérisent et se fixent sur les séquences ERE (estrogen responsive element) localisées dans le promoteur des gènes cibles, activant ainsi la transcription de ces gènes et déclenchant une réponse soit de prolifération cellulaire, soit de différenciation sexuelle ; (2) les effets non génomiques qui concernent directement d’autres acteurs moléculaires dans les cellules, principalement des protéines. B. Similarités structurales (groupements phényls et hydroxyls en particulier) entre l’hormone sexuelle œstradiol et l’entérolactone, lui permettant de se lier aux récepteurs d’œstrogènes. On qualifie alors ces entérolignanes de SERM (specific estrogen receptor modulators). C. Mécanismes de modulation de l’activité de l’œstrogène. Les entérolignanes (exemple : entérolactone) peuvent se fixer sur les récepteurs d’œstrogènes et moduler la response œstrogénique. Cette réponse dépendra de la nature et des concentrations respectives du phyto-œstrogène et de l’œstrogène. Ils peuvent agir comme agonistes (simulent une fixation d’œstrogène) ou bien comme antagonistes (empêchent la fixation de l’œstrogène et inhibent donc son action médiée par la fixation au récepteur). La réponse variera avec les organes et les cellules en fonction des types de récepteurs œstrogéniques (les affinités des SERM sont différentes selon le récepteur) et de la présence d’activateurs (Act) et ou d’inhibiteurs (Rep) de transcription. Un même phyto-œstrogène peut donc avoir selon les organes, voire les tissus, un effet simulant ou au contraire contrariant l’effet de l’œstrogène naturel. Les phytoœstrogènes peuvent également agir en modulant la biosynthèse (inhibition de l’activité de l’aromatase) et l’activation (la sulfatation générant une forme inactive) des œstrogènes, ainsi qu’en modulant les teneurs en œstrogènes libres (en régulant la synthèse de SHBG, protéine se liant aux hormones sexuelles). |
On peut alors comprendre l’effet particulier observé chez des femelles de mammifères prépubères ou ménopausées dont le taux d’œstrogènes endogènes est très bas. Une variabilité des effets est observée en fonction des organes cibles (centraux ou périphériques) et de la nature des récepteurs (ERα ou ERβ). Les affinités des SERM sont différentes selon le récepteur, par exemple les PE de légumineuses présentent une affinité plus grande pour les récepteurs ERβ. La fixation du PE sur un couple de récepteur peut entraîner le recrutement d’activateurs ou d’inhibiteurs, et ceci de façon différente par rapport à l’œstradiol. Toutes les cellules ne contiennent pas non plus les mêmes activateurs et inhibiteurs de transcription. Un même PE peut donc se comporter selon les organes, voire les tissus, comme agoniste ou antagoniste de l’œstrogène naturel. Par ailleurs, les PE interviennent dans la biosynthèse des œstrogènes, en inhibant l’activité de l’aromatase impliquée spécifiquement dans la synthèse de ces hormones (Figure 3C), et en diminuant ainsi le taux d’œstradiol [
6], y compris dans des cellules cancéreuses MCF-7 ER+ [
7]. De plus, il y a interférence avec les étapes de conversion de l’œstradiol en d’autres formes de l’hormone, actives ou inactives (sulfatation de l’œstradiol, liaison à une protéine spécifique, SHBG) (Figure 3C) [
8,
9]. Le rapport forme active/forme inactive se trouve ainsi modifié. Autres actions des lignanes indépendantes des propriétés phyto-œstrogènes Outre les propriétés phyto-œstrogènes des entérolignanes, des effets anti-prolifératifs et pro-apoptotiques ont également été rapportés [
10,
11]. Ainsi, Thompson et al. [
12] ont observé une diminution de la prolifération des tumeurs mammaires, associée à une baisse de l’expression de l’oncogène c-erB-2 et à une augmentation de l’apoptose chez des femmes ménopausées recevant une ration quotidienne de 25 g de graines de lin. Danbara et al. [
13] ont montré que l’entérolactone inhibait la croissance de cellules du cancer du côlon chez l’homme et induisait leur apoptose, in vitro et in vivo. La capacité de l’entérodiol et de l’entérolactone à empêcher la multiplication de métastases a également été évaluée in vitro. Magee et al. [
14] n’ont pas observé d’effet anti-invasif des entérolignanes dérivés des lignanes du lin dans le modèle des cellules MDA-MB-231 (ER- indépendante des œstrogènes) cultivées dans du Matrigel, contrairement à ce qui est observé avec des isoflavones phyto-œstrogènes comme la génistéine et la daidzeine. Chen et Thompson [
15], utilisant un modèle expérimental similaire, ont confirmé ce résultat et noté un effet anti-invasif faible de l’entérolactone, voire nul de l’entérodiol, sur la lignée MDA-MB-231, alors qu’il est notable sur une lignée métastatique, MDA-MB-435 (ER-). Parfois, l’action antitumorale des PE semble pouvoir être corrélée à des effets inhibiteurs de l’angiogenèse, et, chez la souris, une inhibition par l’entérodiol et l’entérolactone de l’angiogenèse associée à des tumeurs MCF-7 œstrogène-dépendantes a été décrite. Cette inhibition était associée à une baisse de sécrétion du facteur de croissance de l’endothélium vasculaire (VEGF) [
16]. Enfin, les lignanes du lin et leurs dérivés circulants ont montré in vitro une efficacité anti-oxydante élevée, évaluée en mesurant la protection de l’acide linoléique contre la peroxydation ou celle d’ADN lors de réactions de Fenton1 [
17,
18]. Ce pouvoir permettrait de lutter contre les radicaux libres dont on pense qu’ils favorisent l’apparition de tumeurs comme celles du côlon. Il n’est pas exclu que plusieurs des mécanismes décrits précédemment agissent de concert, permettant par exemple de prévenir l’apparition des cancers liés aux dégâts oxydatifs, mais aussi leur développement, en réduisant la stimulation œstrogénique et l’angiogenèse et en stimulant l’apoptose cellulaire. |
Les lignanes cytotoxiques : la podophyllotoxine et ses dérivés Étoposide et téniposide en chimiothérapie anti-cancéreuse La podophyllotoxine (PTOX, Figure 1C) est utilisée depuis longtemps pour ses propriétés médicinales. Ce lignane est synthétisé dans la plante à partir du matairésinol selon une voie métabolique complexe, dont seules certaines étapes ont été élucidées. Les sources de PTOX commercialement exploitables par l’industrie pharmaceutique sont peu nombreuses : il s’agit de Podophyllum hexandrum et Podophyllum peltatum
(Figure 2D), appartenant à la famille des Berberidacées, et localisées respectivement en Himalaya et dans les forêts humides d’Amérique du Nord. Des études cliniques ont montré que la PTOX, à la manière de la colchicine, provoquait la mort cellulaire en arrêtant la mitose en métaphase (Figure 4C). Cette propriété antimitotique est liée à sa capacité à inhiber la polymérisation de la tubuline et donc la formation des microtubules, en se combinant à la tubuline β sur le site d’interaction avec la colchicine [
19] (Figure 4A). Toutefois, la très grande toxicité de la PTOX ne permet pas son utilisation directe comme anticancéreux. Elle est cependant utilisée par voie externe pour le traitement des condylomes.
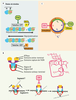 | Figure 4.
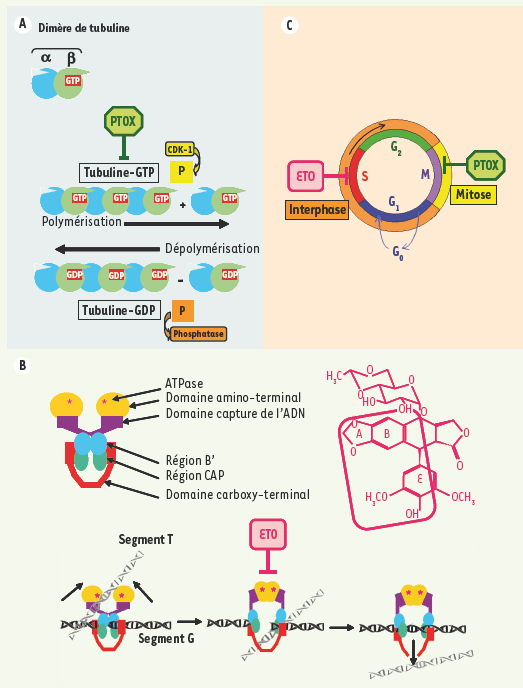
Mécanismes d’action de la podophyllotoxine et de son dérivé semi-synthétique, l’étoposide. A. La PTOX possède la capacité d’inhiber la prolifération cellulaire et de provoquer la mort cellulaire par apoptose en arrêtant la mitose en métaphase. Les microtubules sont constitués de protofilaments résultant de l’assemblage d’un hétérodimère formé des chaînes α et β de tubuline. Ce dimère de tubuline possède un site de liaison avec le GTP (en rouge). La polymérisation de la tubuline, GTP-dépendante, fait intervenir la protéine kinase CDK-1 ( cyclin-dependent kinase-1). Des phosphatases assurent la dépolymérisation. L’effet antimitotique de la PTOX est le résultat de sa fixation sur le dimère de tubuline (sur le même site que la colchicine) qui provoque l’inhibition de la polymérisation de la tubuline et donc de l’assemblage des microtubules. B. L’étoposide (ETO), dérivé semi-synthétique de la PTOX, n’affecte pas l’assemblage des microtubules mais bloque le cycle cellulaire au niveau de la phase de synthèse (phase S). Il agit comme inhibiteur spécifique de la topo-isomérase II. Cette enzyme homodimérique contrôlant le degré de sur-enroulement de l’ADN effectue des coupures double-brin transitoires. Elle possède différents domaines : les domaines amino-terminaux possédant une activité ATPasique (en orange ; les sites de fixation de l’ATP sont représentés par un astérisque rouge) ; les domaines de capture de l’ADN (en violet) ; les régions B’ importantes pour la fixation du segment G d’ADN ; les régions CAP qui contiennent les deux tyrosines du site actif de l’enzyme ; et les domaines carboxy-terminaux qui contiennent d’autres résidus importants pour la catalyse et permettent, avec les régions CAP, le passage du segment T d’ADN. La catalyse débute par la capture puis la fixation de l’ADN (segment G). Puis en présence de cations divalents un équilibre coupure/ligation va s’établir. La coupure s’effectue par trans-estérification et fait intervenir les deux résidus tyrosine du site actif. Elle aboutit à la formation d’une liaison covalente (liaison phospho-tyrosyle) entre l’extrémité 5’ du fragment d’ADN et l’enzyme. La fixation de deux molécules d’ATP au niveau des domaines amino-terminaux provoque un changement de conformation de l’enzyme permettant le passage du segment T à travers la coupure du brin G. À la suite de cette translocation, la religation du segment G se produit puis l’hydrolyse de l’ATP va permettre le relargage de l’ADN et le retour de l’enzyme à sa conformation initiale. L’étoposide modifie l’activité de la TopII en se fixant par l’intermédiaire de liaisons faibles dans le domaine de fixation de l’ATP et en interagissant avec le site actif, ce qui a pour conséquence de stabiliser la coupure double brin de l’ADN et d’inhiber le passage de l’autre brin d’ADN à travers la coupure. La partie de la molécule d’étoposide en interaction avec la TopII est encadrée en rose (d’après [
39]). C. Représentation schématique du cycle cellulaire et du niveau d’intervention de la PTOX et de l’ETO. Le cycle cellulaire, intervalle de temps séparant deux divisions, comporte quatre étapes : une phase G1 (gap1 ou growth phase 1) préparant à la synthèse de l’ADN, une phase de synthèse de l’ADN (phase S), une phase G2 (gap2 ou growth phase 2) qui prépare à la division cellulaire et une phase de division cellulaire (phase M ou mitose), les trois premières phases constituant l’interphase. Entre chacune de ces étapes, il existe des points de contrôle qui ont pour but de vérifier l’intégrité de l’ADN et qui autorisent la poursuite du cycle cellulaire ou envoient la cellule vers l’apoptose en cas de perte de l’intégrité cellulaire. Les cibles moléculaires de la PTOX et de l’étoposide sont différentes et ils agissent également à deux niveaux différents du cycle cellulaire. La PTOX bloque les cellules au niveau de la mitose alors que l’étoposide intervient au moment de la phase de synthèse. |
En revanche, la PTOX sert à la préparation de glycosides hémisynthétiques, téniposide et étoposide (Figure 1C) aujourd’hui largement utilisés comme cytotoxiques anticancéreux [
20]. L’étoposide est délivré en polythérapie en association avec d’autres produits anticancéreux et en particulier les dérivés du platine comme le cisplatine ou le carboplatine : il fait partie du traitement de référence de certains cancers comme ceux du poumon à petites cellules depuis les années 1980 [
21,
22]. Parmi les autres cancers traités par cette association, on peut citer également les tumeurs embryonnaires, les neuroblastomes, les cancers du rein, du sein, de la prostate, ainsi que les lymphomes hodgkiniens ou non hodgkiniens et les leucémies aiguës. Bien que constituant une partie du traitement de référence, l’étoposide et le téniposide ne sont pas sans inconvénients, dont certains sont communs à toutes les drogues cytotoxiques comme la toxicité hématologique, ou encore le développement de résistances [22]. De plus, probablement en raison de sa capacité à provoquer des dommages à l’ADN (en particulier des réarrangements dans le gène MLL) [
23], l’étoposide peut aussi induire des leucémies secondaires, voire des leucémies infantiles suite à une exposition in utero, lorsque les doses cumulées totales dépassent 2 000 mg/m2 [
24] (les doses quotidiennes habituellement délivrées sont d’environ 100 mg/m2, par exemple en traitement de trois jours). Les cytotoxiques dérivés de la PTOX présentent l’intérêt de provoquer peu de vomissements et d’irritations (la forme téniposide peut entraîner plus fréquemment des irritations), et leur effet alopéciant est modéré. L’étoposide-base est administrable per os, ce qui en soi constitue un avantage, mais son absence d’hydrosolubilité (et celle du téniposide) nécessite l’utilisation de solvants non aqueux si son administration intraveineuse est envisagée. Il s’agit classiquement d’alcool benzylique ou éthylique, excipients entraînant des effets notoires, d’où une administration en perfusion lente. La solubilité de l’étoposide phosphate (Etopophos®) est améliorée par la présence de groupements fonctionnels phosphates, ce qui permet la reconstitution du médicament dans de l’eau ppi, une solution de glucose à 5 % ou de NaCl à 0,9 % ; dans ce dernier cas, la durée de perfusion peut être réduite [
25]. Mécanisme d’action des dérivés de la PTOX L’action cytotoxique des dérivés de la PTOX est liée à leur faculté de provoquer l’apoptose des cellules, le mode d’action le plus connu (mais peut être pas le seul) s’expliquant par une interaction de ces molécules avec la topo-isomérase II (TopII) [
26]. La glycosylation qui distingue l’étoposide de la PTOX empêche ce dérivé d’interagir avec la tubuline. La TopII, dont il existe deux isoformes chez l’homme, joue un rôle fondamental en contrôlant la topologie de l’ADN lors de nombreuses étapes du cycle cellulaire (réplication, ségrégation des chromosomes) ou encore lors de la transcription [
27,
28]. TopIIa intervient dans la réplication et la ségrégation des chromosomes, alors que TopIIβ semble impliquée dans la transcription [
29]. Les TopII humaines sont des homodimères composés de trois domaines (Figure 4B) : un domaine amino-terminal possédant une activité ATPasique, un domaine catalytique central contenant le résidu tyrosine dont le groupement hydroxyle permet la formation du complexe ADN-TopII ainsi que les réactions de trans-estérification impliquées dans le processus de coupure et religation de l’ADN, et un domaine carboxy-terminal contenant le signal de localisation nucléaire (NLS). La TopII est capable de catalyser des coupures transitoires d’un ADN double brin afin de modifier le niveau de super-enroulement de l’ADN. Le mécanisme réactionnel (Figure 4B) implique la fixation puis la coupure transitoire d’un segment d’ADN double brin (segment G), puis le transport à travers cette coupure d’un autre ADN double brin (segment T) et enfin la religation du segment G permettant ainsi de relaxer une structure super-enroulée. Ces coupures double brin permettent également la ségrégation des chromosomes au cours de la mitose. Pour catalyser cette réaction, la TopII nécessite deux co-facteurs le magnésium et l’ATP. L’étoposide ne possède qu’une faible affinité pour l’ADN, et se fixerait au niveau du site de fixation de l’ATP amino-terminal et/ou au niveau du site catalytique, empêchant ainsi la fixation de l’ATP et donc le changement de conformation qui permet le passage du segment T à travers la coupure [
30]. L’étoposide n’inhibe pas les fonctions catalytiques de la TopII, mais il augmente le nombre de coupures double brin catalysées par cette enzyme sur l’ADN dans les cellules en prolifération. En effet, le complexe covalent TopII-ADN est normalement très transitoire mais des composés comme l’étoposide vont le stabiliser, le rendant alors nocif pour la cellule [
31]. Le taux de religation est diminué (de façon dose-dépendante), ce qui provoque l’accumulation de coupures double brin, responsables d’instabilité génomique dans les cellules en cours de division. Les altérations de la structure de l’ADN sont alors détectées (via l’activation de la kinase ATM, responsable de la réponse aux dommages subis par l’ADN), ce qui va provoquer l’intervention de la forme activée de la protéine suppressive de tumeur p53, conduisant à l’arrêt du cycle cellulaire (en G2) et/ou à l’apoptose [23]. L’emballement des divisions des cellules cancéreuses est ainsi stoppé, d’où le bénéfice thérapeutique. L’angiogenèse est également inhibée par l’action de la protéine p53 freinant indirectement le développement des tumeurs. L’hypoxie pouvant exister au cœur des tumeurs solides peut inhiber l’effet de l’étoposide et expliquer certains des cas de résistance à ce composé. In vitro, cette inhibition par l’hypoxie est observée dans des cellules d’hépatocarcinome Hep G2, mais l’effet inverse est constaté avec des cellules tumorales mammaires MCF7 (deux lignées avec p53 non mutée) [
32]. Pour que l’étoposide soit efficace, la présence de la protéine p53 semble donc indispensable, or une proportion importante des cancers (environ la moitié des cancers bronchiques) présente une mutation dans le gène de la protéine p53 ou de l’une de ses protéines régulatrices comme p14ARF, ce qui devrait compromettre l’efficacité de ce composé. Cependant, l’étoposide peut également avoir une action même en cas de mutations touchant les gènes codant pour les protéines ATM, p14ARF ou p53. Dans le cas d’une mutation de la protéine ATM, cela s’explique par l’existence d’une autre voie : l’intervention de la kinase ATR, permettant de maintenir un haut niveau d’activité de la protéine p53, ayant pour conséquence la stimulation d’expression d’autres gènes impliqués dans l’apoptose. Mais manifestement la voie faisant intervenir la protéine p53 n’est pas la seule impliquée dans l’effet pro-apoptotique de l’étoposide. En effet, Clifford et al. [
33] ont constaté que ce composé était capable de provoquer l’arrêt du cycle cellulaire en G2 même chez des cellules HT1080 ayant une forme mutante négative dominante de p53. Bjorling-Poulsen et Issinger [
34], pour leur part, ont observé que l’étoposide inhibait l’expression de plusieurs gènes régulant le cycle cellulaire chez une lignée cellulaire HL-60 (leucémie) présentant aussi un gène p53 muté. Résistances à l’étoposide et nouveaux composés Les résistances au traitement par l’étoposide sont de toute évidence multifactorielles et peuvent résulter notamment de mutations affectant la TopII. Par exemple, une mutation de la TopII dans le domaine ATPasique empêche la fixation de l’étoposide [
35] ; une mutation du signal de localisation nucléaire de la TopII, conduit à une localisation erronée de l’enzyme dans le cytosol, qui intercepte l’étoposide dans le cytosol empêchant son passage dans le noyau, et provoque ainsi la résistance [ 35]. Les résistances peuvent aussi résulter d’un efflux actif s’opposant à l’accumulation de l’étoposide dans la cellule tumorale, et faisant intervenir des transporteurs de type ABC ( ATP binding cassette) [
36]. Depuis plus de dix ans, de nouvelles molécules proches de l’étoposide et dérivées de la PTOX sont produites et testées. Plusieurs objectifs sont poursuivis, notamment améliorer la solubilité en milieu aqueux, la demi-vie ou la disponibilité dans la cellule, mais surtout augmenter l’efficacité cytotoxique et échapper aux résistances (dues par exemple à un efflux par des transporteurs de la famille ABC). Une meilleure sélectivité peut aussi être recherchée. Ainsi Castro et al. [
37] ont synthétisé à partir de PTOX un composé actif in vitro contre des cellules de carcinome du côlon. Une autre démarche vise à produire des composés de structure plus simple, efficaces en mélange racémique et pouvant donc être synthétisés facilement, cela est délicat car il semble que la stéreochimie du carbone 9 soit importante pour l’activité biologique. Toutefois Magedov et al. [
38] relatent l’obtention de composés racémiques capables d’induire l’apoptose de cellules de lymphome (lignée Jurkat). La compréhension des mécanismes moléculaires sous-jacents à l’interaction étoposide-TopoII et aux résistances a permis de définir des axes pour le développement de nouveaux dérivés. Les modifications portent essentiellement sur les substituants du noyau E, qui déterminent l’interaction avec la TopIIa et les substituants du C4 du noyau C qui influencent plutôt la disponibilité cellulaire [39]. Certains composés tels que le TOP-53 et le GL-331 (Figure 1C) font actuellement l’objet de tests cliniques [
40]. Les travaux récents d’Azarova et al. [29] ont démontré que les leucémies secondaires aigües induites par l’étoposide impliquaient préférentiellement la formation de complexes avec l’isoforme TopIIβ alors que les complexes conduisant à l’inhibition de la TopIIα avaient un effet cytotoxique et donc curatif. Ces résultats témoignent de la nécessité de développer à l’avenir des molécules ciblant spécifiquement l’isoforme TopIIα. Le défi posé par l’appauvrissement des sources de PTOX L’utilisation accrue des drogues dérivées de la PTOX en chimiothérapie pose le problème de l’approvisionnement en PTOX. Podophyllum hexandrum, qui fait l’objet d’une cueillette intensive excédant ses capacités de régénération naturelle apparaît désormais sur l’appendice II du CITES ( convention for international trade in endangered species) répertoriant les espèces menacées de disparition. Par conséquent le commerce de ces plantes est étroitement contrôlé ( World conservation monitoring centre, 2001). Il est très difficile d’envisager la culture de cette plante à cause de sa longue phase juvénile, de sa pauvre capacité à faire des fruits et de la longue période de germination de ses graines. Le Podophyllum américain, certes moins menacé, renferme quant à lui trois fois moins de PTOX. Son utilisation pour l’extraction de la PTOX ne constitue donc qu’une alternative à moyen terme. D’autre part, bien que techniquement possible [
41], la synthèse chimique de la PTOX est largement entravée par des problèmes de fermeture stéréochimique du noyau aromatique et ne peut fournir cette molécule qu’à des coûts prohibitifs. Ce problème d’approvisionnement est à l’origine d’une recherche active de sources alternatives de PTOX. Depuis le début des années 1990, de nombreux travaux témoignent de la volonté des chercheurs de mettre au point des systèmes biologiques confinés in vitro (racines transgéniques, cultures cellulaires provenant de Podophyllum ou d’autres genres tels Hyptis, Anthriscus, Juniperus ou Dysosma) produisant de la PTOX ou ses dérivés [
42]. Dans cette optique, le genre Linum apparaît comme un bon modèle pour la poursuite des études sur les lignanes. En effet, des lins sauvages tels que Linum album ou Linum flavum
(Figure 2) accumulent respectivement de la PTOX et de la 6-méthoxy-PTOX [
43]. La voie du génie génétique, qui nécessite le clonage des gènes codant les enzymes limitantes de cette voie métabolique, couplée à des méthodes de supplémentation en précurseurs simples pourrait également offrir de nouvelles perspectives. |
Les auteurs remercient le Conseil Général d’Eure et Loir et la Ligue contre le Cancer pour leur soutien financier.
|
Footnotes |
1. Smeds AI, Eklund PC, Sjöholm RE, et al. Quantification of a broad spectrum of lignans in cereals, oilseeds, and nuts. J Agric Food Chem 2007; 55 : 1337–46. 2. Hall C III, Tulbek M, Xu, Y. Flaxseed. Adv Food Nutr Res 2006; 51 : 1–97. 3. Lainé E, Hano C, Lamblin F. Les lignanes phyto-œstrogènes du lin sont ils des bienfaiteurs méconnus ? Phytothérapie 2007; 5 : 121–8. 4. Cho JY, Kim AR, Yoo ES, et al. Immunomodulatory effect of arctigenin, a lignan compound, on tumour necrosis factor-a and nitric oxide production and lymphocyte proliferation. J Pharm Pharmacol 1999; 51 : 1267–73. 5. Adlercreutz H. Phyto-œstrogens and cancer. Lancet Oncology 2002; 6 : 364–73. 6. Adlercreutz H, Bannwart C, Wahala K, et al. Inhibition of human aromatase by mammalian lignans and isoflavonoid phytoestrogens. J Steroid Biochem Mol Biol 1993; 44 : 147–53. 7. Brooks JD, Thompson LU. Mammalian lignans and genistein decrease the activities of aromatase and 17beta-hydroxysteroid dehydrogenase in MCF-7 cells. J Steroid Biochem Mol Biol 2005; 94 : 461–7. 8. Martin ME, Haourigui M, Pelissero C, et al. Interactions between phytœstrogens and human sex steroid binding protein. Life Sci 1996; 58 : 429–36. 9. Schottner M, Spiteller G. Lignans interfering with 5alpha-dihydrotestosterone binding to human sex hormone-binding globulin. J Nat Prod 1998; 61 : 119–21. 10. Li D, Yee JA, Thompson LU, Yan L. Dietary supplementation with secoisolariciresinol diglycoside (SDG) reduces experimental metastasis of melanoma cells in mice. Cancer Lett 1999; 142 : 91–6. 11. Bylund A, Saarinen N, Zhang JX, et al. Anticancer effects of a plant lignan 7-hydroxymatairesinol on a prostate cancer model in vivo. Exp Biol Med (Maywood) 2005; 230 : 217–23. 12. Thompson LU, Chen JM, Li T, et al. Dietary flaxseed alters tumor biological markers in postmenopausal breast cancer. Clin Cancer Res 2005; 11 : 3828–35. 13. Danbara N, Yuri T, Tsujita-Kyutoku M, et al. Enterolactone induces apoptosis and inhibits growth of Colo 201 human colon cancer cells both in vitro and in vivo. Anticancer Res 2005; 25 : 2269–76. 14. Magee PJ, McGlynn H, Rowland. Differential effects of isoflavones and lignans on invasiveness of MDA-MB-231 breast cancer cells in vitro. Cancer Lett 2004; 208 : 35–41. 15. Chen J, Thompson LU. Lignans and tamoxifen, alone or in combination, reduce human breast cancer cell adhesion, invasion, and migration in vitro. Br Can Res Treat 2003; 80 : 163–70. 16. Bergman Jungestrom M, Thompson LU, Dabrosin C. Flaxseed and its lignans inhibit estradiol-induced growth, angiogenesis, and secretion of vascular endothelial growth factor in human breast cancer xenografts in vivo. Clin Cancer Res 2007; 13 : 1061–7. 17. Prasad K. Hydroxyl radical-scavenging property of secoisolariciresinol diglucoside (SDG) isolated from flax-seed. Mol Cell Biochem 1997; 168 : 117–23. 18. Kitts DD, Yuan YV, Wijewickreme AN, Thompson LU. Antioxidant activity of the flaxseed lignan secoisolariciresinol diglycoside and its mammalian lignan metabolites enterodiol and enterolactone. Mol Cell Biochem 1999; 202 : 91–100. 19. Imbert F. Discovery of podophyllotoxin. Biochimie 1998; 80 : 207–22. 20. Canel C, Moraes RM, Dayan FE, Ferreira D. Podophyllotoxin. Phytochemistry 2000; 54 : 115–20. 21. El Maalouf G, Rodier JM, Faivre S, Raymond E. Could we expect to improve survival in small cell lung cancer ? Lung Cancer 2007; 57 : 30–4. 22. Lally BE, Urbanic JJ, Blackstock AW, et al. Small cell lung cancer : have we made any progress over the last 25 years ? The Oncologist 2007; 12 : 1096–104. 23. Sung PA, Libura J, Richardson C. Etoposide and illegitimate DNA double-strand break repair in the generation of MLL translocations : new insights and new questions. DNA Repair 2006; 5 : 1109–18. 24. Guenfoudi-Roullaud MP, Menat C, Girard F, et al. Etoposide et risque leucémogène. J Pharm Clin 1998; 17 : 71–3. 25. Schacter L. Etoposide phosphate : what, why, where, and how ? Semin Oncol 1996; 23 : 1–7. 26. Hande K. Topoisomerase II inhibitors. Update Cancer Ther 2006; 1 : 3–15. 27. Champoux JJ. DNA topoisomerases : structure, function, and mechanism. Annu Rev Biochem 2001; 70 : 369–413. 28. Wang JC. Cellular roles of DNA topoisomerases : a molecular perspective. Nat Rev Mol Cell Biol 2002; 3 : 430–40. 29. Azarova AM, Lyu YL, Lin CP, et al. Roles of DNA topoisomerase II isozymes in chemotherapy and secondary malignancies. Proc Natl Acad Sci USA 2007; 104 : 11014–9. 30. Leroy D, Kajava AV, Frei C, Gasser SM. Analysis of etoposide binding to subdomains of human DNA topoisomerase II alpha in the absence of DNA. Biochemistry 2001; 40 : 1624–34. 31. Montecucco A, Biamonti G. Cellular response to etoposide treatment. Cancer Lett 2007; 252 : 9–18. 32. Cosse JP, Sermeus A, Vannuvel K, et al. Differential effects of hypoxia on etoposide induced apoptosis according to the cancer lines. Mol Cancer 2007; 6 : 61. 33. Clifford B, Beljin M, Stark GR, Taylor WR. G2 arrest in response to topoisomerase II inhibitors the Role of p53. Cancer Res 2003; 63 : 4074–81. 34. Bjørling-Poulsen M, Issinger OG. CDNA array analysis of alterations in gene expression in the promyelocytic leukemia cell line, HL-60, after apoptosis induction with etoposide. Apoptosis 2003; 8 : 377–88. 35. Okada Y, Tosaka A, Nimura Y, et al. Atypical multidrug resistance may be associated with catalytically active mutants of human DNA topoisomerase II alpha. Gene 2001; 272 : 141–8. 36. Gillet JP, Efferth T, Remacle J. Chemotherapy-induced resistance by ATP-binding cassette transporter genes. Biochim Biophys Acta 2007; 1775 : 237–62. 37. Castro MA, Miguel del Corral JM, Gordaliza M, et al. Synthesis and biological evaluation of new selective cytotoxic cyclolignans derived from podophyllotoxin J Med Chem 2004; 47 : 1214–22. 38. Magedov IV, Manpadi M, Van Slambrouck S, et al. Discovery and investigation of antiproliferative and apoptosis-inducing properties of new heterocyclic podophyllotoxin analogues accessible by a one-step multicomponent synthesis. J Med Chem 2007; 50 : 5183–92. 39. Wiltermann AM, Bender RP, Godfrey M, et al. Topoisomerase II-drug inteaction domains : identification of substituents on etoposide that interact with the enzyme. Biochemistry 2007; 46 : 8217–25. 40. Zhang FM, Yao XJ, Tu YQ. Synthesis and biological evaluation of new 4β-5-Fu-substituted 4’-demethylepipodophyllotoxin derivatives. Molecules 2006; 11 : 849–57. 41. Medarde M, Ramos AC, Caballero E, et al. A New approach to the synthesis of podophyllotoxin based on epimerization reactions. Tetrahedron Lett 1996; 37 : 2663–66. 42. Farkya S, Bisaria VS, Srivastava AK. Biotechnological aspects of the production of the anticancer drug podophyllotoxin. Appl Microbiol Biotechnol 2004; 65 : 504–19 43. Gordaliza M, García PA, Miguel del Corral JM, Castro MA, Gómez-Zurita MA. Podophyllotoxin : distribution, sources, applications and new cytotoxic derivatives Toxicon 2004; 44 : 441–59 |