| |
| Med Sci (Paris). 2008 May; 24(5): 525–528. Published online 2008 May 15. doi: 10.1051/medsci/2008245525.Les IKDC Cellules dendritiques tueuses ou cellules NK présentatrices d’antigènes ? Laurence Zitvogel,1,2,3,4* Grégoire Mignot,1,2 Mathieu Bonmort,1,2 Evelyn Ullrich,1 and Nathalie Chaput1,3 1Inserm, U805, Villejuif, France 2Université Paris-Sud, Le Kremlin-Bicêtre, France 3Centre d’Investigations Cliniques CBT507, Villejuif, France 4Institut Gustave Roussy, 39, rue Camille Desmoulins, 94805 Villejuif Cedex, France MeSH keywords: Cellules présentatrices d'antigène, Cellules dendritiques, Humains, Interleukine-15, Cellules tueuses naturelles, Lymphocytes T cytotoxiques |
L’article de Laure Coulombel et Armand Bensussan « IKDC, un nouveau costume pour les cellules NK activées » (page 521 de ce numéro) a été adressé au
Pr Laurence Zitvogel, et nous publions ci-dessous le
texte qui constitue sa réponse.
Les cellules de l’immunité, comme celles du système hématopoïétique, sont habituellement et de façon courante définies « phénotypiquement » par une association de marqueurs, ces marqueurs concourant à la caractérisation de leur lignage ou précurseur d’origine, de leurs fonctions (parfois dictées par un facteur de transcription) ou de leur topographie dictant une régulation phénotypique et fonctionnelle particulière. L’immunologie moderne a permis la définition de nouvelles sous-populations cellulaires appartenant à une catégorie d’origine, ces sous-populations s’étant singularisées par leurs fonctions distinctes. |
La confusion marqueur/fonction Prenons l’exemple des lymphocytes T régulateurs puis celui des cellules dendritiques. L’exemple des lymphocytes T régulateurs Les lymphocytes T régulateurs naturels (Treg), définis initialement par des marqueurs non spécifiques CD3 +CD4 +CD25 +, se sont révélés être « naturellement » CD25 fort (distinguables des autres T activés exprimant CD25 de façon intermédiaire ou faible) et doués d’une fonction suppressive [
1]. Ce n’est qu’en 2003 qu’un marqueur spécifique fut décrit, le facteur de transcription Foxp3 [
2], dictant leur fonction suppressive [
3]. Pourtant, ces mêmes cellules Treg existent à l’état basal, et peuvent aussi être inductibles à partir de cellules T conventionnelles dans certaines circonstances d’activation [
4]. Il s’agit ici d’un exemple où une même fonction T inhibitrice peut exister spontanément/naturellement à l’état basal dans une cellule A ou être induite à partir d’une cellule B dans un contexte d’activation. Récemment, il a été démontré que l’expression de Foxp3 pouvait dans certains cas ne pas être reliée à une fonction suppressive [
5]. En effet, Foxp3 peut être exprimé dans les cellules T effectrices activées qui ne montrent aucune fonction suppressive. Ainsi la dénomination de lymphocytes régulateurs fondée uniquement sur le phénotype n’est plus correcte et seule la fonction suppressive associée à un phénotype permet de statuer. L’exemple des cellules dendritiques Le second exemple correspond à une même cellule dont l’activité fonctionnelle est sous la dépendance des signaux environnementaux. La versatilité ou plasticité fonctionnelle d’une même cellule est peu typique mais c’est une propriété originale des cellules dendritiques (CD). En effet, les CD peuvent exister à l’état immature (où elles exercent une activité phagocytique) ou à l’état mature (où elles présentent l’antigène), la transition entre les deux états étant provoquée par des signaux inflammatoires [cytokines, PGE2 (prostaglandine E2), ligands des TLR (Toll-like receptors)], chaque état étant identifiable par des marqueurs phénotypiques spécifiques [
6,
7]. Les CD offrent un élément de complexité supplémentaire. Leur phénotype est aussi dicté par le tissu où elles résident. Ainsi, les CD de l’épiderme sont-elles appelées « cellules de Langerhans » dont les fonctions seraient davantage de transférer un « cargo phagocytique » (transport d’antigènes de la peau phagocytés) aux ganglions, que de directement opérer la fonction de présentation des antigènes. En revanche, les CD dermiques seraient capables d’initialiser des réponses B et T à partir de lymphocytes naïfs après migration dans la zone riche en T du ganglion drainant le derme siège d’inflammation. À noter qu’au sein même des ganglions murins, une sous-population de CD (exprimant le marqueur spécifique DEC205) venant du sang par les veinules à endothélium épais (HEV, high endothelial venules) est spécialisée dans la présentation croisée des antigènes dans la voie des molécules du complexe majeur d’histocompatibilité (CMH) de classe I [
8]. En résumé, les CD de l’épiderme, du derme et résidentes des ganglions n’ont pas les mêmes fonctions, bien que toutes soient dénommées « dendritiques » car exprimant le CD11c et les molécules du CMH de classe II fortement à l’état basal. Prenons encore l’exemple des cellules dendritiques plasmacytoïdes, décrites à l’origine comme des cellules produisant un facteur soluble pouvant interférer avec la croissance virale « viral interference », nommé interféron, les « Interferon producing cells » (IPC) [
9–
11] ; ces cellules furent ensuite nommées cellules dendritiques uniquement en raison de leur morphologie « cellule ébouriffée et voilée » et de leur expression des CMH de classe II [
12]. L’origine de ces cellules est très controversée (lymphoïde ou myéloïde [9]) et leur capacité à induire une réponse immunitaire à partir de lymphocytes naïfs T CD4+ n’a été démontrée in vivo que très récemment, uniquement au niveau des ganglions et non de la rate des souris [
13]. Du fait de cette complexité et de cette plasticité, les experts du domaine reconnaissent qu’une bona fide CD a, indépendamment de son origine, des caractéristiques morphologiques spécifiques (richesse en CMH de classe II) et une capacité phagocytique et de présentation de l’antigène permettant d’initier des réponses T primaires. Cette définition est donc principalement fonctionnelle. Qu’en est-il des IKDC ? Les IKDC ont été décrites début 2006 comme exprimant à l’état basal le phénotype CD11cint B220+NK1.1+CD3- et exprimant les molécules du CMH de classe II sur le site de la tumeur chez la C57BL/6 [
14] et dans les ganglions des souris BALB/c infectées par la Listeria [
15]. Les IKDC troublent les esprits parce que les cellules natural killer (NK) murines n’étaient pas connues pour exprimer des molécules du CMH de classe II fonctionnelles (induisant une fonction de présentation antigénique) et qu’il était inattendu que les CD classiques murines exercent une activité lytique spontanée (sauf chez le rat ou après culture et induction par les IFN in vitro [
16]). |
Pourquoi s’intéresser aux IKDC ? Les IKDC sont apparentées aux lymphocytes NK conventionnels (car elles expriment CD122, NKG2D, NKp46 [
17–
19] et dépendent du facteur de transcription Id2 [
20], de l’IL-15 et de son récepteur IL-15Rα pour leur ontogénie [
21]) mais ont une origine de différenciation unique à partir d’un progéniteur lymphoïde c-kitfortCD62L+ [
22]. De plus, d’un point de vue fonctionnel, les IKDC se distinguent des NK conventionnels par au moins six éléments incontournables au plan expérimental :
-
Contrairement aux bona fide, lymphocytes NK murins (définis comme CD3-NK1.1+ NKp46+ CD11c± mais B220−), les IKDC prolifèrent de façon clonale en présence d’IL-15 trans-présentée par l’IL-15Rα sur une cellule stromale (IKDC15). Jusqu’à 20 % d’entre elles forment des colonies (expansion d’un facteur 1 000 en micro-puits) gardant leur phénotype originel. Il est donc possible de propager en culture les IKDC alors que les NK ne se divisent pas et survivent difficilement lorsqu’elles sont cultivées sur des cellules nourricières ex vivo [21].
-
Contrairement aux bona fide, lymphocytes NK murins, les IKDC tuent principalement par la voie TRAIL [TNF (tumor necrosis factor) related apoptosis inducing ligand] lorsqu’elles sont stimulées par trans-présentation de l’IL-15 in vitro [21], ou l’association Glivec® et IL-2 in vivo [14]. Dans les mêmes conditions, les NK classiques tuent leurs cibles principalement par la voie perforine/granzyme B [21]. La qualité de la lyse est donc différente et a des implications intéressantes sur l’immunogénicité de la mort des cibles tumorales [21].
-
Conséquence du mode de cytotoxicité évoqué ci-dessus, la réinjection de cellules de mélanome tuées par des IKDC activées engendre une protection antitumorale significative alors que ce n’est pas le cas après la réinjection de cellules de mélanome tuées par les NK conventionnelles. À noter que cet effet prophylactique antitumoral est conservé même en présence de la cytokine suppressive TGF (transforming growth factor)-β1 (alors que les fonctions NK sont affectées par cette cytokine) [21]. Ces données posent la question du rôle immunogène de la lyse par TRAIL dans ce modèle, question méritant une confirmation expérimentale.
-
Contrairement aux bona fide NK murins, les IKDC expriment le récepteur de chimiokine CCR2 (récepteur de CCL2/MCP-1) en réponse à la trans-présentation de l’IL-15. Elles peuvent donc répondre à CCL2 (produite au niveau du site tumoral ou par des IKDC ou des NK activées). Ainsi dans un modèle de souris déficientes pour CCL2, les IKDC ne s’accumulent plus dans les tumeurs traitées par Glivec® et IL-2 [
23].
-
Le transfert adoptif passif d’IKDC (ou de préparations enrichies en IKDC) dans des souris dépourvues d’effecteurs classiques (Rag−/− x il-2rγ
-/-
) et inoculées par le mélanome B16F10, entraîne un effet antitumoral très significatif qui n’est pas obtenu avec les NK B220- ni avec les CD plasmacytoïdes [14].
-
Par ailleurs, l’association thérapeutique efficace combinant le Glivec® et l’IL-2 permet l’amplification des IKDC in vivo (de façon dépendante du couple IL-15 et IL-15Rα) et leur accumulation aux sites tumoraux, alors que les lymphocytes NK sont peu affectés (en nombre et migration) par cette combinaison thérapeutique. Cette efficacité thérapeutique est dépendante des IFN (type II [14] et type I [23]) qui régulent positivement les niveaux de TRAIL sur les IKDC et provoquent un effet tumoricide dépendant de TRAIL in vivo. En résumé, la combinaison Glivec® et IL-2 permet de véhiculer, via les IKDC, le TRAIL membranaire aux sites tumoraux. C’est ce que les industriels espèrent faire dans les essais de Phase II à l’aide des anticorps monoclonaux anti-DR4 et des molécules TRAIL solubles (dont le ciblage in vivo paraît aléatoire).
|
Des fonctions présentatrices d’antigène pour les IKDC ? De façon intéressante, on s’aperçoit que les IKDC sont en plus forte proportion dans les compartiments de NK ganglionnaires (majoritairement CD27+ [
24]) que de NK spléniques (25 ± 5 % versus 10 ± 5 %). De plus, les IKDC des ganglions ont tendance à exposer les molécules du CMH II à leur membrane et, en parallèle, à diminuer les récepteurs de lyse NKG2D [15]. Les ganglions étant des sites clefs pour la régulation des réponses adaptatives, il est licite de penser que les IKDC pourraient jouer un rôle dans la présentation antigénique. Quelles sont donc les données publiées permettant d’asseoir cette hypothèse ? Rappelons qu’une cellule présentatrice d’antigène doit pouvoir endocyter ou phagocyter l’antigène, l’apprêter (digestion par une machinerie spécialisée impliquant des cathepsines), le présenter dans des molécules du CMH de classe II et/ou I en présence de molécules de costimulation (comme CD40, CD80, CD86 et les membres de la famille du TNF) et migrer par la lymphe ou le sang vers la zone riche en lymphocytes T des organes lymphoïdes secondaires par où les lymphocytes T naïfs transitent. Les IKDC répondent aux cellules tumorales en exposant leurs molécules du CMH de classe II à leur membrane, l’IFNγ autocrine jouant un rôle majeur dans cet effet [14,
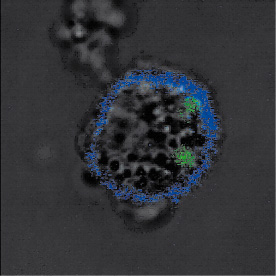
25]. Les IKDC ont apparemment la capacité de lyser les cellules de mélanome B16F10 et de phagocyter leurs victimes. La Figure 1 montre une IKDC après expansion de cette population ex vivo, contenant des cellules B16F10 marquées par le traceur CMFDA (5-chloromethylfluorescein diacetate) En présence de cellules tumorales, les IKDC pulsées par des protéines antigéniques, stimulent des lymphocytes T naïfs exprimant un récepteur T transgénique spécifique de l’antigène pulsé (modèle OT II ou D011.10 [15, 21]), bien que moins efficacement qu’une CD myéloïde. L’entrée en cycle de ces lymphocytes T CD4+ stimulés par les IKDC in vitro et l’exposition du CD69 à leur surface ont ainsi été rapportées. La migration des IKDC par la lymphe afférente au ganglion drainant le site injecté par les IKDC est opérationnelle puisque le transfert adoptif passif des cellules OTII s’accompagne de leur activation et de leur différenciation dans ce ganglion [25]. L’injection intraveineuse d’IKDC issues de ganglions dans une souris infectée par Listeria permet de visualiser leur localisation préférentielle dans les zones riches en lymphocytes T des ganglions et dans la pulpe rouge de la rate [15].  | Figure 1.
Morphologie en microscopie confocale d’une cellule IKDC (CD11c+- AlexaFluor 647, Bleu) activée par IL-15/IL-15Rα et ayant phagocyté des cellules de la lignée tumorale mourante B16F10 (CMFDA, Vert).
|
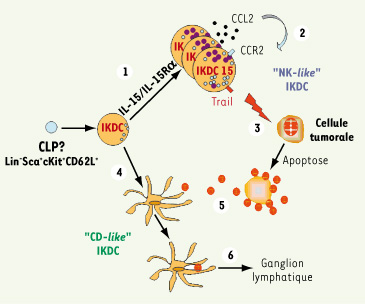
La présentation antigénique des IKDC est régulée. Les IKDC sont de meilleurs effecteurs lytiques en présence d’IL-15 (« NK-like » IKDC) mais elles perdent leur expression des molécules du CMH de classe II dans ces conditions ainsi que leur pouvoir d’activation des lymphocytes T naïfs in vitro et in vivo ([21]). L’injection des IKDC15 incubées en présence de leurs cibles ne permet pas de générer des réponses T contre les antigènes de ces cibles [21]. Pourtant, les cellules tumorales sont nécessaires aux IKDC naïves pour l’initialisation d’une réponse adaptative T CD4+ face à un antigène soluble. L’ensemble de ces résultats laisse penser que ces cellules sont probablement douées d’une exceptionnelle plasticité et capables de passer d’un état « CD-like » à un état « NK-like » (Figure 2).
 | Figure 2.
Schéma représentant la plasticité des IKDC dans un contexte tumoral. 1. Dans un site inflammatoire, sous la dépendance de l’IL-15/IL-15Rα, les IKDC prolifèrent, deviennent blastiques, accumulent des granules cytotoxiques et expriment CCR2 et TRAIL. 2. Les IKDC15 produisent également du CCL2 ce qui permet un recrutement des cellules du système immunitaire et un autorecrutement des IKDC. 3. Les IKDC15 sont capables d’induire l’apoptose des cellules tumorales essentiellement via TRAIL.4. Sous la dépendance de stimulus inconnus (ligands de TLR, tumeur ?), les IKDC peuvent exprimer des molécules du CMH de classe II et de costimulation. 5. Ces « CD-like » IKDC peuvent capter les antigènes tumoraux et les apprêter. 6. Les « CD-like » IKDC sont capables de migrer dans les organes lymphoïdes secondaires pour initier des réponses lymphocytaires T CD4+. CLP : common lymphoid progenitor.
|
|
Quelle nomenclature adopter de façon consensuelle pour ces cellules ? Les IKDC peuvent donc revêtir une plasticité phénotypique et fonctionnelle. À l’état basal, et dans les ganglions, ces cellules ont un profil transcriptionnel très proche de celui des NK classiques mais un potentiel de cellule présentatrice d’antigènes peut être induit dans certaines conditions de stimulation - tumeurs [14, 21] et TLR agonistes (données non publiées) - et elles revêtent alors un profil transcriptionnel plus proche de celui des CD conventionnelles (données non publiées). Après stimulation par l’IL-15, les IKDC régulent négativement leur présentation restreinte par les CMH II au niveau transcriptionnel et traductionnel [21] et deviennent cytolytiques. Les données accumulées au cours de ces deux dernières années nous orientent vers le fait que les IKDC représenteraient une sous-population de NK « à phénotype ganglionnaire ». Cependant, de grandes questions restent ouvertes. Quelles sont les formulations antigéniques absorbées par les IKDC (protéines ? tumeurs mourantes ? pathogènes ?) pour l’apprêtement ultérieur et par quel récepteur d’endo/phagocytose ? Quelle est la pertinence fonctionnelle et téléologique de l’existence de sous-populations de NK ganglionnaires dotées de cette potentialité ? Dans quelles circonstances physiopathologiques ont-elles un rôle clé ? Ces questions semblent stimuler de nombreuses équipes d’horizons divers et nul doute que les travaux en cours permettront de convaincre les jeunes esprits de l’intérêt des sous-populations NK résidentes des ganglions. |
1. Sakaguchi S, Sakaguchi N, Asano M, et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol 1995; 155 : 1151–64. 2. Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science 2003; 299 : 1057–61. 3. Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol 2003; 4 : 330–6. 4. Chen W, Jin W, Hardegen N, et al. Conversion of peripheral CD4+CD25- naive T cells to CD4+CD25+ regulatory T cells by TGF-beta induction of transcription factor Foxp3. J Exp Med 2003; 198 : 1875–86. 5. Allan SE, Crome SQ, Crellin NK, et al. Activation-induced FOXP3 in human T effector cells does not suppress proliferation or cytokine production. Int Immunol 2007; 19 : 345–54. 6. Ueno H, Klechevsky E, Morita R, et al. Dendritic cell subsets in health and disease. Immunol Rev 2007; 219 : 118–42. 7. Banchereau J, Palucka AK. Dendritic cells as therapeutic vaccines against cancer. Nat Rev Immunol 2005; 5 : 296–306. 8. Dudziak D, Kamphorst AO, Heidkamp GF, et al. Differential antigen processing by dendritic cell subsets in vivo. Science 2007; 315 : 107–11. 9. Fitzgerald-Bocarsly P, Dai J, Singh S. Plasmacytoid dendritic cells and type I IFN: 50 years of convergent history. Cytokine Growth Factor Rev 2008; 19 : 3–19. 10. Isaacs A, Lindenmann J. Virus interference. I. The interferon. Proc R Soc Lond B Biol Sci 1957; 147 : 258–67. 11. Isaacs A, Lindenmann J, Valentine RC. Virus interference. II. Some properties of interferon. Proc R Soc Lond B Biol Sci 1957; 147 : 268–73. 12. Ferbas JJ, Toso JF, Logar AJ, et al. CD4+ blood dendritic cells are potent producers of IFN-alpha in response to in vitro HIV-1 infection. J Immunol 1994; 152 : 4649–62. 13. Sapoznikov A, Fischer JA, Zaft T, et al. Organ-dependent in vivo priming of naive CD4+, but not CD8+, T cells by plasmacytoid dendritic cells. J Exp Med 2007; 204 : 1923–33. 14. Taieb J, Chaput N, Menard C, et al. A novel dendritic cell subset involved in tumor immunosurveillance. Nat Med 2006; 12 : 214–9. 15. Chan CW, Crafton E, Fan HN, et al. Interferon-producing killer dendritic cells provide a link between innate and adaptive immunity. Nat Med 2006; 12 : 207–13. 16. Bonmort M, Dalod M, Mignot G, et al. Killer dendritic cells: IKDC and the others. Curr Opin Immunol 2008 (sous presse). 17. Blasius AL, Barchet W, Cella M, Colonna M. Development and function of murine B220+CD11c+NK1.1+ cells identify them as a subset of NK cells. J Exp Med 2007; 204 : 2561–8. 18. Caminschi I, Ahmet F, Heger K, et al. Putative IKDCs are functionally and developmentally similar to natural killer cells, but not to dendritic cells. J Exp Med 2007; 204 : 2579–90. 19. Vosshenrich CA, Lesjean-Pottier S, Hasan M, et al. CD11cloB220+ interferon-producing killer dendritic cells are activated natural killer cells. J Exp Med 2007; 204 : 2569–78. 20. Spits H, Lanier LL. Natural killer or dendritic: what’s in a name ? Immunity 2007; 26 : 11–6. 21. Ullrich E, Bonmort M, Mignot G, et al. Trans-presentation of interleukin-15 dictates IKDC effector functions. 2008 (sous presse). 22. Welner RS, Pelayo R, Garrett KP, et al. Interferon-producing killer dendritic cells (IKDCs) arise via a unique differentiation pathway from primitive c-kitHiCD62L+ lymphoid progenitors. Blood 2007; 109 : 4825–31. 23. Mignot G, Ullrich E, Bonmort M, et al. The critical role of IL-15 in the antitumor effects mediated by the combination therapy imatinib and IL-2. J Immunol 2008 (sous presse). 24. Hayakawa Y, Smyth MJ. CD27 dissects mature NK cells into two subsets with distinct responsiveness and migratory capacity. J Immunol 2006; 176 : 1517–24. 25. Ullrich E. Boston : Federation of Clinical Immunology Societies (FOCIS), 2008. |