Les patients infectés par le virus d’immunodéficience humaine (VIH) manifestent, en dehors des lymphopénies, de multiples déficiences hématologiques associées au syndrome d’immuno-déficience acquise (Sida). Ces déficiences combinées reflètent un dysfonctionnement des cellules souches hématopoïétiques (CSH) elles-mêmes. Pourtant, bien que les fonctions de ces cellules souches soient altérées, aucune séquence virale n’a pu y être détectée [ 1], posant la question du mode d’action du VIH dans ce contexte cellulaire. Les mêmes types de désordres hématologiques caractérisent des singes infectés par le virus apparenté SIV (simian immunodeficiency virus) [ 2]. Afin de comprendre l’origine du dérèglement de telles CSH, nous avons infecté des macaques par l’isolat viral SIVmac251 et purifié une population de cellules médullaires contenant les CSH et les progéniteurs hématopoïétiques multipotents, sur la base de l’expression du marqueur CD34 [ 3]. Nous avons observé que la capacité caractéristique de ces cellules à former des clones de différentes cellules hématopoïétiques se trouve diminuée d’environ 50 à 60 % par rapport à la même population issue de singes non infectés. L’analyse comparée des niveaux d’expression de divers facteurs transcriptionnels actifs dans cette population cellulaire CD34+ a révélé la perte sélective d’expression des facteurs Stat5a et Stat5b dans les progéniteurs hématopoïétiques des animaux infectés. Cette perte est décelable très tôt après l’administration de virus aux animaux et se maintient tout au long de l’infection (Figure 1). La simple introduction dans les CSH des singes malades d’un vecteur permettant l’expression du transgène Stat5b, conduit au rétablissement de leurs propriétés clonogéniques [3]. Ces facteurs Stat5a/b sont des molécules de signalisation ubiquitaires, fréquemment activées par des cytokines et facteurs de croissance, qui peuvent directement convertir le message d’une cytokine/facteur de croissance en une régulation de l’expression de gènes particuliers grâce à leur double propriété de circuler du cytoplasme au noyau et d’agir comme facteurs de transcription. L’absence de ces facteurs chez la souris knock-out avait déjà révélé le rôle de Stat5a/b dans le maintien de CSH fonctionnelles capables de reconstituer l’hématopoïèse de souris irradiées [ 4, 5]. Le fait que la seule réintroduction de Stat5b dans des CSH de singes infectés suffise à rétablir les propriétés biologiques de ces cellules démontre que les mêmes facteurs Stat5 sont également des régulateurs importants des CSH de primates.
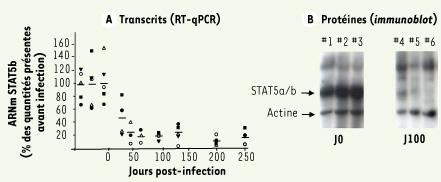
| Figure 1.
Expression de STAT5a et STAT5b dans les progéniteurs hématopoïétiques issus d’animaux infectés. L’infection de macaques par le virus SIV induit une diminution massive de l’expression des transcrits et des protéines Stat5a et Stat5b dans les progéniteurs hématopoïétiques médullaires CD34+. Les prélèvements d’animaux différents sont indiqués par des symboles (A) ou des numéros (B) différents. |