| |
| Med Sci (Paris). 2008 August; 24(8-9): 680–682. Published online 2008 August 15. doi: 10.1051/medsci/20082489680.Du nouveau dans la régulation de la prise alimentaire ? Serge Luquet* Université Paris 7-CNRS UMR 7059, Case courrier 7126, 2, place Jussieu, 75251 Paris Cedex 05, France MeSH keywords: Hormone corticotrope, Digestion, Consommation alimentaire, Ghréline, Homéostasie, Humains, Leptine, Modèles biologiques, Neuropeptides, Estomac |
L’homéostasie énergétique est maintenue par un réseau complexe de signaux périphériques et centraux qui renseigne sur le statut nutritionnel d’un organisme. L’intégration de ces signaux de faim et de satiété au niveau du système nerveux central (SNC) permet de développer une réponse adaptée aux modifications de la disponibilité en nutriments. Une perturbation de ce système intégrateur est probablement responsable, au moins en partie, de la propagation épidémique du syndrome métabolique dans les pays industrialisés. Parmi les principaux signaux circulants qui participent à la régulation à court et long terme de la régulation de la prise alimentaire comme la leptine, l’insuline ou la cholécystokinine (CCK) (Figure 1), la ghréline jouit du statut particulier d’être, à ce jour, la seule hormone circulante à potentialité orexigène. La ghréline est une hormone peptidique composée de 28 acides aminés sécrétée principalement par l’estomac et la partie supérieure de l’intestin [
11]. La cible endogène de la ghréline est le récepteur sécrétagogue à l’hormone de croissance (GHS-R) [
1] et certains des effets métaboliques et neuroendocriniens de cette hormone nécessitent la greffe par acylation d’un acide gras à 8 carbones (octanoate) sur un résidu sérine en position 3. La ghréline possède de nombreux sites d’action au niveau du SNC parmi lesquels une action sur la sécrétion d’hormone de croissance (GH), d’hormone adrénocorticotrope (ACTH), de cortisol et de prolactine. Au niveau hypothalamique, la ghréline augmente la sécrétion d’hormone de croissance (GH) en stimulant, via le GHS-R, les neurones à growth-hormone releasing hormone (GHRH) [
2] et stimule la prise alimentaire en activant les neurones qui fabriquent le neuropeptide Y (NPY) et l’agouti-related protein (AgRP), deux puissants peptides orexigènes [
12]. Ainsi, chez l’homme ou le rongeur, l’administration de ghréline se traduit par une augmentation de la sensation de faim, de la prise alimentaire, ainsi que des sécrétions acides et de la mobilité gastrique [
3]. La libération de la ghréline est initiée un peu avant un repas pour s’arrêter après l’épisode de prise alimentaire [
4]. Notons que les neurones NPY/AgRP semblent être un relais hypothalamique indispensable à l’action orexigène de la ghréline puisque l’invalidation du gène codant pour NPY et AgRP [
5] ou bien l’élimination des neurones NPY/AgRP per se au stade prénatal aboutit, chez l’animal, à une perte de l’action orexigène initiée par une injection de ghréline en périphérie [
6]. De récentes études démontrent que la ghréline exerce aussi une action sur le système mésolimbique dopaminergique, où elle modulerait la prise alimentaire dans sa composante motivationnelle et hédonique via son action sur les neurones dopaminergiques de l’aire tegmentale ventrale (VTA) [
7].
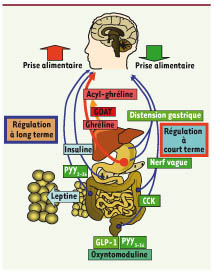
 | Figure 1.
La régulation de la prise alimentaire à court terme et à long terme. Le noyau du tractus solitaire (NTS) est un relais viscérosensitif qui intègre des signaux périphériques de nature nerveuse, comme la distension gastrique issue des mécanorécepteurs de la poche gastrique ou les afférences vagales qui relaient les signaux anorexigènes de la cholécystokinine (CCK), le glucagon-like petide 1 (GLP-A) ou l’oxyntomoduline par exemple. Ce processus représente la majeure partie de la régulation à court terme de la prise alimentaire. L’hypothalamus (Hyp) est un relais métabolique qui intègre des signaux circulants anorexigène comme la leptine qui circule de manière proportionnelle à la masse adipeuse (TA), l’insuline, ou le peptide YY3-36 (PYY3-36) (flèches bleues) ou orexigène comme la ghréline (flèche rouge). L’acylation de la ghréline par la Ghrelin O-acyl transferase (GOAT) est une étape indispensable à son action oréxigène (flèche orange). |
|
La GOAT : une cible pharmacologique pour un traitement anti-obésité En utilisant un crible bio-informatique basé sur l’homologie de structure des enzymes de la famille des O-acyltransférases, l’équipe de Joseph L. Goldstein a identifié une protéine qui catalyse la réaction d’octanoylation de la ghréline [
8] en position sérine 3, dans un protocole expérimental de co-transfection de cellules en culture avec l’ADNc de la prépro-ghréline et des ADNc identifiés sur la base de leur homologie avec les O-acyltransférases. Avec le clonage et la caractérisation de la Ghrelin O-Acyl Transferase (GOAT), Yang et al. fournissent à la communauté scientifique une nouvelle cible pharmacologique de choix pour le développement d’une stratégie visant à réduire l’apport alimentaire en réduisant le signal orexigène initié par la ghréline. En effet, la ghréline est le seul substrat connu de la GOAT, en cela, l’inhibition de la GOAT affecterait, spécifiquement et de manière réversible, l’octanoylation de la ghréline nécessaire à son action orexigène. On peut imaginer qu’une telle stratégie permettrait de contrôler la prise alimentaire à la fois dans sa composante homéostatique, au niveau des relais hypothalamiques NPY/AgRP, et non-homéostatique, au niveau du système de « récompense » dopaminergique du VTA. |
L’action orexigène des neurones NPY et AgRP, au-delà du système mélanocortine Le système impliquant la mélanocortine est devenu une structure canonique de régulation hypothalamique de la prise alimentaire et implique une action antagoniste des neurones NPY/AgRP et des neurones à pro-opiomélanocortine (POMC) (Figure 2). En particulier, l’AgRP exerce son action orexigène par l’inhibition compétitive de l’action anorexigène initiée par la liaison de l’α-mélanine stimulating hormone (α-MSH), sécrétée par les neurones POMC, sur les récepteurs à la mélanocortine de type 3 et 4 (MC3-R, MC4-R). Ce mécanisme est invoqué pour rendre compte de l’action centrale anabolique des neurones NPY/AgRP et il a été démontré que l’élimination brutale de ce signal, via l’élimination sélective des neurones NPY/AgRP, conduisait à un arrêt de la prise alimentaire [
9]. Wu et al. ont réitéré l’expérience d’élimination des neurones NPY/AgRP, mais cette fois chez les souris de fond génétique agouti yellow (AY), un modèle d’obésité hyperphagique due à l’expression ubiquiste d’un antagoniste de la voie mélanocortine. Si cette manipulation permet de réduire la dérégulation de l’activité neuronale observée dans certaines structures neuronanatomiques richement innervées par les neurones NPY/AgRP, l’arrêt de la prise alimentaire persiste [
10]. Ce résultat démontre que l’inhibition de la voie mélanocortine par la sécrétion d’AgRP n’est probablement pas le seul mécanisme par lequel les neurones NPY/AgRP antagonisent la voie satiétogène à la mélanocortine et il suggère l’existence d’une autre molécule orexigène par laquelle ces neurones exercent leur action orexigène et/ou l’existence d’un réseau neuronal parallèle au système mélanocortine, sur lequel les neurones NPY/AgRP exercent leur influence inhibitrice [10].
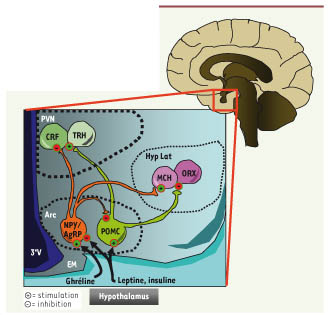
 | Figure 2.
Le réseau neuronal du noyau arqué. Situé à la base de l’hypothalamus, accolé au troisième ventricule (3eV) et près de l’éminence médiane (EM), le noyau arqué (Arc) de l’hypothalamus contient deux populations neuronales dites de « premier ordre » dans l’intégration des signaux circulants de faim et de satiété comme la leptine, l’insuline ou la ghréline. Il existe d’une part les neurones orexigènes qui fabriquent le Neuropeptide Y (NPY) et l’agouti-related protein (AgRP), et d’autre part les neurones anorexigènes à pro-opiomélanocortine (POMC) qui fabriquent notamment l’α-melanocyte stimulating hormone (α-MSH). Ces deux populations neuronales interagissent entre elles de manière antagoniste et projettent des afférences vers les neurones de « second ordre » dans d’autres régions de l’hypothalamus, comprenant le noyau paraventriculaire (PVN) ou le noyau de l’hypothalamus latéral (Hyp Lat). Au sein de ces structures les neurones NPY/AgRP et POMC exercent une action opposée sur d’autres populations neuronales clés dans la régulation de la balance énergétique comme les neurones à Corticotropin-releasing factor (CRF) et Thyrotropin-releasing hormone (TRH) du PVN, ou les neurones Orexines A et B (ou hypocrétines) et Melanin-concentrating hormone (MCH) de l’Hyp Lat. |
|
1. Kojima M, Hosoda H, Date Y, et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature 1999; 402 : 656–60. 2. Tannenbaum GS, Epelbaum J, Bowers CY. Interrelationship between the novel peptide ghrelin and somatostatin/growth hormone-releasing hormone in regulation of pulsatile growth hormone secretion. Endocrinology 2003; 144 : 967–74. 3. Tschop M, Smiley DL, Heiman ML. Ghrelin induces adiposity in rodents. Nature 2000; 407 : 908–13. 4. Cummings DE, Purnell JQ, Frayo RS, et al. A preprandial rise in plasma ghrelin levels suggests a role in meal initiation in humans. Diabetes 2001; 50 : 1714–9. 5. Chen HY, Trumbauer ME, Chen AS, et al. Orexigenic action of peripheral ghrelin is mediated by neuropeptide Y and agouti-related protein. Endocrinology 2004; 145 : 2607–12. 6. Luquet S, Phillips CT, Palmiter RD. NPY/AgRP neurons are not essential for feeding responses to glucoprivation. Peptides 2007; 28 : 214–25. 7. Naleid AM, Grace MK, Cummings DE, Levine AS. Ghrelin induces feeding in the mesolimbic reward pathway between the ventral tegmental area and the nucleus accumbens. Peptides 2005; 26 : 2274–9. 8. Yang J, Brown MS, Liang G, et al. Identification of the acyltransferase that octanoylates ghrelin, an appetite-stimulating peptide hormone. Cell 2008; 132 : 387–96. 9. Luquet S, Perez FA, Hnasko TS, Palmiter RD. NPY/AgRP neurons are essential for feeding in adult mice but can be ablated in neonates. Science 2005; 310 : 683–5. 10. Wu Q, Howell MP, Cowley MA, Palmiter RD. Starvation after AgRP neuron ablation is independent of melanocortin signaling. Proc Natl Acad Sci USA 2008; 105 : 2687–92. 11. Bluet-Pajot MT, Tolle V, Zizzari P, et al. Ghrelin: a striking example of neuroendocrine peptide pleiotropy. Med Sci (Paris) 2005; 21 : 715–21. 12. Jégou S, Mounien L, Boutelet I, Vaudry H. Le peptide YY3-36, une nouvelle arme thérapeutique contre l’obésité ? Med Sci (Paris) 2003; 19 : 537–9 |