| |
| Med Sci (Paris). 2008 August; 24(8-9): 776–778. Published online 2008 August 15. doi: 10.1051/medsci/20082489776.Axe corticotrope et plasticité de la communication neuronale Décryptage des mécanismes cellulaires Laurent Groc1* and Francis Chaouloff* 1UMR5091 CNRS, Université de Bordeaux, 33077 Bordeaux Cedex, France 2NeuroCentre INSERM U862, Université de Bordeaux, 33077 Bordeaux Cedex, France MeSH keywords: Animaux, Encéphale, Humains, Apprentissage, Plasticité neuronale, Neurones, Stress physiologique, Synapses |
Le stress, définissant ici une situation ressentie par l’individu comme une menace pour son intégrité (et non comme l’ensemble des réponses de l’organisme à cette menace), a des effets notoires sur le système limbique. Ainsi, dans l’hippocampe, une région cérébrale clef dans la régulation des processus mnésiques et des états d’anxiété et de peur, le stress agit à tous les niveaux de la neuroplasticité. Plus précisément, selon son intensité et sa durée (deux variables subjectives car dépendantes du patrimoine génétique et du vécu, y compris développemental, de chaque individu), le stress agira tout d’abord sur la plasticité synaptique, c’est-à-dire sur l’efficacité de la transmission synaptique, puis sur l’architecture neuronale (altération de la taille et/ou du nombre des épines dendritiques), et enfin sur la neurogenèse et la survie des neurones adultes [
1]. |
Les hormones du stress : de l’adaptation à l’inadaptation Cela fait maintenant plus de 70 ans et depuis les travaux de W.B. Cannon que l’on sait que l’exposition à un stress, qu’il soit psychologique ou physique, entraîne très rapidement une libération des catécholamines (adrénaline, noradrénaline) à partir de la médullosurrénale et des terminaisons sympathiques. Cette libération, avec ses répercussions rapides sur le système cardiovasculaire et le métabolisme, nous permet de répondre rapidement au stimulus stressant. Comme l’ont ensuite montré les travaux de H. Selye dans les années 1940, si le stimulus stressant dure au minimum quelques minutes, cette libération rapide des catécholamines est progressivement suivie d’une activation du système hypothalamo-hypophyso-surrénalien et de la sécrétion de corticostéroïdes à partir du cortex surrénalien. Ces corticostéroïdes, principalement le cortisol chez l’homme et la corticostérone chez le rongeur, prennent le relais des catécholamines pour assurer à plus long-terme une adaptation physique et psychologique de l’individu [
2]. Par contre, si ces hormones du stress sont sécrétées de manière inappropriée en réponse à un stimulus, par exemple s’il existe une hypersécrétion, elles entraîneront un épuisement de l’organisme et favoriseront l’apparition de troubles psychiques, métaboliques, cardiovasculaires, etc. [2]. Comprendre le rôle des hormones du stress dans l’étiologie des troubles de l’inadaptation est donc un enjeu scientifique, mais également de santé publique, majeur. |
La corticostérone, une hormone du stress régulatrice de la plasticité synaptique La corticostérone se lie à deux récepteurs spécifiques. Le premier est le récepteur aux minéralocorticoïdes (MR, qui lie également l’aldostérone) et le second est le récepteur aux glucocorticoïdes (GR), la liaison de l’hormone à chacun de ces récepteurs dépendant de sa concentration circulante. Ainsi, la corticostérone se lie tout d’abord au récepteur à haute affinité MR, puis, quand les concentrations de l’hormone atteignent des valeurs importantes, comme c’est le cas lors de l’exposition à un stimulus stressant ou lors de la phase active du rythme circadien, la corticostérone se lie progressivement aux récepteurs GR [2]. Il est important de noter ici que ces deux récepteurs sont particulièrement concentrés dans l’hippocampe. Lorsqu’ils sont activés par leurs ligands respectifs - l’aldostérone et la corticostérone passent la membrane plasmique par diffusion passive - ces deux récepteurs cytosoliques subissent une translocation nucléaire pour effectuer leur action transcriptionnelle directe/indirecte. Au-delà des effets génomiques médiés par ces récepteurs, des travaux récents ont mis en évidence dans l’aire CA1 de l’hippocampe ou dans l’hypothalamus l’existence additionnelle de récepteurs aux corticostéroïdes membranaires responsables des effets rapides de la corticostérone [
3,
4]. Les corticostéroïdes entretiennent une relation privilégiée avec la synapse excitatrice [
5]. Schématiquement, une synapse est formée d’un élément pré-synaptique, d’où provient l’information, et d’un élément post-synaptique qui la reçoit. Lorsque le compartiment pré-synaptique est stimulé par un signal électrique, il libère des messagers chimiques, appelés neurotransmetteurs. Et quelques millièmes de seconde plus tard, ces neurotransmetteurs se fixent au niveau de récepteurs spécifiques et provoquent un changement de l’activité électrique du neurone post-synaptique. Une des propriétés essentielles de la transmission synaptique est sa plasticité. Ainsi, lors de tâches d’apprentissage, l’intensité de certaines synapses est renforcée ou diminuée afin de permettre au réseau neuronal de coder et de stocker de nouvelles informations. C’est principalement au niveau des synapses excitatrices (>80 % des synapses) qui libèrent du glutamate et activent des récepteurs glutamatergiques que ces processus de plasticité prennent place (Figure 1). Enfin parmi les récepteurs glutamatergiques, les récepteurs ionotropiques (perméables à des ions) de type AMPA et NMDA ont été particulièrement étudiés car ils jouent des rôles clés dans les processus de maturation et de plasticité synaptiques [
6].
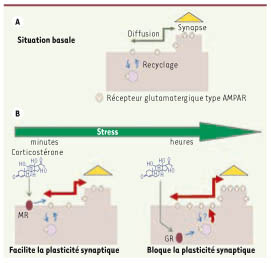
 | Figure 1.
Effet des corticostéroïdes sur le trafic des récepteurs glutamatergiques AMPA et sur la plasticité synaptique de neurones hippocampiques en culture. A. En condition basale, les récepteurs AMPA sont insérés (et internalisés) dans la membrane plasmique dans laquelle ils diffusent sur de longues distances. Lorsque les récepteurs AMPA diffusent au niveau d’une synapse, ils sont alors confinés et immobilisés pour une certaine durée. B. Après un événement stressant, la libération de corticostéroïdes induit dans un premier temps (de l’ordre de la minute ; schéma de gauche) une augmentation du trafic de surface des récepteurs AMPA qui facilite la plasticité synaptique. Cet effet est médié par un récepteur membranaire de type MR. À plus long terme les corticoïdes induisent, via les récepteurs intracellulaires des glucocorticoïdes (GR) : (1) une augmentation du nombre de récepteurs AMPA de surface par une augmentation d’insertion et/ou une diminution de l’internalisation ; (2) une augmentation du trafic de surface et du nombre de récepteurs synaptiques ; et (3) un blocage de la plasticité synaptique. |
En l’espace de quelques minutes, l’application de corticostérone sur des neurones pyramidaux de l’aire CA1 de l’hippocampe accroît la fréquence des courants synaptiques médiés par les récepteurs AMPA, un effet qui semble impliquer des récepteurs MR membranaires [5]. À plus long-terme (quelques heures), une telle application accroît les courants synaptiques médiés par les récepteurs AMPA mais cette action implique une action génomique de la corticostérone liée aux récepteurs GR. Au-delà de ces effets, la corticostérone exerce également un rôle métaplastique puisqu’en quelques minutes l’hormone amplifie la potentialisation à long-terme (PLT) induite par une stimulation à haute fréquence [5]. Ce résultat est intéressant si on le replace dans le cadre plus global de l’exposition au stress puisque l’application d’une autre hormone du stress, l’adrénaline, provoque également un renforcement rapide de la PLT induite par une stimulation à haute fréquence [
7]. La corticostérone exerce aussi un effet métaplastique à plus long-terme puisque quelques heures après son application, l’hormone prévient, via les récepteurs GR, l’apparition d’une PLT mais facilite une autre forme de plasticité, la dépression à long-terme induite par une stimulation à basse fréquence [5]. Enfin, ces effets intrinsèques de la corticostérone ont un pendant (patho)physiologique car on les retrouve chez des animaux préalablement stressés [1]. |
Voies cellulaires impliquées dans ces adaptations La compréhension des mécanismes cellulaires impliqués dans les modifications de la communication neuronale induite par la corticostérone a donc captivé les neuroscientifiques depuis des décennies. Notre étude, basée sur l’utilisation de techniques d’imagerie de suivi de nano-particules [
8], montre que la corticostérone modifie l’intensité de la transmission des synapses excitatrices, et ce en mobilisant les récepteurs AMPA de surface [
9]. Contrairement à ce que les neuroscientifiques ont pensé depuis longtemps, les récepteurs glutamatergiques (et d’autres types de récepteurs) localisés dans la synapse et dans la membrane plasmique ne sont pas statiques mais très mobiles à la surface des neurones [
10]. À court terme, la corticostérone augmente la mobilité des récepteurs AMPA permettant ainsi aux connections synaptiques de s’adapter plus efficacement aux demandes de l’activité cérébrale (Figure 1), la corticostérone agissant en quelque sorte comme une alarme cellulaire en mobilisant les récepteurs membranaires ! Un des effets de cette mobilisation est qu’en présence de corticostérone, les capacités de plasticité synaptique sont, dans un premier temps, augmentées. Ce résultat est d’autant plus pertinent qu’il a été mis en évidence dans l’hippocampe, une région du cerveau très sensible aux effets des corticostéroïdes et qui est fortement impliquée dans les processus d’apprentissage et de mémorisation [5]. Quelques heures après exposition à la corticostérone, les capacités de PLT sont, à l’inverse, diminuées. Cet effet antagoniste s’explique par le fait qu’après un certain délai les corticostéroïdes n’augmentent pas seulement la mobilité des récepteurs AMPA de surface mais aussi leur nombre au niveau de la synapse (Figure 1) [9], limitant de fait les possibilités de plasticité de cette dernière. En conclusion, une libération significative de corticostéroïdes durant la phase active du rythme circadien ou après un évènement stressant entraîne deux effets physiologiques antagonistes sur la plasticité synaptique : un effet facilitateur à court terme et un effet inhibiteur à long-terme qui sont tous deux liés à des modifications du trafic de surface des récepteurs glutamatergiques de type AMPA [9]. |
La mise en évidence de ces mécanismes cellulaires ouvre de nombreuses pistes de recherche avec des retombées à la fois fondamentales et potentiellement cliniques. Par exemple, en démontrant comment la plasticité synaptique dépend de la mobilité des récepteurs membranaires, ce travail va permettre d’étudier sous un nouvel angle certains processus cognitifs complexes tels que la mémorisation. De même, on peut désormais concevoir que chez certains individus soumis à des stress importants, l’absence de mobilité des récepteurs glutamatergiques contribue à l’absence d’adaptation. La plasticité des synapses lors des états de stress dépendrait alors d’interactions dynamiques entre le cortisol et les récepteurs neuronaux qui modulent l’activité du cerveau. |
1. Kim JJ, Diamond DM. The stressed hippocampus, synaptic plasticity and lost memories. Nat Rev Neurosci 2002; 3 : 453–62. 2. De Kloet ER, Joels M, Holsboer F. Stress and the brain: from adaptation to disease. Nat Rev Neurosci 2005; 6 : 463–75. 3. Karst H, Berger S, Turiault M, et al. Mineralocorticoid receptors are indispensable for nongenomic modulation of hippocampal glutamate transmission by corticosterone. Proc Natl Acad Sci USA 2005; 102 : 19204–7. 4. Di S, Malcher-Lopes R, Halmos KC, Tasker JG. Nongenomic glucocorticoid inhibition via endocannabinoid release in the hypothalamus: a fast feedback mechanism. J Neurosci 2003; 23 : 4850–7. 5. Joels M, Pu Z, Wiegert O, et al. Learning under stress: how does it work ? Trends Cogn Sci 2006; 10 : 152–8. 6. Malinow R, Malenka RC. AMPA receptor trafficking and synaptic plasticity. Annu Rev Neurosci 2002; 25 : 103–26. 7. Hu H, Real E, Takamiya K, et al. Emotion enhances learning via norepinephrine regulation of AMPA-receptor trafficking. Cell 2007; 131 : 160–73. 8. Groc L, Lafourcade M, Heine M, et al. Surface trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J Neurosci 2007; 27 : 12433–7. 9. Groc L, Choquet D, Chaouloff F. The stress hormone corticosterone conditions AMPAR surface trafficking and synaptic potentiation. Nat Neurosci 2008; 11 juillet (online). 10. Choquet D, Triller A. The role of receptor diffusion in the organization of the postsynaptic membrane. Nat Rev Neurosci 2003; 4 : 251–65. |