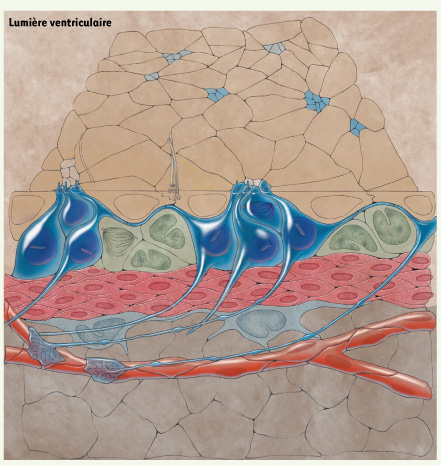
Mirzadeh et al. [
5] se focalisent quant à eux sur l’architecture cellulaire de la zone germinative adulte. Grâce à des marquages simultanés des bordures cellulaires (β-caténine) et des corps basaux des cils (γ-tubuline), les auteurs décrivent une organisation unique qu’ils baptisent « pinwheel architecture » que, par défaut, nous traduirons ici par « architecture en rosace ». Ils découvrent en effet que les prolongements apicaux émis par les CSN forment des îlots encerclés par des cellules épendymaires. En plus des CSN de type astroglial qui émettent un seul cil primaire dans la lumière ventriculaire [
7], et des cellules épendymaires multiciliées, un nouveau type de cellules épendymaires est décrit comme n’émettant que 2 longs cils susceptibles de véhiculer des signaux régulateurs en provenance du liquide céphalo-rachidien (Figure 1). Les prolongements apicaux des CSN sont courts en comparaison des longs prolongements basaux que ces cellules émettent et qui contactent les vaisseaux sanguins, comme cela est décrit également par les deux autres équipes. Des manipulations génétiques, marquant spécifiquement les cellules qui entrent en contact avec le ventricule et leur descendance, montrent que ces cellules sont neurogéniques in vivo et donc capables de produire des neurones du bulbe olfactif [6].
Cette organisation en rosace pourrait donc être fondamentale pour la régulation des cellules souches. En effet, leurs prolongements possèdent des jonctions adhérentes et communiquent entre eux et avec les cellules épendymaires voisines, ce qui pourrait permettre le passage de signaux entre ces cellules. Cette organisation amène enfin les auteurs à dresser un intéressant parallèle entre neurogenèse adulte et embryonnaire. Chez l’embryon, il existe deux zones germinatives distinctes et adjacentes, la zone ventriculaire (ZV), directement apposée au ventricule et composée d’une population homogène de cellules souches, et la ZSV, composée de progéniteurs intermédiaires. Chez l’adulte, une ZV est maintenue, mais devient hétérogène puisque composée des prolongements des CSN mais également des cellules épendymaires. La ZSV persiste également, et elle est composée des progéniteurs et des neuroblastes. La distinction est cependant moins claire que pendant le développement, puisque les corps cellulaires des CSN sont décalés dans la ZSV. Le parallèle entre ZV/ZSV embryonnaire et adulte est également mis en exergue par Shen et al., l’accent étant mis par cette équipe sur le lien avec le réseau vasculaire, lui aussi extrêmement conservé.
Ces trois articles complémentaires modifient donc profondément notre vision de la niche de la ZSV en décrivant de nouveaux acteurs et de nouveaux types d’interactions. Ces nouvelles perspectives seront probablement lourdes de conséquences sur notre compréhension des régulations fonctionnelles des cellules souches du cerveau adulte et leur potentielle utilisation à des fins thérapeutiques.