| |
| Med Sci (Paris). 2009 March; 25(3): 235–238. Published online 2009 March 15. doi: 10.1051/medsci/2009253235.Des mutations dans l’exon HSN2 du gène WNK1 causent la neuropathie héréditaire sensitive et autonomique de type 2 Jean-Baptiste Rivière,1* Patrick Dion,1 Masoud Shekarabi,1 Nathalie Girard,1 Laurence Faivre,2 Ronald G. Lafrenière,1 Mark Samuels,3 and Guy A. Rouleau1 1Centre d’excellence en neuromique de l’Université de Montréal (CENUM), 1560, rue Sherbrooke Est, Pavillon de-Sève, salle Y-3624, Montréal, Québec, H2L 4M1 Canada 2Centre de Génétique, Hôpital d’Enfants, CHU Consultation de génétique, 10, boulevard Maréchal de Lattre de Tassigny, BP 77908, 21079 Dijon Cedex, France 3Centre d’excellence en neuromique de l’Université de Montréal (CENUM), CHU Sainte-Justine, 3175 Côte-Ste-Catherine, salle A-733, Montréal, Québec, H3T 1C5 Canada MeSH keywords: Amorces ADN, Exons, Femelle, Neuropathies héréditaires sensitives et autonomes, Humains, Protéines et peptides de signalisation intracellulaire, Mâle, Mutation, Protéines tissu nerveux, Polymorphisme de nucléotide simple, Protein-Serine-Threonine Kinases, RT-PCR |
Neuropathie héréditaire sensitive et autonomique et mutations de HSN2 La neuropathie héréditaire sensitive et autonomique de type II (NHSAII) tire son origine d’un désordre génétique récessif rare. Sa fréquence est plus élevée dans les populations du Québec et de l’Est du Canada puisque plus de 50 % des cas décrits proviennent de ces régions [
1]. Ce désordre se manifeste dès la petite enfance par une perte de perception de la douleur, du toucher et de la température due à une perte des neurones sensoriels périphériques [
2]. En 2004, notre groupe a identifié des mutations causant la NHSAII dans HSN2 (hereditary sensory neuropathy), un nouveau gène encodé par un seul exon localisé dans l’intron 8 du gène WNK1 qui code pour une serine-thréonine kinase qui intervient dans la régulation homéostatique du transport ionique dans la membrane plasmique [
3]. En 2001, des délétions introniques du gène WNK1 ont été associées au pseudohypoaldostéronisme de type II (PHAII), caractérisé par une hypertension [
4]. À l’exception de deux publications décrivant le rôle de WNK1 dans des précurseurs de cellules neuronales [
5] et détaillant son expression au cours du développement du cerveau [
6], peu d’informations sur le rôle de WNK1 dans le système nerveux ont été rapportées. Nos récents travaux démontrent que HSN2 est finalement un exon alternatif de WNK1 et que cet épissage produit une isoforme exclusive au système nerveux, jusqu’ici inconnue (provisoirement appelé WNK1/HSN2) [
7]. |
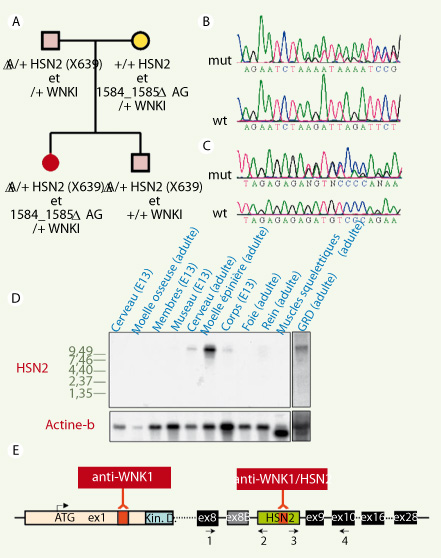
L’observation clinique et génétique d’une famille informative Afin de confirmer un diagnostic chez une patiente présentant les symptômes usuels de NHSAII (perte distale des sensations douloureuses, diminution du sens du toucher et de la température, absence des réflexes tendineux, etc.), une famille française nous a été adressée par le Centre de génétique de l’hôpital d’enfants de Dijon (Figure 1A). L’examen de la patiente n’a révélé ni dysautonomie ni anomalie particulière de sa pression sanguine. La lecture des séquences de HSN2 dans cette famille a permis d’observer une délétion hétérozygote d’une paire de bases (pb) (639delA, Arg214fsX215) chez la patiente, son frère asymptomatique et leur père (Figure 1B). De façon inattendue, car il s’agit d’un désordre récessif, nous n’avons pu observer de mutation du second allèle de HSN2. Bien que différentes études aient authentifié HSN2 comme la cause de la NHSAII [1, 3,
8] et qu’il n’y ait aucun lien génétique ou fonctionnel connu entre HSN2 et WNK1, nous avons séquencé WNK1 et détecté une délétion de 2-pb dans l’exon 6 (1584_1585delAG, Asp531fsX547) transmise de la mère à la patiente (Figure 1C). La mère ne présentait aucun symptôme relié à une anomalie de la pression sanguine ou à la NHSAII, ce qui est cohérent avec le fait que les mutations de WNK1 associées au PHAII se traduisent par de larges délétions affectant le premier intron et entraînant toutes une surexpression de WNK1 [4]. Étant donné que la mère et la fille ne présentent aucune anomalie de leur pression sanguine, nous pouvons conclure qu’une perte partielle de WNK1 n’affecte pas le maintien d’une pression normale. La découverte inattendue de mutations hétérozygotes composées, l’une dans WNK1 et l’autre dans HSN2, nous a mené à formuler l’hypothèse selon laquelle HSN2 est un exon alternatif de WNK1.  | Figure 1.
Mutations dans WNK1/HSN2 et détection de l’ARNm de WNK1/HSN2 par Northern. A.
Transmission des mutations dans la famille de la patiente. B. Séquences de la délétion d’une pb (639delA, Arg214fsX215) identifiée dans HSN2 et (C) de la délétion de deux pb (1584_1585delAG, Asp531fsX547) dans l’exon 6 de WNK1 comparées à la séquence référence (wt). D. Détection de l’isoforme WNK1/HSN2 par Northern dans différents tissus de souris. La membrane a été hybridée avec une sonde complémentaire à HSN2 (haut) avant d’être traitée et hybridée avec une sonde reconnaissant l’actine-β (bas). GRD : ganglion de la racine dorsale. E. Diagramme du gène WNK1/HSN2 incluant les amorces utilisées pour les RT-PCR (flèches noires) et les sites détectés par les anticorps anti-HSN2 et anti-WNK1 (alpha diagnostic) (en rouge). |
|
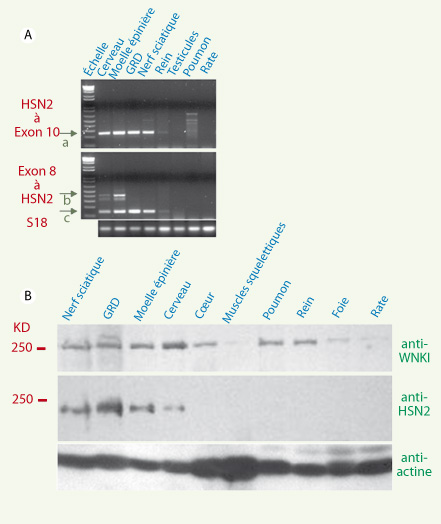
Vérification de l’hypothèse dans un modèle murin : HSN2 est un exon alternatif de WNK1 Les régions codantes et les éléments régulateurs de HSN2 et WNK1 sont aussi bien conservés chez la souris que chez l’humain (86 % d’identité). Nous avons donc étudié l’orthologue murin pour tester notre hypothèse. Les ARN de tissus embryonnaires et adultes de souris ont été préparés et séparés par Northern blot. La membrane a été hybridée avec une sonde complémentaire à une région codante située en 3’ de HSN2. Nous avons ainsi observé un ARNm de ~10 kb exprimé exclusivement dans les tissus du système nerveux (Figure 1D). Au stade E13 du développement, ce messager est davantage exprimé dans le corps que dans les parties distales comme les membres et le museau. Ces observations attestant qu’un ARNm de 10,5 kb code WNK1 dans le cerveau [
9] concordent avec celles faites par des groupes indépendants. Afin de mieux étayer nos observations montrant HSN2 comme exon alternatif de WNK1, nous avons réalisé des PCR par transcription inverse (RT-PCR) à l’aide de deux paires d’amorces. L’amplification avec la première paire (amorces 1 et 2, Figure 1E) a révélé une bande de 160-pb propre aux tissus neuronaux (Figure 2A) correspondant à la taille calculée d’une amplification entre l’exon 8 de WNK1 et HSN2 et une bande supplémentaire de 420-pb dans laquelle un nouvel exon en amont de HSN2 est inclus dans le système nerveux central (exon 8b, Figure 2A, flèche b).  | Figure 2.
RT-PCR et immunodétection par Western. A. Amplification par RT-PCR entre l’exon 8 de WNK1 et HSN2 (amorces 1 et 2, bas) et entre HSN2 et l’exon 10 (amorces 3 et 4, haut). Les flèches a, b et c indiquent les produits amplifiés. B. Technique de Western : immunodétections de WNK1 (par l’anticorps anti-WNK1, haut) et de WNK1/HSN2 (par l’anticorps anti-HSN2, milieu) à partir de divers tissus de souris. Un anticorps anti-actine a servi de contrôle afin de comparer la quantité de protéines dans chacun des puits. |
Afin de confirmer de façon plus définitive notre hypothèse, nous avons réalisé des immunodétections sur des extraits totaux de protéines préparés à partir de tissus de souris séparés par SDS-PAGE et transférés par Western. Deux anticorps ont été utilisés : l’un ciblant la portion carboxy-terminale de HSN2 (anti-HSN2) et l’autre la portion amino-terminale de WNK1 (anti-WNK1) (Figure 1E). Une protéine de ~250 kDa a été observée dans tous les tissus avec anti-WNK1 (Figure 2B), ce qui est en accord avec les publications antérieures [
10]. Par contre, l’anticorps anti-HSN2 a permis d’observer une protéine de ~230 kDa (Figure 2B), ce qui est très différent du poids moléculaire d’une protéine encodée uniquement par la séquence de HSN2 (~45 kDa), mais qui correspond au poids moléculaire attendu pour une protéine encodée par l’isoforme WNK1/HSN2. |
En dépit des études antérieures entourant WNK1 et de l’absence de symptômes communs entre la NHSAII et le PHAII, nos résultats démontrent clairement l’existence d’une nouvelle isoforme de WNK1 (WNK1/HSN2) dont l’expression est exclusive au système nerveux périphérique et central. Nos observations de l’ADN, de l’ARN et des protéines établissent donc de façon définitive que HSN2 est un exon alternatif de WNK1. À ce jour, toutes les mutations connues causant la NHSAII identifiées par notre groupe, ainsi que par des groupes indépendants entraînent une troncature de la protéine WNK1/HSN2. Nos données génétiques montrent qu’une mutation hétérozygote dans l’exon HSN2 est suffisante pour causer la NHSAII lorsqu’elle est combinée à une mutation de WNK1 localisée sur l’autre allèle. La séquence protéique encodée par HSN2 ne présente aucun motif ou domaine fonctionnel établi qui puisse suggérer qu’elle exerce un rôle spécifique au sein du système nerveux. Conséquemment l’impact fonctionnel de l’inclusion de cet exon dans la protéine WNK1 demeure inconnu à ce jour. La NHSAII étant caractérisée par un défaut de perception sensorielle, l’élucidation du rôle exact de WNK1/HSN2 dans le système nerveux périphérique mènerait à une meilleure compréhension de la perception de la douleur. Étant donné le rôle avéré de WNK1 dans le transport ionique et ses interactions protéiques avec un membre de la famille des TRP, canaux ioniques associés aux perceptions nociceptives et thermiques [
11], il n’est pas exclu que WNK1/HSN2 exerce une action dans la localisation et/ou la régulation de canaux TRP. Enfin, cette étude souligne l’importance de l’épissage alternatif spécifique à certains tissus et constitue une excellente illustration du fait que des mutations affectant différents isoformes d’un même gène peuvent entraîner des maladies très distinctes. |
Les auteurs déclarent ne pas avoir de conflit d’intérêt à mentionner concernant l’article soumis.
|
1. Roddier K, Thomas T, Marleau G, et al. Two mutations in the HSN2 gene explain the high prevalence of HSAN2 in French Canadians. Neurology 2005; 64 : 1762–7. 2. Ota M, Ellefson RD, Lambert EH, Dyck PJ.Hereditary sensory neuropathy, type II. Clinical, electrophysiologic, histologic, and biochemical studies of a Quebec kinship. Arch Neurol 1973; 29 : 23–37. 3. Lafrenière RG, MacDonald ML, Dube MP, et al. Identification of a novel gene (HSN2) causing hereditary sensory and autonomic neuropathy type II through the Study of Canadian Genetic Isolates. Am J Hum Genet 2004; 74 : 1064–73. 4. Wilson FH, Disse-Nicodème S, Choate KA, et al. Human hypertension caused by mutations in WNK kinases. Science 2001; 293 : 1107–12. 5. Sun X, Gao L, Yu RK, Zeng G. Downregulation of WNK1 protein kinase in neural progenitor cells suppresses cell proliferation and migration. J Neurochem 2006; 99 : 1114–21. 6. Delaloy C, Hadchouel J, Imbert-Teboul M,et al. Cardiovascular expression of the mouse WNK1 gene during development and adulthood revealed by a BAC reporter assay. Am J Pathol 2006; 169 : 105–18. 7. Shekarabi M, Girard N, Rivière JB,et al. Mutations in the nervous system-specific HSN2 exon of WNK1 cause hereditary sensory neuropathy type II. J Clin Invest 2008; 118 : 2496–505. 8. Coen K, Pareyson D, Auer-Grumbach M, et al. Novel mutations in the HSN2 gene causing hereditary sensory and autonomic neuropathy type II. Neurology 2006; 66 : 748–51. 9. O’Reilly M, Marshall E, Speirs HJ, Brown RW. WNK1, a gene within a novel blood pressure control pathway, tissue-specifically generates radically different isoforms with and without a kinase domain. J Am Soc Nephrol 2003 : 14 : 2447–56. 10. Wade JB, Fang L, Liu J, et al. WNK1 kinase isoform switch regulates renal potassium excretion. Proc Natl Acad Sci USA 2006; 103 : 8558–63. 11. Dhaka A, Viswanath V, Patapoutian A. Trp ion channels and temperature sensation. Annu Rev Neurosci 2006; 29 : 135–61. |