| |
| Med Sci (Paris). 2009 March; 25(3): 247–252. Published online 2009 March 15. doi: 10.1051/medsci/2009253247.CEACAM1 : modulateur central du métabolisme, de la progression tumorale,de l’angiogenèse et de l’immunité Anne-Laure Nouvion1 and Nicole Beauchemin1,2* 1Centre de cancérologie McGill 2Départements de biochimie, médecine et oncologie. Université McGill, 3655 Promenade Sir-William- Osler, Montréal (Québec) H3G 1Y6, Canada |
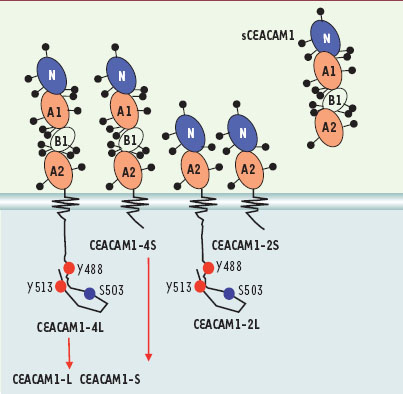
CEACAM1 (carcinoembryonic antigen cell adhesion molecule 1) est considéré comme l’ancêtre de la famille des antigènes carcinoembryonnaires (CEA). Cette famille de 22 gènes et 11 pseudogènes est regroupée dans une région de 1,8 Mb du chromosome humain 19q13.2. Elle se divise en deux branches : la branche CEA dont la majorité des membres se trouve associée à la membrane cytoplasmique, et la branche PSG (pregnancy-specific glycoprotein) dont les protéines sont largement sécrétées par le placenta. La caractéristique structurale de ces protéines se retrouve dans la présentation extracellulaire de domaines de type immunoglobuline (Ig) variables ou constants, densément glycosylés et portant des structures LewisX ou sialyl LewisX. La protéine CEACAM1 présente généralement 4 domaines Ig, est liée à la membrane cytoplasmique et possède un domaine cytosolique soit court de 10 soit long de 71-73 acides aminés (Figure 1) [
1,
2]. Il existe de multiples isoformes de CEACAM1 résultant d’épissages alternatifs (12 chez l’humain). CEACAM1 est exprimée pendant le développement embryonnaire et chez l’adulte à la surface de plusieurs types cellulaires, tels que les cellules épithéliales de la voie gastro-intestinale, les tissus reproducteurs, les cellules myéloïdes et endothéliales.  | Figure 1.
Isoformes de CEACAM1. CEACAM1 présente plusieurs domaines immunoglobulines variables (N) et constants (A1, B1, A2) fortement glycosylés. Leur nombre (dans la souris, CEACAM1-4 ou CEACAM1-2) dépend de l’épissage alternatif qui régule aussi la longueur et la composition du domaine cytoplasmique, soit court (S) ou long (L). Des isoformes sécrétées sont aussi produites par épissage alternatif ou par clivage de la surface cellulaire. Le domaine cytoplasmique de l’isoforme long contient deux Tyr phosphorylées et un grand nombre de Ser phosphorylées, dont la Ser503. |
En 1997, lors de notre dernière communication dans ce journal, CEACAM1 était reconnue comme un inhibiteur du développement tumoral, comme le récepteur du virus de l’hépatite murine et comme un participant à la signalisation cellulaire [
3]. L’adhésion intercellulaire représente la première fonction décrite de cette protéine. En effet, la liaison du premier domaine Ig de CEACAM1 avec son semblable présenté par le même type cellulaire ou par différents types cellulaires déclenche la signalisation intracellulaire. Quant à la reconnaissance virale, la production d’une souris Ceacam1
−/− nous a permis de confirmer que CEACAM1 agit in vivo comme le seul récepteur du virus de l’hépatite murine MHV-A59 et que par conséquent, la délétion de ce gène rend ces souris complètement résistantes à l’infection virale MHV [
4]. De plus, chez l’humain, CEACAM1 interagit avec plusieurs types de bactéries dont E. coli, S. thyphimurium, les gonocoques Neisseria, Haemophilus influenzae et Moraxella catarrhalis [2]. Ces fonctions d’adhésines bactériennes ou virales de CEACAM1 contribuent à l’immunosuppression des lymphocytes B ou T. Plusieurs modèles de souris génétiquement modifiées ont contribué à l’élucidation des fonctions in vivo qui seront décrites ci-après. |
CEACAM1 et la modulation du métabolisme L’équipe du Docteure Sonia Najjar a identifié CEACAM1 comme un substrat du récepteur à l’insuline dans le foie. La phosphorylation de la Tyr488 de CEACAM1, régulée par la Tyr1316 de la chaîne β du récepteur activé, provoque l’endocytose du récepteur lié à l’insuline [
5]. Cette phosphorylation sur tyrosine de CEACAM1 dépend également de la phosphorylation de la Ser503 de son domaine cytoplasmique long. Ainsi, une souris transgénique (Tg L-SACC1) surexprimant un mutant CEACAM1-L Ser503Ala dans le foie agissant comme un dominant négatif de la protéine normale, a permis de vérifier les phénotypes métaboliques in vivo [
6]. Les souris Tg ont démontré un important déficit de la clairance de l’insuline induisant une hyperinsulinémie, une résistance secondaire à l’insuline et une intolérance au glucose. En conséquence, ces souris Tg se caractérisent par une adiposité viscérale accrue avec un taux sérique plus élevé d’acides gras libres et une augmentation des triglycérides hépatiques et sériques. Notre laboratoire a examiné si l’extinction de l’expression de CEACAM1 (Ceacam1
−/−) plutôt que la surexpression de son mutant dominant négatif (L-SACC1) produisait des effets métaboliques similaires [
7]. Les souris Ceacam1−/−
ayant un patrimoine génétique hybride C57Bl/6 X 129Sv ont un surplus de poids causé par l’adiposité viscérale, mais le phénotype s’amenuise chez les souris dont le patrimoine génétique est homogène sur C57Bl/6. La comparaison des profils génétiques des foies mâles Ceacam1
−/− et des foies contrôles révèle une augmentation significative de l’expression de plusieurs enzymes engagées dans la biosynthèse des triglycérides et des phospholipides, tels la FasN, la ACC et la HMG-CoA réductase. En conséquence, les souris Ceacam1
−/− âgées de 8 mois présentent une augmentation significative du cholestérol hépatique estérifié sans augmentation parallèle des taux sériques, suggérant un défaut du transport des lipides hépatiques chez ces souris. Le foie des souris Ceacam1
−/− âgées de 8 mois, dont le régime alimentaire est riche en lipides et en glucides, se caractérise donc par une stéatose hépatique marquée [7]. Les souris Ceacam1
−/− sont résistantes à l’insuline, que leur alimentation soit normale ou riche en lipides et en glucides. Elles révèlent également un défaut majeur dans la clairance de l’insuline hépatique observée après un jeûne de 6 heures. Cependant, contrairement à celle de la souris L-SACC1, la glycémie des souris Ceacam1
−/− est normale. En conclusion, CEACAM1, originalement décrit comme un participant essentiel à l’endocytose du récepteur de l’insuline dans les hépatocytes [
8], contribue au maintien systémique d’un poids normal en prévenant l’obésité et le développement du syndrome métabolique. |
CEACAM1 et la progression tumorale L’expression de CEACAM1 dans les tumeurs est beaucoup plus complexe qu’on ne l’avait envisagé originalement [3]. CEACAM1 est diminué dans les cancers du côlon, de la prostate, du foie, de l’endomètre, de la vessie, du rein et dans 30 % des cancers du sein [1], mais est augmenté et représente un marqueur fiable dans les cancers gastriques, pancréatiques, pulmonaires et les mélanomes [
9,
10]. La surexpression de CEACAM1-L dans des cellules de carcinomes de côlon, de prostate ou de vessie réduit leur potentiel tumorigénique in vitro et inhibe le développement de tumeurs greffées en situation xénogénique in vivo [
11]. Plusieurs mécanismes s’entrecroisent. Tout d’abord, la diminution de CEACAM1 dans les tumeurs de la prostate dépend de l’association du répresseur transcriptionnel SP2 et du recrutement de la déacétylase des histones au promoteur CEACAM1 [
12]. De plus, la tyrosine phosphorylation de CEACAM1-L, provoquant son association avec la tyrosine phosphatase SHP-1, régule la croissance de cellules tumorales in vivo [
13,
14]. Enfin, l’association de CEACAM1-L avec la β-caténine contribue au maintien de l’homéostasie intestinale et l’absence de CEACAM1 dans les souris Ceacam1
−/− dérégule complètement la voie de signalisation Wnt. On constate également chez ces animaux une diminution significative de l’apoptose dans les colonocytes et les entérocytes [
15]. Les souris Ceacam1
−/−, même très âgées, ne développent aucune tumeur. Cependant, si des tumeurs coloniques sont induites par carcinogenèse chimique, les souris Ceacam1
−/− présentent alors une charge tumorale plus importante [
16]. De même, le croisement de souris Ceacam1
−/− avec des souris Apc1638N/+, porteuses d’une mutation du gène adenomatous polyposis coli qui les prédispose aux cancers gastro-intestinaux favorise une progression tumorale accrue dans les souris hybrides. Ces tumeurs sont plus invasives que celles observées chez les souris contrôles Apc1638N/+ [15]. D’autre part, bien que CEACAM1 ne soit pas exprimée dans la glande thyroïde normale ou dans ses tumeurs bénignes, elle est surexprimée dans les carcinomes thyroïdiens de nature métastatique [
17]. Le mécanisme dans ce cas impliquerait l’augmentation des interactions de CEACAM1 avec la matrice extracellulaire, alors que dans les cancers pulmonaires et les mélanomes, la surexpression de CEACAM1 induirait un accroissement de la densité vasculaire [
18,
19]. |
L’expression de CEACAM1 se concentre principalement dans les petits vaisseaux sanguins de tissus en prolifération, tels que l’endomètre, le placenta, et les tumeurs humaines [
20]. De plus, CEACAM1 potentialise les effets du facteur angiogénique VEGF (vascular endothelial growth factor) sur la prolifération et la migration des cellules endothéliales, ainsi que sur la formation de vaisseaux sanguins dans la membrane chorioallantoïdienne de l’embryon de poulet. À l’aide de souris transgéniques, nous avons montré que la surexpression spécifique de CEACAM1 dans les cellules endothéliales augmente efficacement la formation de vaisseaux sanguins in vivo (les mesures ont été effectuées à l’aide d’implants de Matrigel injectés par voie sous-cutanée dans les souris). De plus, l’observation en microscopie électronique des implants injectés dans les souris Ceacam1−/−
montre un défaut dans l’organisation structurale des vaisseaux. CEACAM1 semble donc jouer un rôle primordial dans l’intégrité vasculaire et la formation de réseaux capillaires in vivo, particulièrement en situation de néovascularisation [
21]. La surexpression de CEACAM1 à la surface de cellules endothéliales induit fortement l’expression de facteurs pro-angiogéniques tels que le VEGF, l’angiopoiétine-1 et -2, l’interleukine-8 (IL-8) ; et, à l’inverse, inhibe la production de facteurs anti-angiogéniques comme le collagène XVIII et l’endostatine [
22]. Par ailleurs, CEACAM1 régule l’adhésion des cellules endothéliales sur la matrice extracellulaire via l’activation des protéines de la famille Rho et la voie de signalisation des intégrines [
23]. L’angiogenèse normale différant fortement de l’angiogenèse tumorale, nous avons analysé le rôle de CEACAM1 dans cette dernière. Ainsi, CEACAM1, surexprimé spécifiquement dans les cellules endothéliales de souris transgéniques, stimule la croissance des vaisseaux sanguins au sein de tumeurs du sein injectées en sous-cutané. Cela confirme pour la première fois l’activité pro-angiogénique de CEACAM1 dans un modèle de tumorigenèse in vivo (données non publiées). Dans les cas de néoplasmes de la prostate, CEACAM1 apparaît sous-exprimée dans les cellules épithéliales mais surexprimée dans les cellules endothéliales. Mimer l’inhibition de l’expression de CEACAM1 par des siARN dans les cellules épithéliales DU-145 (cancer de la prostate) ou RT4 (cancer de la vessie) entraîne la surexpression de facteurs pro-angiogéniques tels que VEGF-A, -C et -D [
24]. À l’inverse, le surnageant issu de cellules DU-145 surexprimant CEACAM1, mis en présence de cellules endothéliales inhibe la formation de réseaux tubulaires. Ainsi, CEACAM1 exprimée au sein des cellules épithéliales possède une activité anti-angiogénique. Cette fonction de CEACAM1 est en accord avec son rôle de suppresseur de tumeur, mais apparaît contradictoire avec sa fonction pro-angiogénique définie dans les cellules endothéliales. En réalité, l’inhibition de l’expression de CEACAM1 dans les cellules épithéliales, associée à l’augmentation de son expression dans les cellules endothéliales, agissent en synergie lors de la croissance tumorale. Toutes deux convergent vers l’activation de la signalisation angiogénique (Figure 2). Cette synergie serait nécessaire à la progression tumorale, lors de la transition d’un stade non invasif à un stade plus agressif et métastatique [
25]. Enfin, en stimulant la sécrétion des facteurs de croissance lymphatiques VEGF-C et VEGF-D, ainsi que l’activation de leur récepteur VEGFR-3 via le facteur de transcription Prox-1, CEACAM1 endothélial semble activer le mécanisme de lymphangiogenèse. Ce processus participerait à la « reprogrammation » des vaisseaux sanguins en vaisseaux lymphatiques, favorisant la dissémination des cellules tumorales à travers le système lymphatique [
26]. 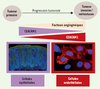 | Figure 2.
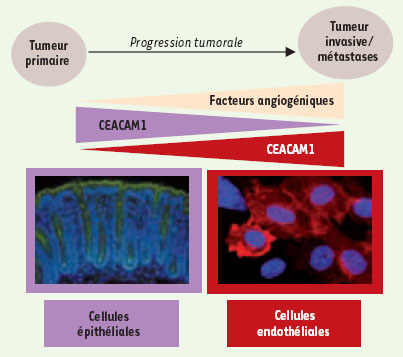
Modulation de l’angiogenèse tumorale par CEACAM1 au sein des cellules épithéliales et endothéliales : dualité et complémentarité fonctionnelles. CEACAM1 est exprimée dans les cellules épithéliales (immunofluorescence de CEACAM1 (vert) sur coupe de côlon de souris). Lors de la progression tumorale, CEACAM1 y est sous-exprimée. À l’inverse, CEACAM1 apparait surexprimée dans les cellules endothéliales (immunofluorescence de CEACAM1 (rouge) sur cellules endothéliales primaires de poumons). Ces deux processus agissent en synergie pour activer l’angiogenèse. |
|
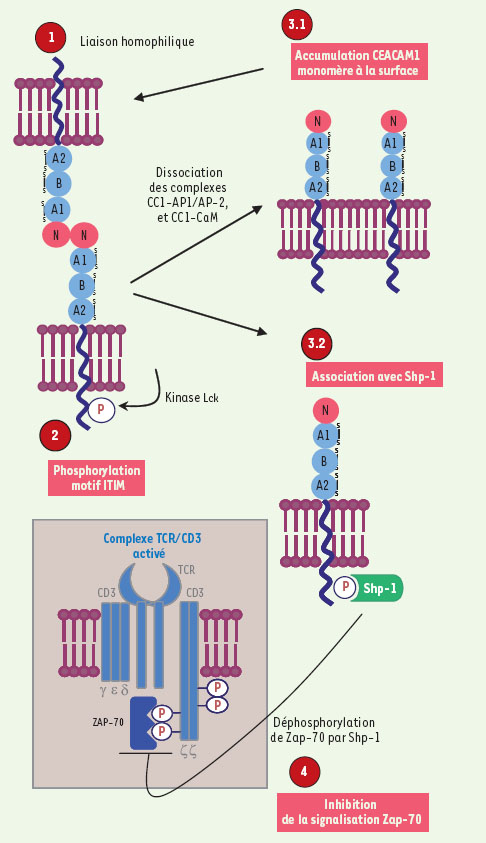
Plusieurs études chez l’homme et la souris définissent CEACAM1-L comme un puissant inhibiteur de la signalisation du complexe récepteur des lymphocytes T (TCR). Premièrement, CEACAM1 est rapidement surexprimée à la surface des lymphocytes T après activation du complexe TCR par des cytokines telles l’IL-2 [
27]. Les lymphocytes T présents dans le côlon surexpriment également CEACAM1 lors de l’inflammation de l’intestin [
28]. Par ailleurs, les souris transgéniques surexprimant CEACAM1-4L spécifiquement dans les lymphocytes T présentent une prolifération des lymphocytes T et une production d’IL-2 diminuées. À l’inverse, la suppression spécifique de CEACAM1 dans des cellules T entraîne une prolifération accrue des lymphocytes T, ainsi qu’une augmentation de la production d’IL-2 et d’interféron γ. CEACAM1-L surexprimée à la surface des lymphocytes T inhibe la capacité qu’ont les cellules T naïves d’induire l’inflammation du côlon [27]. Ces observations pourraient avoir une traduction thérapeutique dans le traitement des maladies inflammatoires de l’intestin. Par ailleurs, le mécanisme d’inhibition de la signalisation du complexe TCR par CEACAM1 implique le domaine cytoplasmique et le motif ITIM de CEACAM1-L, ainsi que le recrutement de la phosphatase SHP-1 (Figure 3). Cette fonction inhibitrice de CEACAM1-L serait amorcée par une liaison homophilique provoquant la phosphorylation du motif ITIM via la kinase Lck, suivie rapidement de l’association avec Shp-1. Cette association faciliterait le recrutement de SHP-1 dans le complexe TCR/CD3, induisant la déphosphorylation de la protéine Zap-70, kinase essentielle à l’activation du complexe. L’activation des voies de signalisation en aval de Zap-70 serait alors fortement inhibée [
29]. S’ajoute à ce mécanisme l’intervention d’autres partenaires. En effet, dans les lymphocytes T non activés, CEACAM1 semble être exprimée à un degré basal sous forme de dimères et rapidement recyclée dans les radeaux lipidiques via son interaction avec les molécules adaptatrices AP-1 et AP-2. Après l’activation du complexe TCR, la phosphorylation du motif ITIM scinderait cette association permettant l’accumulation de CEACAM1 à la surface des lymphocytes. Enfin, la dissociation de l’interaction calmoduline-CEACAM1 par suite de l’activation du complexe TCR accompagnée d’une variation du taux calcique intracellulaire, modulerait l’équilibre monomère/dimère de CEACAM1. L’augmentation de CEACAM1 sous forme de monomères faciliterait ainsi les liaisons homophiliques aux lymphocytes T adjacents [2]. 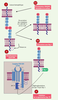 | Figure 3.
Inhibition de la signalisation du complexe TCR par CEACAM1. La liaison homophilique provoque la phosphorylation du motif ITIM de CEACAM1 via la kinase Lck, suivie rapidement de l’association avec Shp-1. Cette association facilite le recrutement de SHP-1 dans le complexe TCR/CD3, induisant la déphosphorylation de la protéine Zap-70, kinase essentielle à l’activation du complexe. |
Bien que la plupart des études concernant CEACAM1 dans l’immunité portent sur les lymphocytes T, CEACAM1-L semble avoir un rôle inhibiteur équivalent dans les lymphocytes B. Cet effet nécessite la présence de SHP-1 et SHP-2, ainsi que celle des résidus Tyr du motif ITIM de CEACAM1-L. L’expression de CEACAM1-L à la surface des cellules tueuses NK (natural killer) est également induite après activation. De façon intéressante, la surexpression de CEACAM1-L au sein de mélanomes permettrait une liaison homophilique avec une autre molécule CEACAM1 exprimée à la surface des cellules NK. Cette liaison serait alors responsable de l’inhibition de l’activité « tueuse » des cellules NK. En ce sens, CEACAM1 exercerait un rôle dans la suppression de l’immunosurveillance lors du processus de tumorigenèse [
30]. |
Ce tour d’horizon donne un aperçu des différentes activités de CEACAM1 dans le métabolisme, la progression tumorale, l’immunité et l’angiogenèse. Il illustre la grande complexité fonctionnelle de cette glycoprotéine. Tout d’abord, CEACAM1 opère différemment selon le type et le contexte cellulaires. CEACAM1 agit comme un inhibiteur dans les hépatocytes, les cellules épithéliales de côlon ou encore les lymphocytes T, mais aussi comme un puissant activateur de l’angiogenèse dans les cellules endothéliales. Le rôle de CEACAM1 dépend également du rapport des deux isoformes, de leurs différents partenaires de signalisation, ainsi que de leur localisation subcellulaire. De plus, l’équilibre entre les formes monomériques et dimériques peut affecter les réponses cellulaires. Enfin, CEACAM1 est une protéine très glycosylée. Son état de glycosylation pourrait modifier ses interactions, qu’elles soient homophiliques ou hétérophiliques. Malgré l’enrichissement de nos connaissances, les nombreuses avancées dans la compréhension des différentes fonctions de CEACAM1, son mode d’action reste donc très complexe. En revanche, la régulation de l’activité de CEACAM1 semble converger vers un point commun. En effet, en réaction à un stimulus, CEACAM1 est rapidement et de façon transitoire phosphorylée sur tyrosine par les récepteurs de l’insuline ou de l’EGF dans les cellules épithéliales ou par la kinase Lck de type Src dans les cellules hématopoïétiques. Dans le contexte des cellules endothéliales, nos résultats préliminaires (données non publiées) indiquent également l’induction d’une phosphorylation sur tyrosine après l’activation du récepteur au VEGF. CEACAM1 semble ensuite rapidement déphosphorylée par les phosphatases SHP-1 et SHP-2. Ce mécanisme de phosphorylation/déphosphorylation serait au moins en partie à la source de l’activation des voies de signalisation en aval de CEACAM1 comme l’attestent les résultats des travaux de recherche considérés dans ces pages. |
1. Beauchemin N, Draber P, Dveksler G, et al. Redefined nomenclature for members of the carcinoembryonic antigen family. Exp Cell Res 1999; 252 : 243–9. 2. Gray-Owen SD, Blumberg RS. CEACAM1: contact-dependent control of immunity. Nat Rev Immunol 2006; 6 : 433–46. 3. Létourneau S, Beauchemin N. Rôles des antigènes carcino-embryonnaires dans la cancérisation et la progression tumorale. Med Sci (Paris) 1997; 13 : 483–91. 4. Hemmila E, Turbide C, Olson M, et al. Ceacam1a−/− mice are completely resistant to infection by murine coronavirus mouse hepatitis virus A59. J Virol 2004; 78 : 10156–65. 5. Najjar SM. Regulation of insulin action by CEACAM1. Trends Endocrinol Metab 2002; 13 : 240–5. 6. Poy MN, Yang Y, Rezaei K, et al. CEACAM1 regulates insulin clearance in liver. Nat Genet 2002; 30 : 270–6. 7. Xu E. Targeted disruption of Ceacam1 promotes diet-induced hepatic steatosis and insulin resistance. Endocrinology 2009 (sous presse). 8. Formisano P, Najjar SM, Gross CN, et al. Receptor-mediated internalization of insulin. Potential role of pp120/HA4, a substrate of the insulin receptor kinase. J Biol Chem 1995; 270 : 24073–7. 9. Horst A, Wagener C. CEA-related CAMs. Hum Exp Pharmacol 2004; 165 : 283–341. 10. Simeone DM, Ji B, Banerjee M, et al. CEACAM1, a novel serum biomarker for pancreatic cancer. Pancreas 2007; 34 : 436–43. 11. Kunath T, Ordoñez-Garcia C, Turbide C, Beauchemin N. Inhibition of colonic tumor cell growth by biliary glycoprotein. Oncogene 1995; 11 : 2375–82. 12. Phan D, Cheng CJ, Galfione M, et al. Identification of Sp2 as a transcriptional repressor of carcinoembryonic antigen-related cell adhesion molecule 1 in tumorigenesis. Cancer Res 2004; 64 : 3072–8. 13. Beauchemin N, Kunath T, Robitaille J, et al. Association of biliary glycoprotein with protein tyrosine phosphatase SHP-1 in malignant colon epithelial cells. Oncogene 1997; 14 : 783–90. 14. Izzi L, Turbide C, Houde C, Kunath T, Beauchemin N. Cis-determinants in the cytoplasmic domain of CEACAM1 responsible for its tumor inhibitory function. Oncogene 1999; 18 : 5563–72. 15. Leung N, Turbide C, Balachandra B, et al. Intestinal tumor progression is promoted by decreased apoptosis and dysregulated Wnt signaling in Ceacam1−/− mice. Oncogene 2009; 27 : 4943–53. 16. Leung N, Turbide C, Olson M, et al. Deletion of the carcinoembryonic antigen-related cell adhesion molecule 1 (Ceacam1) gene contributes to colon tumor progression in a murine model of carcinogenesis. Oncogene 2006; 25 : 5527–36. 17. Liu W, Wei W, Winer D, et al. CEACAM1 impedes thyroid cancer growth but promotes invasiveness: a putative mechanism for early metastase s.
Oncogene 2007; 26 : 2747–58. 18. Obrink B. On the role of CEACAM1 in cancer. Lung Cancer 2008; 60 : 309–12. 19. Ebrahimnejad A, Streichert T, Nollau P, et al. CEACAM1 enhances invasion and migration of melanocytic and melanoma cells. Am J Pathol 2004; 165 : 1781–7. 20. Ergün S, Kilik N, Ziegeler G, et al. CEA-related cell adhesion molecule 1: a potent angiogenic factor and a major effector of vascular endothelial growth factor. Mol Cell 2000; 5 : 311–20. 21. Horst AK, Ito WD, Dabelstein J, et al. Carcinoembryonic antigen-related cell adhesion molecule 1 modulates vascular remodeling in vitro and in vivo.
J Clin Invest 2006; 116 : 1596–605. 22. Kilic N, Oliveira-Ferrer L, Wurmbach JH, et al. Pro-angiogenic signaling by the endothelial presence of CEACAM1. J Biol Chem 2005; 28 : 2361–9. 23. Müller MM, Singer BB, Klaile E, et al. Transmembrane CEACAM1 affects integrin-dependent signaling and regulates extracellular matrix protein-specific morphology and migration of endothelial cells. Blood 2005; 105 : 3925–34. 24. Tilki D, Irmak S, Oliveira-Ferrer L, et al. CEA-related cell adhesion molecule-1 is involved in angiogenic switch in prostate cancer. Oncogene 2006; 25 : 4965–74. 25. Oliveira-Ferrer L, Tilki D, Ziegeler G, et al. Dual role of carcinoembryonic antigen-related cell adhesion molecule 1 in angiogenesis and invasion of human urinary bladder cancer. Cancer Res 2004; 64 : 8932–8. 26. Kilic N, Oliveira-Ferrer L, Neshat-Vahid S, et al. Lymphatic reprogramming of microvascular endothelial cells by CEA-related cell adhesion molecule-1 via interaction with VEGFR-3 and Prox1. Blood 2007; 110 : 4223–33. 27. Nagaishi T, Pao L, Lin SH, et al. SHP1 phosphatase-dependent T cell inhibition by CEACAM1 adhesion molecule isoforms. Immunity 2006; 25 : 769–81. 28. Donda A, Mori L, Shamshiev A, et al. Locally inducible CD66a (CEACAM1) as an amplifier of the human intestinal T cell response. Eur J Immunol 2000; 30 : 2593–603. 29. Chen Z, Chen L, Qiao SW, et al. Carcinoembryonic antigen-related cell adhesion molecule 1 inhibits proximal TCR signalling by targeting ZAP-70. J Immunol 2008; 180 : 6085–93. 30. Markel G, Lieberman N, Katz G, et al. CD66a interactions between human melanoma and NK cells: a novel class I MHC-independent inhibitory mechanism of cytotoxicity. J Immunol 2002; 168 : 2803–10. |