| |
| Med Sci (Paris). 2009 April; 25(4): 341–343. Published online 2009 April 15. doi: 10.1051/medsci/2009254341.L’interleukine-21, un nouvel adjuvant contre le cancer ? Alexandre Iannello* and Ali Ahmad* Laboratoire d’immunité innée, Centre de recherche du CHU-Sainte-Justine, Département de microbiologie et immunologie, Université de Montréal, 3175, chemin de la Côte Sainte-Catherine, Montréal (Québec), H3T 1C5 Canada MeSH keywords: Animaux, Anticorps monoclonaux, Antinéoplasiques, Protocoles de polychimiothérapie antinéoplasique, Carcinomes, Essais cliniques comme sujet, Tests de criblage d'agents antitumoraux, Femelle, Humains, Immunité cellulaire, Interleukines, Lymphome B, Tumeurs expérimentales de la mamelle, Mélanome, Souris, Tumeurs |
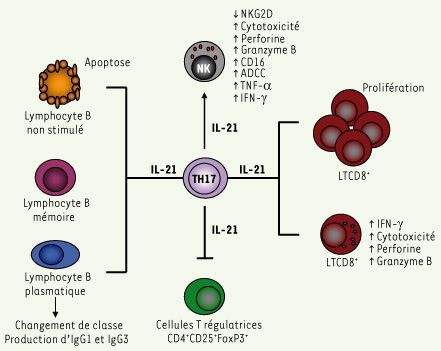
L’interleukine-21 (IL-21) est une interleukine récemment découverte faisant partie de la famille des cytokines. Le récepteur de l’IL-21 est un hétérodimère entre IL-21R et la chaîne commune γ, cette dernière étant également partagée par les récepteurs de plusieurs interleukines, IL-2, 4, 7, 9 et 15. L’IL-21 est principalement produite, chez la souris comme chez l’humain, par les lymphocytes T CD4+ activés et les cellules TH17. Elle a de multiples fonctions dans le système immunitaire (Figure 1) [
1]. Le rôle des cytokines dans le système immunitaire, et leur répercussion sur le développement des cancers ont amené les chercheurs à essayer d’en bloquer l’action, comme c’est le cas pour l’IL-6 [
2], ou à les utiliser en tant qu’agents thérapeutiques dans le cas de l’IL-2 [
3]. Récemment, de nombreuses études portant sur la biologie de l’IL-21, et des études précliniques convaincantes réalisées sur des modèles murins, ont permis aux scientifiques de commencer des essais cliniques chez l’homme utilisant l’IL-21 seule ou en combinaison avec d’autres agents thérapeutiques anticancéreux.  | Figure 1.
Effets majeurs de l’IL-21 sur les cellules du système immunitaire. L’IL-21 est sécrétée principalement par les lymphocytes T CD4+ activés et les cellules TH17. Elle entraîne la maturation des cellules NK et augmente leur activité cytotoxique contre les cellules tumorales. L’IL-21 augmente la prolifération des lymphocytes T CD8+ (LTCD8+) ainsi que leur activité cytotoxique contre leurs cibles. L’IL-21 inhibe l’activité des cellules T régulatrices dont l’un des rôles est de contenir la réponse anti-tumorale et spécialement la prolifération des LTCD8+. En l’absence de stimulation, l’IL-21 provoque l’apoptose des lymphocytes B. Cependant, cette cytokine permet la différenciation de cellules B naïves en lymphocytes B mémoires et en cellules plasmatiques après leur interaction avec un lymphocyte T et une stimulation qui fait intervenir CD40 et son ligand CD40L. L’IL-21 peut aussi promouvoir le changement de classe des immunoglobulines - anticorps et augmenter la production d’anticorps de type IgG1 et IgG3 qui permettent l’opsonisation des cellules cancéreuses. Cette opsonisation entraîne leur élimination par les macrophages et favorise le fonctionnement du mécanisme d’ADCC médié par les cellules natural killer.
|
|
Études précliniques utilisant l’IL-21 Ses effets sur la stimulation des cellules Natural Killer (NK) et des lymphocytes T CD8+ (LTCD8+) justifient l’utilisation depuis peu de temps de l’IL-21 à des fins thérapeutiques contre différents types de cancers. En effet, de nombreux groupes ont montré dans des études indépendantes que la transfection de l’ADNc codant pour l’IL-21 dans des cellules tumorales murines (issues de cancer du côlon, de mélanome, de fibrosarcome, de cancer mammaire, de cancer de la vessie, de gliome, de carcinome rénal et de neuroblastome) ralentit leur croissance ou entraîne le rejet total de ces tumeurs [
4]. De plus, une stratégie vaccinale, via l’injection de cellules tumorales exprimant l’IL-21 et irradiées dans un modèle murin d’adénocarcinome mammaire, a démontré un allongement de la survie de ces souris [
5]. Des résultats identiques sur la réduction de la croissance tumorale et la survie des souris ont été obtenus dans les modèles B16 de mélanome ou de fibrosarcome, en présence d’un plasmide codant pour l’IL-21 [
7]. La présence d’IL-21 favorise aussi le transfert adoptif de LTCD8+ tumoraux spécifiques dans le modèle murin de mélanome B16, retardant la croissance de la tumeur avant son élimination [
6], ou dans le modèle murin de thymome EG.7 [7]. |
L’IL-21 seule ou en combinaison ? L’utilisation combinée de l’IL-21 et d’anticorps dirigés contre des cibles tumorales fait également l’objet d’études. La présence d’IL-21 associée au Trastuzumab (anti-HER2, human epidermal growth factor receptor) pour le cancer du sein, au Rituximab (anti-CD20, cluster of differentiation 20) pour les lymphomes ou au Cetuximab (anti-récepteur de l’EGF, epidermal growth factor) pour le cancer du côlon entraîne une augmentation de la cytotoxicité cellulaire dépendante d’anticorps (ADCC : antibody dependent cell cytotoxicity) accompagnée de la sécrétion d’IFN-γ (interferon-γ) et de TNF-α (tumor necrosis factor-α) [
9]. In vivo, le traitement de souris inoculées avec des cellules cancéreuses murines surexprimant le récepteur humain HER2, avec de l’IL-21 associée à l’anticorps 4D5 (anti-HER2 humain) a permis de ralentir la croissance de la tumeur [
10]. Des résultats similaires ont été obtenus avec l’association Cetuximab et IL-21 dans un modèle expérimental utilisant des cibles tumorales surexprimant le récepteur à l’EGF [10]. Non seulement l’IL-21 active la réponse anti-tumorale relayée par les cellules NK et les LTCD8+, mais, de plus, elle peut aussi avoir un effet anti-tumoral direct sur les cellules cancéreuses de type lymphocytaire. L’IL-21 induit l’apoptose de cellules de leucémie lymphocytaire chronique (LLC) et augmente l’efficacité de l’ADCC en présence du Rituximab [
11]. Cette cytokine provoque l’apoptose de cellules provenant de lymphomes B non-hodgkiniens (LCBNH), réduit la prolifération de cellules de lymphomes diffus à grandes cellules B (LDGCB) et déclenche l’apoptose des cellules primaires de lymphomes de types LLC et LDGCB [
12,
13]. Cependant, chez les patients atteints de Sézary (forme généralisée d’une prolifération lymphoïde T cutanée), l’IL-21 n’entraîne pas l’apoptose de cellules T provenant de lymphomes cutanés ni celle des cellules malignes circulantes [
14,
15]. |
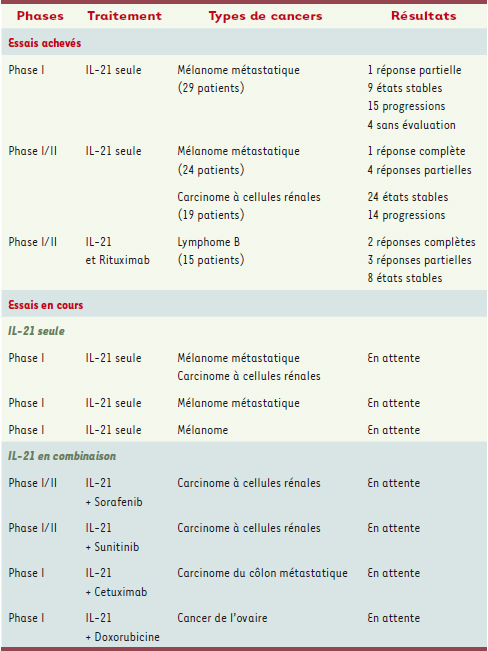
Des essais cliniques prometteurs Ces études précliniques convaincantes ont stimulé le développement d’essais cliniques chez l’homme (Tableau 1). À ce jour, trois essais cliniques de phase I/II ont été réalisés en Australie et aux États-Unis. Les deux premiers ont porté sur le mélanome métastatique et le « carcinome à cellules rénales ». Le troisième essai clinique a associé IL-21 et Rituximab dans le lymphome B non hodgkinien. L’étude de phase I dans le mélanome métastatique incluait 29 patients, dont 25 ont pu être évalués : une stabilisation de la maladie a été obtenue chez 9 d’entre eux, et une réponse partielle caractérisée par une baisse de la taille et de la progression des tumeurs chez un patient. Le deuxième essai clinique a porté sur 24 patients atteints de mélanome métastatique et 19 ayant un carcinome à cellules rénales. Le traitement a induit une réponse complète chez les patients atteints de mélanome et 4 réponses partielles dans les cas de cancer du rein. Dans la troisième étude, l’association de l’IL-21 et du Rituximab chez 15 patients une des rechute de lymphome B a permis d’obtenir deux réponses complètes caractérisées par une disparition totale des tumeurs dans l’organisme, 3 réponses partielles, ainsi que 8 stabilisations.  | Tableau I.
Essais cliniques achevés et en cours utilisant l’IL-21. Le Sorafenib et le Sunitinib sont des inhibiteurs « multicibles » des récepteurs à tyrosine kinase administrés par voie orale. La doxorubicine est un agent intercalant l’ADN qui inhibe la topo-isomérase II. |
De nouveaux essais cliniques sont en cours avec l’IL-21 seule ou en combinaison avec d’autres agents (Tableau 1). Deux cytokines, l’IL-2 et l’IFN-α, sont déjà utilisées dans le traitement du mélanome métastatique et du carcinome à cellules rénales, mais elles induisent une réponse antitumorale faible et l’IL-2 s’avère toxique à long terme lorsqu’elle est utilisée aux doses efficaces sur le plan tumoral. Le traitement par l’IL-2 entraîne en effet un syndrome hémorragique vasculaire qui produit des œdèmes interstitiels et provoque la défaillance d’organes comme les poumons et le cœur. L’IL-21 est, quant à elle, considérablement moins toxique que l’IL-2 pour une efficacité anti-tumorale au moins équivalente sinon supérieure, permettant donc d’envisager son utilisation seule ou associée à d’autres agents thérapeutiques, si ces premières données se confirment dans d’autres essais cliniques. L’IL-21 semble donc à ce jour être la seule cytokine dotée de propriétés antitumorales efficaces, notamment vis-à-vis des cellules B malignes, et dont la toxicité est acceptable, aucun effet secondaire mortel ou sévère n’ayant été rapporté à ce jour. Récemment, notre groupe de recherche a démontré un taux faible d’IL-21 circulante chez les patients infectés par le VIH (virus de l’immunodéficience humaine) développant un SIDA (syndrome d’immunodéficience acquise), et une corrélation positive entre l’absence d’IL-21 et la progression vers un SIDA [
16]. De plus, nos donnés expérimentales attestent un effet bénéfique de l’IL-21 sur la réponse antivirale relayée par les cellules NK et les LTCD8+. Cette cytokine représente donc l’un des agents immunothérapeutiques les plus prometteurs et les essais cliniques en cours apporteront de précieuses informations sur son efficacité dans le traitement de patients atteints de cancer ou de pathologies associées à des virus ou à des bactéries. |
1. Spolski R, Leonard WJ. Interleukin-21 : basic biology and implications for cancer and autoimmunity. Ann Rev Immunol 2008; 26 : 57–79. 2. Gougelet A, Mansuy A, Blay J. De l’eau au moulin de thérapies ciblant l’interleukine-6 dans les tumeurs épithéliales. Med Sci (Paris) 2008; 24 : 694–6. 3. Kirkwood JM, Tarhini AA, Panelli MC, et al. Next generation of immunotherapy for melanoma. J Clin Oncol 2008; 26 : 3445–55. 4. Andorsky DJ, Timmerman JM. Interleukin-21 : biology and application to cancer therapy. Exp Opin Biol Ther 2008; 8 : 1295–307. 5. Comes A, Rosso O, Orengo AM, et al. CD25+ regulatory T cell depletion augments immunotherapy of micrometastases by an IL-21-secreting cellular vaccine. J Immunol 2006; 176 : 1750–8. 6. Zeng R, Spolski R, Finkelstein SE, et al. Synergy of IL-21 and IL-15 in regulating CD8+ T cell expansion and function. J Exp Med 2005; 201 : 139–48. 7. Wang G, Tschoi M, Spolski R, et al.
In vivo antitumor activity of interleukin 21 mediated by natural killer cells. Cancer Res 2003; 63 : 9016–22. 8. Moroz A, Eppolito C, Li Q, et al. IL-21 enhances and sustains CD8+ T cell responses to achieve durable tumor immunity : Comparative evaluation of IL-2, IL-15, and IL-21. J Immunol 2004; 173 : 900–9. 9. Skak K, Kragh M, Hausman D, et al. Interleukin 21 : combination strategies for cancer therapy. Nat Rev Drug Discov 2008; 7 : 231–40. 10. Roda JM, Joshi T, Butchar JP, et al. The activation of natural killer cell effector functions by cetuximab-coated, epidermal growth factor receptor positive tumor cells is enhanced by cytokines. Clin Cancer Res 2007; 13 : 6419–28. 11. Gowda A, Roda J, Hussain SRA, et al. IL-21 mediates apoptosis through up-regulation of the BH3 family member BIM and enhances both direct and antibodydependent cellular cytotoxicity in primary chronic lymphocytic leukemia cells in vitro. Blood 2008; 111 : 4723–30. 12. Akamatsu N, Yamada Y, Hasegawa H, et al. High IL-21 receptor expression and apoptosis induction by IL-21 in follicular lymphoma. Cancer Lett 2007; 256 : 196–206. 13. Sarosiek K, Chen J, Pham DG, et al. Interleukin-21-induced apoptosis and cell death of diffuse large-B cell lymphoma (DLBCL) cell lines and primary tumors are associated with an induction of Bim. ASH Annual Meeting. Blood 2006; 108 (suppl) : 2503 (abstract). 14. Marzec M, Halasa K, Kasprzycka M, et al. Differential effects of interleukin-2 and interleukin-15 versus interleukin-21 on CD4+ cutaneous T-cell lymphoma cells. Cancer Res 2008; 68 : 1083–91. 15. Yoon J, Newton S, Wysocka M, et al. IL-21 enhances antitumor responses without stimulating proliferation of malignant T cells of patients with Sézary syndrome. J Invest Dermatol 2008; 128 : 473–80. 16. Iannello A, Tremblay C, Routy J, et al. Decreased levels of circulating IL-21 in HIV-infected AIDS patients : Correlation with CD4+ T cell counts. Viral Immunol 2008; 21 : 385–8. |