| |
| Med Sci (Paris). 2009 May; 25(5): 457–460. Published online 2009 May 15. doi: 10.1051/medsci/2009255457.L’expression de l’hémoglobine fœtale est sous le contrôle du répresseur BCL11A
Dominique Labie* Département de génétique, développement et pathologie moléculaire, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Protéines de transport, Cellules cultivées, Érythroblastes, Érythropoïèse, Exons, Hémoglobine foetale, Régulation de l'expression des gènes au cours du développement, Globines, Humains, Protéines nucléaires, Polymorphisme de nucléotide simple, Protéines de répression |
Signification du taux d’hémoglobine fœtale L’expression de différentes hémoglobines (Hb) au cours du développement ontogénique correspond à l’activation successive des gènes codant pour les chaînes de globine, situés sur le chromosome 11p15 dans l’ordre de leur expression1. Au niveau du locus β-globine, deux commutations (switch) sont observées : la première, précoce au cours de la vie embryonnaire, correspond à l’activation des gènes γ-globine ; la seconde, périnatale, correspond à l’extinction incomplète de ces derniers et à l’activation des gènes adultes δ- et β-globine. Ce switch a fait l’objet de multiples travaux ; c’est, en effet, un modèle d’étude, mais son importance physiopathologique est majeure, car le taux d’Hb fœtale (HbF) est un élément essentiel modulant la gravité des hémoglobinopathies, drépanocytose et β-thalassémies. Ce taux d’HbF se présente en clinique comme un trait quantitatif dont on a cherché les facteurs de régulation. Dans un nombre limité de cas, on a observé l’existence concomitante d’une PHHF (hereditary persistance of fetal hemoglobin) de transmission mendélienne. Deux types de PHHF ont été caractérisés, soit des délétions impliquant tout ou partie du gène β-globine, soit des mutations (le plus souvent ponctuelles) dans la région promotrice de l’un des gènes γ-globine. L’existence d’une distribution inégale de l’HbF résiduelle dans la population adulte générale a aussi été établie depuis les années 1950 avec, dans 10 % de la population environ, un taux d’HbF supérieur à 0,7 % (0,8 à 5 %) (phénotype appelé PHHF de type suisse, Swiss-type HPFH). La majorité des recherches a, cependant, porté sur les taux plus ou moins élevés d’HbF au cours d’hémoglobinopathies majeures, drépanocytose, β-thalassémies, dont ils peuvent modifier l’expression phénotypique. La régulation en est distincte de celle de l’hémoglobinopathie en cause, et se présente souvent comme indépendante de l’ensemble du locus β-globine. Un certain nombre de travaux ont donc cherché à mettre en évidence l’association entre un taux élevé d’HbF et différents polymorphismes. |
Association entre polymorphismes génétiques et taux d’HbF Un SNP (single nucleotide polymorphism) C/T a été constaté dès 1985 à -158 en 5’ du gène Gγ, les taux élevés d’HbF étant statistiquement associés au variant T [
1,
2]. Ce SNP a toujours été retrouvé, sans qu’on en ait jamais démontré une valeur fonctionnelle propre. De nombreuses exceptions suggèrent aussi l’existence de facteurs additionnels. Outre ce SNP situé en cis, plusieurs QTL (quantitative trait locus) situés sur d’autres chromosomes ont été décrits dont l’association est statistique avec les taux élevés d’HbF ou de cellules F, dont la mesure est plus précise en cas de taux faible. Dans une série de sujets drépanocytaires, on a identifié un site en Xp22.2-22.3 [
3]. On a aussi décrit un QTL situé sur le chromosome 8q [
4], mais dans ce cas comme dans le précédent, une localisation précise n’a pas pu être établie. Deux autres QTL semblent plus informatifs. L’étude sur quatre générations d’une grande famille indienne a révélé un QTL en 6q23, localisé entre les gènes HBS1L et c-MYB, qu’on a appelé polymorphisme intergénique HBS1L-MYB (HMIP) [
5]. La recherche sur la totalité du génome a identifié en 2p15 un polymorphisme dans l’IVS2 (intervening sequence) de l’oncogène BCL11A, codant une protéine à doigts de zinc [
6]. Ce dernier QTL a depuis lors été retrouvé dans 3 populations différentes [
7]. Il est aussi statistiquement associé à l’amélioration du phénotype β-thalassémique [
8]. On peut signaler enfin une approche un peu différente : la mise en évidence dans la région promotrice du gène β-globine d’un polymorphisme de type (AT)xTy qui fixe de façon variable un répresseur BP1 [
9]. Dans tous les cas, cependant, on n’a enregistré qu’une association entre polymorphisme, taux d’HbF et amélioration phénotypique dans les hémoglobinopathies, et aucun des travaux cités n’a établi le mécanisme moléculaire en cause. |
BCL11A, un répresseur fonctionnel du gène γ−globine Cette étape vient d’être franchie par l’équipe de S.H. Orkin du Children’s Hospital, Harvard Medical School à Boston. Dans un premier article, les auteurs avaient mis en évidence l’action synergique de trois de ces sites polymorphes dans le contrôle de l’expression de l’HbF et des crises douloureuses chez les drépanocytaires [
10]. La coexistence de 3 variants de séquence, représentant 5 SNP, sur les chromosomes 11, 6 et 2 est nécessaire pour modifier la gravité de la maladie, et permettre une évaluation pronostique, alors qu’aucun d’eux, isolé, n’est vraiment significatif. Un article paru dernièrement dans Science montre que l’expression de l’HbF est sous le contrôle d’un répresseur codé par une séquence localisée en BCL11A, dont l’expression varie au cours du développement [
11]. Le variant BCL11A, situé dans le second intron du gène, est, en effet, celui dont l’effet est le plus important. Ce gène BCL11A avait été étudié au cours du développement lymphocytaire ; il avait été montré qu’en raison d’épissages alternatifs il est traduit en 4 isoformes de longueur différente, XL, L, S et XS, dont l’extrémité amino-terminale est conservée [
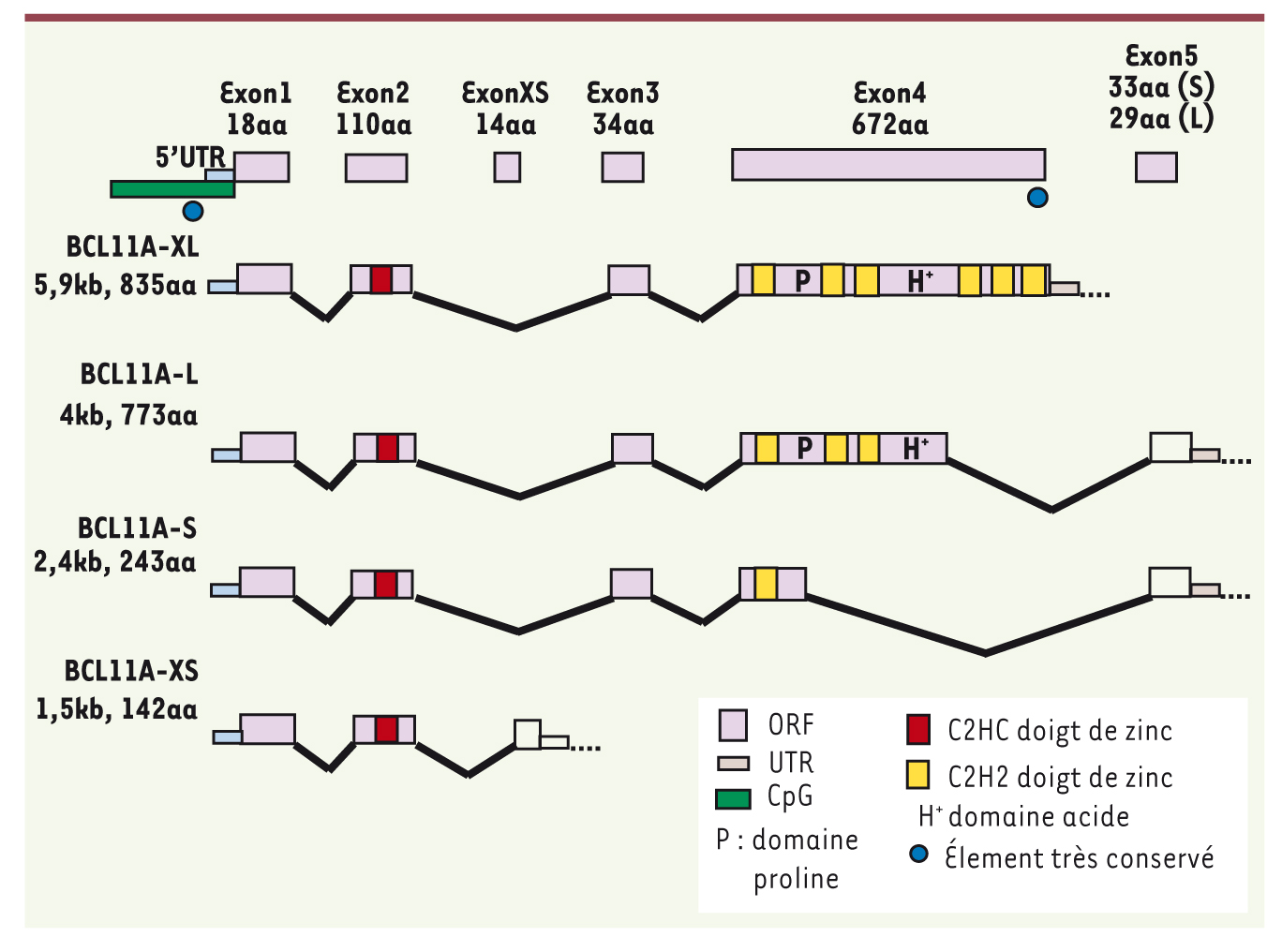
12] (Figure 1). Le travail actuel s’est orienté vers son devenir dans la lignée érythrocytaire.  | Figure 1.
Représentation des quatre isoformes de BCL11A par suite d’un épissage alternatif. La séquence amino-terminale est la même dans toutes les formes (d’après [ 12]). |
|
Variants ontogéniques de BCL11A Partant des variations de l’HbF à l’état physiologique selon les individus et les populations, et dans le cadre physiopathologique des hémoglobinopathies, les auteurs ont fait l’hypothèse d’une action transcriptionnelle variable de BCL11A. Dans les cultures de progéniteurs et précurseurs érythroïdes adultes, ils ont constaté l’expression, au niveau ARN et protéine, des deux isoformes longues XL et L. Les travaux cités précédemment [6, 8] avaient permis de localiser un SNP A/G (r4671393) par sa forte association au taux de l’HbF. L’étude systématique de ce variant dans des lignées cellulaires érythroïdes a confirmé, pour les deux isoformes, des variations importantes entre les individus : les transcrits de BCL11A varient en sens inverse du taux d’HbF, l’allèle associé à un taux bas d’HbF est exprimé à un taux supérieur (x 3,5). Dans les cellules de la lignée érythroleucémique K562 (issue d’un patient adulte en phase blastique d’une LMC [leucémie myéloïde chronique] porteur de la fusion bcr-abl), les auteurs ont été surpris de constater la quasi-absence des isoformes longues, et la seule présence des variants courts. Afin de savoir si ce fait était un reflet de l’expression par les cellules Hb embryonnaires ou reflétait le caractère malin des cellules K562, ils ont poursuivi l’étude sur des cellules érythroïdes isolées à divers stades ontogéniques : moelle osseuse adulte, foie fœtal au second trimestre de gestation, et érythroblastes immatures présents dans la circulation maternelle durant le premier trimestre. Ils ont alors constaté que si les formes courtes ne sont détectables qu’au début du développement, les isoformes longues XL et L de BCL11a ne sont présentes que dans les érythroblastes adultes, et le taux de ces formes longues est influencé par les variations de séquence. Quel pouvait être le mécanisme en cause ? |
BCL11A réprime l’expression des gènes γ-globine dans les érythroblastes L’étude fonctionnelle a été poursuivie par un marquage à la biotine de BCL11A dans une lignée de cellules érythroleucémiques de souris, MEL, cellules n’exprimant que les globines adultes. Ce marquage permet la purification sur colonne d’avidine des complexes protéiques contenant BCL11A biotinylée. Un de ces complexes est le complexe répresseur NuRD (nucleosome remodeling and histone deacetylase) lié par la séquence amino-terminale ; un complexe BCL11B/NuRD a déjà été observé dans des lymphocytes B et T [
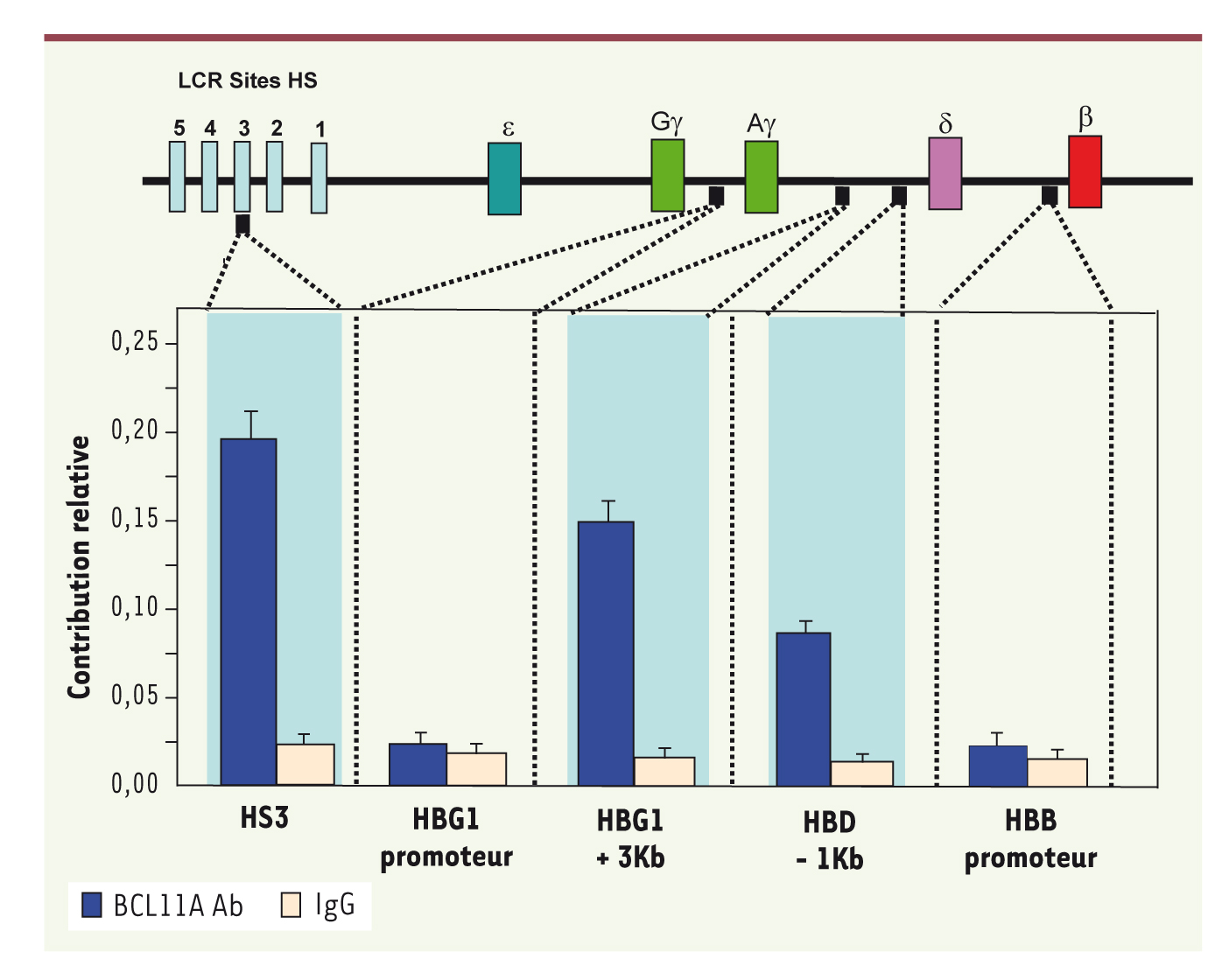
13]. BCL11A s’associe aussi avec la protéine de la matrice nucléaire matrine-3, ainsi qu’avec des peptides de GATA-1, principal facteur de transcription érythroïde, et son cofacteur FOG-1 (Friend of Gata). L’ensemble des données génétiques, développementales et biochimiques suggérait un rôle de BCL11A dans l’extinction des gènes γ-globine, et les auteurs ont entrepris de tester cette hypothèse directement en modulant son taux dans des cellules érythroïdes primitives. De fait, l’introduction transitoire d’un ARN d’interférence (siARN) ciblant l’ARNm BCL11A à J0 de la culture, diminue la protéine de 40-45 % à J4 en même temps que le taux de l’ARN γ-globine s’élève (x 2,3) à J7 ; l’effet est moindre si le siARN est utilisé plus tardivement. En comparant par microarrays les gènes exprimés avant et à 7 jours après le traitement par siARN spécifique ou par un contrôle non spécifique, les auteurs ont exclu toute interférence de BCL11A avec le processus de différenciation des cellules, et montré une action du siARN BCL11A restreinte à la répression du gène γ-globine. Une réduction plus durable de l’expression de BCL11A via l’expression permanente d’un ARN simple brin en épingle à cheveux (shARN) ciblant l’expression de BCL11A entraîne une élévation très supérieure du taux d’HbF à J7, qui peut être isolée par HPLC, alors qu’elle est indétectable dans la culture témoin. L’effet quantitatif comparé obtenu par siARN et shARN a permis aux auteurs de parler d’un effet de « rhéostat moléculaire » contrôlant l’extinction des gènes γ-globine. Une dernière question enfin : s’agit-il d’une interaction directe de BCL11A avec des éléments régulateurs en cis du locus β-globine ou d’une action sur le cycle cellulaire ou quelque autre signal indirect ? Ce problème a été abordé par les techniques d’immuno-précipitation de chromatine (ChIP) dans des cultures de cellules primaires. Aucune interaction n’est trouvée avec les promoteurs γ- et β-globine, mais, en revanche, plusieurs zones de forte liaison sont identifiées sur l’ensemble du locus (Figure 2). On les trouve entre autres au niveau du HHS3 (hypersensitive site) du LCR (locus control region), ainsi qu’en différents points, en amont du gène δ-globine, en aval du gène Aγ-globine… Il est remarquable que tous ces éléments en cis ont, à une occasion ou une autre, été impliqués dans l’extinction des gènes γ-globine. Une compréhension complète devrait requérir une localisation précise de BCL11A et de ses protéines partenaires au niveau de la chromatine. On peut, cependant, supposer que les formes courtes (S et XS), seules présentes en début de différenciation dans les cellules exprimant abondamment l’HbF, ont aussi d’autres rôles dans la régulation transcriptionnelle et que BCL11A intervient pour reconfigurer la chromatine au cours du développement.  | Figure 2.
Étude par ChIP de la fixation de BCL11A dans différentes régions du locus β-globine. On voit qu’aucune liaison spécifique n’est retrouvée au niveau du promoteur Aγ ou du promoteur β. Le contrôle est la fixation d’une immunoglobuline. En revanche, la liaison est très nette au niveau de HS3, d’une zone située en 3’ de Aγ et d’une autre en 5’ de δ (d’après [ 10]). |
|
Le développement ontogénique de l’Hb a été considéré comme paradigmatique du développement d’autres gènes. On observe sa régulation par un répresseur BCL11A, lui-même modulé au cours de l’ontogénie, les isomères longs XL et L, d’expression tardive interagissant avec le complexe répresseur NuRD, GATA-1 et FOG-1 pour éteindre le gène γ-globine. La question se pose évidemment d’y voir une cible thérapeutique possible pour l’activation des gènes γ-globine au cours des β-hémoglobinopathies. L’expression de BCL11A pourrait-elle aussi fournir l’explication d’une expression phénotypique atypique de certains cas d’hémoglobinopathies ? On sait l’existence de drépanocytoses totalement asymptomatiques présentant un taux élevé d’HbF. On observe aussi des patients atteints de β-thalassémie dont le défaut moléculaire devrait se traduire par une maladie grave, et qui mènent une vie normale avec un taux d’HbF de 10 à 15 g/dL [
15]. Peut-on supposer qu’en présence d’un déficit majeur du gène β-globine l’absence des isoformes longues de BCL11A, ou un variant inactif, associé au SNP C/T sur le chromosome 11, interviendrait en amplifiant la synthèse des chaînes γ-globine ? Cette observation conforterait la perspective d’une thérapeutique ciblée. |
1. Labie D, Dunda-Belkhodja O, Rouabhi F, et al. The - 158 site 5’ to the Gγgene and Gγ expression. Blood 1985; 66 : 1463–5. 2. Gilman JG, Huisman THJ. DNA sequence variation associated with elevated Gγ globin production. Blood 1985; 66 : 783–7. 3. Dover GJ, Smith KD, Chang YC. Fetal hemoglobin levels in sickle cell disease and normal individuals are partially controlled by an X-linked gene located at Xp22.2. Blood 1992; 80 : 816–24. 4. Garner C, Silver N, Best S, et al. Quantitative trait locus on chromosome 8q influences the switch from fetal to adult hemoglobin. Blood 2004; 104 : 2184–6. 5. Thein SL, Menzel S, Peng X, et al. Intergenic variants of HBS1L-MYB are responsible for a major quantitative trait locus on chromosome 6q23 influencing fetal hemoglobin levels in adults. Proc Natl Acad Sci USA 2007; 104 : 11046–51. 6. Menzel S, Garney C, Gut I, et al. A QTL influencing F cell production maps to a gene encoding a zinc-finger protein on chromosome 2p15. Nat Genet 2007; 39 : 1197–9. 7. Sedgewick AE, Timofeev N, Sebastiani P, et al. BCL11A is a majorHbF quantitative trait locus in three different populations with b-hemoglobinopathies. Blood Cells Mol Dis 2008; 41 : 255–8. 8. Uda M, Galanello R, Sanna S, et al. Genome-wide association study shows BCL11A associated with persistent fetal hemoglobin and amelioration of the phenotype of β-thalassemia. Proc Natl Acad Sci USA 2008; 105 ; 1620–5. 9. Elion J, Berg PE, Lapoumeroulie C, et al. DNA sequence variation in a negative control region 5’ to the β-globin gene correlates with the phenotypic expression of the βS mutation. Blood 1992; 79 : 787–92. 10. Lettre G, Sankaran VG, Bezerra MAC, et al. DNA polymorphisms at the BCL11A, HBS1L-MYB and β-globin loci associate with fetal hemoglobin levels and pain crises in sickle cell disease. Proc Natl Acad Sci USA 2008; 105 : 11869–74. 11. Sankaran VG, Menne TF, Xu J, et al. Human fetal hemoglobin expression is regulated by the developmental stage-specific repressor BCL11A. Science 2008; 322 : 1839–42. 12. Liu H, Ippolito GC, Wall JK, et al. Functional studies of BCL11A : characterization of the conserved BCL11A-XL splice variant and its interaction with BCL6 in nuclear paraspeckles of germinal center B cells. Mol Cancer 2006; 5 : 18–33. 13. Cismastu VB, Adamo S, Gecewicz J, et al. BCL11B functionally associates with the NuRD complex in T lymphocytes to repress targeted promoter. Oncogene 2005; 24 : 6753–64. 14. Moffat J, Grueneberg DA, Yang X, et al. A lentiviral RNAi library for human and mouse genes applied to an arrayed viral high-content screen. Cell 2006; 124 : 1283–98. 15. Ragusa A, Amata S, Lombardo T, et al. Asymptomatic and mild β-thalassemia in homozygotes and compound heterozygotes for the IVS2+1G>A mutation : role of the β-globin gene haplotype. Haematologica 2003; 88 : 1099–105. |