| |
| Med Sci (Paris). 2009 June; 25(6-7): 557–559. Published online 2009 June 15. doi: 10.1051/medsci/2009256-7557.Les nouveaux partenaires de la ferritine Lydie Viatte* Département Endocrinologie, métabolisme et cancer, Inserm U567, Université Paris Descartes, Faculté de Médecine René Descartes, CNRS, UMR-S 8104, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Animaux, Ferritines, Humains, Fer, Mâle, Mitochondries, Néovascularisation physiologique, Tumeurs de la prostate, Transferrine |
La ferritine, deuxième protéine cristallisée - en 1937 - ne semblait plus avoir de secret à révéler. Protéine de stockage du fer, elle est composée de 24 sous-unités de chaînes légères (L pour light) ou chaînes lourdes (H pour heavy) et permet de séquestrer jusqu’à 4 500 atomes de fer dans le cytoplasme des cellules [
1]. Le fer, lié à la transferrine (ou holotransferrine, holoTf), est capté par les cellules via le récepteur de la transferrine (RTf1) situé à la surface des cellules [
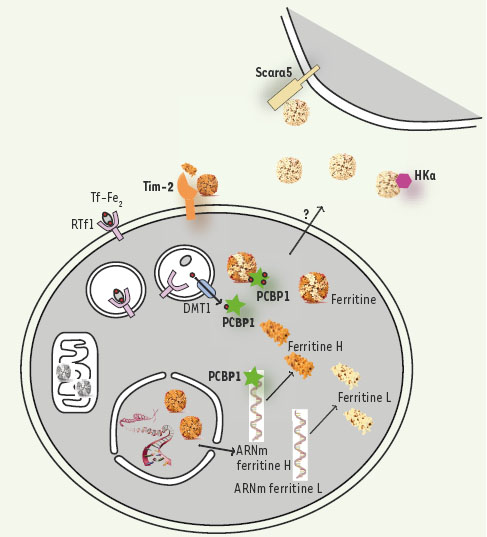
9]. Le complexe RTf1-holoTf est ensuite endocytosé et le fer relargué dans le cytoplasme par le transporteur DMT1 (divalent metal transporter 1). La ferritine permet de protéger la cellule du fer importé dans le cytosol qui, bien que vital, s’avère toxique lorsqu’il est sous forme soluble. Le fer catalyse en effet la réaction de Fenton qui produit des radicaux libres. Jusqu’à récemment, on ne savait pas ce que devenait le fer entre le moment de son transport par DMT1 et son stockage dans la ferritine.  | Figure 1.
Le fer lié à la transferrine (Tf-Fe2) est capté par le récepteur de la transferrine (RTf1) exprimé à la surface des cellules. Après endocytose, le fer est transporté dans le cytosol par DMT1 (divalent metal transporter 1). Dans le cytosol, la ferritine est composée de 24 sous-unités H et L. La traduction de la ferritine H est régulée par PCBP1 (Poly(rC)-binding protein 1). PCBP1, également chaperonne cytosolique du fer, livre le fer à la ferritine qui le stocke. On retrouve également de la ferritine, essentiellement H, dans le noyau où elle protège l’ADN des effets toxiques du fer, et la forme mitochondriale est représentée en gris. Tim-2 (T-cell immunoglobulin-domain and mucin-domain-2) est le récepteur de la ferritine H probablement sécrétée localement, alors que Scara5 est capable de lier la ferritine L circulante. La ferritine peut interagir avec HKa (2-chain high molecular weight) et inhiber ses effets anti-angiogéniques (sur le schéma seule la forme L est représentée se liant à HKa). |
|
Une nouvelle chaperonne du fer Alors que la majorité des cellules eucaryotes utilisent la ferritine pour stocker le fer dans leur cytoplasme, les levures n’expriment pas de ferritine ni d’équivalent de la ferritine. Shi et al. ont tiré parti de cette singularité ; si on leur apportait des ferritines humaines, ces levures n’étaient pas capables de se charger en fer. Les auteurs ont supposé qu’il manquait à ces cellules un partenaire essentiel pour la livraison du fer à la ferritine ; l’hypothèse était exacte et les a conduits à identifier une nouvelle chaperonne du fer, PCBP1 (Poly(rC)-binding protein 1), connue pour se lier à l’ARN [
2]. L’étude de Shi et al. a révélé que cette protéine pouvait lier trois atomes de fer et les apporter à la ferritine, qu’elle pouvait interagir avec celle-ci et que son inhibition conduisait à une accumulation du fer dans le cytosol de cellules dérivées d’une tumeur hépatique humaine. Jusqu’à présent, une seule chaperonne du fer, la frataxine, avait été identifiée, mais dans la mitochondrie ; c’est la première fois qu’une telle chaperonne cytosolique est décrite. Au-delà de son rôle de « livreur » de fer pour le stockage, elle permet de protéger la cellule du fer soluble toxique. De façon très intéressante, des études antérieures avaient montré que PCBP1 pouvait se lier à des séquences régulatrices de l’ARNm de la ferritine H [
3]. Les auteurs de cette étude proposaient un rôle de PCBP1 dans la régulation par le fer et l’IL (interleukine)-1 β de la traduction de la ferritine H. Cependant, la déplétion en PCBP1 dans des cellules d’hépatome ne semble pas influencer les niveaux de ferritine [2], ce qui peut être expliqué par la faible quantité dans ces cellules de la forme H de la ferritine par rapport à la forme L, ce qui pourrait masquer l’effet de la déplétion en PCBP1. Une étude approfondie des deux rôles de PCBP1 et de leur spécificité par rapport aux différentes formes de la ferritine reste à faire. |
Scara5, un récepteur pour la ferritine circulante Mais la ferritine n’est pas qu’une simple protéine de stockage cytoplasmique du fer ; on la retrouve dans d’autres compartiments : le noyau, où elle pourrait protéger l’ADN des radicaux générés par le fer [
4], la mitochondrie où elle a récemment été identifiée [
5,
10]. La ferritine circule également dans le sang où l’on peut la doser, mais le mécanisme conduisant à la sécrétion de cette ferritine est peu connu. Contrairement à la ferritine cytosolique, son contenu en fer est faible. Depuis les années 1990, la ferritine a dévoilé d’autres propriétés : elle est impliquée dans la myélopoïèse, l’immunité, l’apoptose, la régulation de la traduction, la protection de l’ADN. La plupart de ces nouvelles propriétés sont attribuées à la sous-unité H plutôt que L et un récepteur pour la ferritine H a été proposé, TIM-2 (T-cell immunoglobulin-domain and mucin-domain-2) (pour revue, voir [
6]). Or la ferritine sérique est composée essentiellement de sous-unités L glycosylées, et la fonction de cette ferritine circulante restait donc une énigme. Très récemment, une équipe cherchant à identifier les molécules permettant le captage du fer lors de l’organogenèse a identifié un nouveau récepteur de la ferritine, Scara5 [
7]. Li et al. ont utilisé une stratégie innovante : des cellules souches embryonnaires dont le récepteur RTf1 avait été invalidé et qui expriment la GFP (green fluorescent protein) ont été injectées dans des embryons normaux, et le devenir des cellules fluorescentes dans les chimères a été examiné. En dépit de l’absence de récepteur à la transferrine, ces cellules ont proliféré et participé à l’organogenèse, notamment celle du rein. L’analyse du profil d’expression des cellules triées grâce à leur fluorescence a ainsi permis d’identifier que l’expression du gène Scara5 était augmentée dans les cellules n’exprimant pas RTf1. La suite du travail a permis de montrer l’interaction de Scara5 avec la ferritine (avec une préférence pour la ferritine L), authentifiant ainsi un récepteur pour la ferritine L circulante. |
Un rôle inattendu de la ferritine comme facteur pro-angiogénique Enfin, Coffman et al. ont très récemment exploré un nouveau rôle de la ferritine comme agent favorisant l’angiogenèse [
8]. On savait qu’elle pouvait interagir avec le kininogène de haut poids moléculaire (HK), cofacteur de la coagulation, mais l’observation nouvelle est que la ferritine est aussi capable de se lier à l’HKa, produit dérivé de HK, qui possède des effets antiangiogéniques. L’interaction de la ferritine avec l’HKa inactive ce dernier, favorisant l’angiogenèse, notamment dans un modèle de tumeur prostatique exogène implantée chez des souris. La ferritine, qui est induite lors de l’inflammation, pourrait ainsi contribuer au développement des tumeurs en favorisant leur vascularisation. Ce rôle inattendu ouvre des perspectives intéressantes dans le traitement de certains cancers associés à des taux élevés de ferritine. Il reste cependant à déterminer quelle forme de la ferritine possède cette propriété pro-angiogénique et le compartiment dans lequel cette interaction a lieu. La ferritine, protéine connue depuis longtemps réserve ainsi encore de nombreuses surprises et sort de son carcan cytoplasmique et de son rôle de réserve en fer pour devenir une cible thérapeutique potentiellement intéressante. |
1. Harrison PM, Arosio P. The ferritins: molecular properties, iron storage function and cellular regulation. Biochim Biophys Acta 1996; 1275 : 161–203. 2. Shi H, Bencze KZ, Stemmler TL, Philpott CC. A cytosolic iron chaperone that delivers iron to ferritin. Science 2008; 320 : 1207–10. 3. Thomson AM, Cahill CM, Cho HH, et al. The acute box cis-element in human heavy ferritin mRNA 5’-untranslated region is a unique translation enhancer that binds poly(C)-binding proteins. J Biol Chem 2005; 280 : 30032–45. 4. Surguladze N, Patton S, Cozzi A, et al. Characterization of nuclear ferritin and mechanism of translocation. Biochem J 2005; 388 : 731–40. 5. Levi S, Arosio P. Mitochondrial ferritin. Int J Biochem Cell Biol 2004; 36 : 1887–9. 6. Arosio P, Ingrassia R, Cavadini P. Ferritins: a family of molecules for iron storage, antioxidation and more. Biochim Biophys Acta 2009 (sous presse). 7. Li JY, Paragas N, Ned RM, et al. Scara5 is a ferritin receptor mediating non-transferrin iron delivery. Dev Cell 2009; 16 : 35–46. 8. Coffman LG, Parsonage D, D’Agostino R Jr, et al. Regulatory effects of ferritin on angiogenesis. Proc Natl Acad Sci USA 2009; 106 : 570–5. 9. Beaumont C. Molecular mechanisms of iron homeostasis. Med Sci (Paris) 2004; 20 : 68–72. 10. Vaulont S, Viatte L. Gene fishing in zebrafish: identification of the iron mitochondrial transporter. Med Sci (Paris) 2006; 22 : 466–8. |