| |
| Med Sci (Paris). 2009 June; 25(6-7): 578–584. Published online 2009 June 15. doi: 10.1051/medsci/2009256-7578.Biologie systémique Des concepts d’hier aux découvertes de demain Anne-Ruxandra Carvunis,1,2,3* Elisa Gomez,4 Nicolas Thierry-Mieg,3 Laurent Trilling,3 and Marc Vidal1,2* 1Center for cancer systems biology (CCSB) and Department of cancer biology, Dana-Farber Cancer Institute, 1, Jimmy Fund Way, Boston, Massachusetts 02115, États-Unis 2Department of Genetics, Harvard Medical School, 77, avenue Louis Pasteur, Boston, Massachusetts 02115, États-Unis 3TIMC-IMAG, CNRS UMR5525, Faculté de médecine, 38706 La Tronche Cedex, France 4Inserm U833, Collège de France, Chaire de médecine expérimentale, 75005 Paris, France |
La biologie systémique représente un important changement de paradigme scientifique par rapport à la biologie moléculaire des cinquante dernières années. La biologie moléculaire traditionnelle, de nature « réductionniste », s’est jusqu’ici concentrée principalement sur la caractérisation des composants individuels de la cellule, gènes, protéines, ou encore ARN non codants, avec pour but de comprendre la vie à partir de la caractérisation des macromolécules qui la constituent. Toutefois, protéines et ARN opèrent en interagissant les uns avec les autres, formant ainsi des systèmes dont la complexité peut difficilement être comprise une molécule à la fois. La biologie systémique, de nature « intégrative et holistique », entend comprendre la vie à partir de ces systèmes. Elle pose les questions biologiques en mettant l’accent sur le « tout » plutôt que sur les « parties ». Intrinsèquement interdisciplinaire, sa méthodologie originale est définie par un aller-retour dynamique entre expérimentation, travail informatique et théorique, formulation de nouvelles hypothèses scientifiques et développement technologique. |
La biologie systémique est l’étude des interactions entre les composants d’un système biologique Le terme « système » vient du grec sustêma qui signifie ensemble. Un système est un ensemble d’entités interagissant ou interdépendantes, abstraites ou concrètes, dont l’union forme un tout. En biologie, une certaine confusion règne autour de cette définition car l’échelle d’étude d’un système peut lui valoir ou non l’appellation « système » selon l’opinion de celui qui le considère. En fait, il n’y a pas de limite théorique à la taille d’un système : libre à chacun de définir les bornes le délimitant de son environnement[
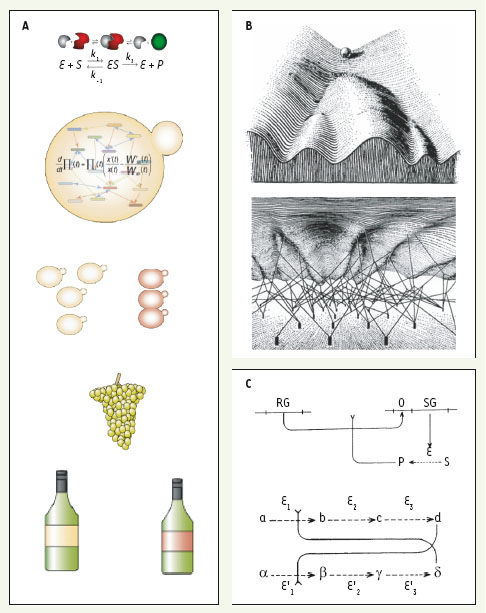
1]. Ainsi, un facteur de transcription régulant sa propre expression constitue un système, de la même façon que l’ensemble des molécules d’une cellule, l’ensemble des cellules d’un organisme, ou encore l’ensemble des individus d’une population. Différents systèmes peuvent être étudiés à partir des mêmes entités si l’on considère un type d’interaction plutôt qu’un autre. La population d’une ville peut être vue soit comme un ensemble d’individus partageant des relations économiques, des engagements matrimoniaux ou encore des maladies contagieuses, soit comme trois systèmes distincts. Un système peut aussi intégrer des composants hétérogènes, tel un écosystème comprenant à la fois des proies, des prédateurs et des ressources naturelles. Enfin, des composants et des interactions de natures différentes et traversant plusieurs échelles peuvent former un système unique (Figure 1A).  | Figure 1.
Illustrations de la notion de système biologique. A. Schématisation de systèmes biologiques à différentes échelles d’étude. De haut en bas : une enzyme et son substrat, ensemble des voies métaboliques dans une levure, population constituée de plusieurs levures individuelles partageant les mêmes ressources, la grappe de raisin comme écosystème, le vin comme produit d’intégration. Si chacun de ces systèmes peut être étudié séparément, ils peuvent aussi être intégrés dans un unique système mixte. Par exemple, l’Institut de recherche pour le vin australien propose d’étudier en détail comment les systèmes métaboliques de différentes levures (ici représentées par une population jaune et une population rouge), en causant la fermentation du même raisin, produisent des produits de dégradation caractéristiques [ 1]. Puisque ce sont ces produits qui sont responsables de la variété aromatique des vins (représentée ici par les étiquettes jaunes et rouges), l’institut suggère que ce savoir moléculaire pourra être intégré à la géographie des vignobles et au système économique dynamique de l’offre et de la demande, afin de produire pour les marchés de consommateurs ciblés les vins dont le goût leur plaira. B. Illustration de la notion de « paysage épigénétique » de C.H. Waddington (d’après [
2]). C. Deux systèmes biologiques imaginés par F. Jacob et J. Monod (d’après [
4]). RG : « gène régulateur » (répresseur de transcription) ; SG : « gène structural » (codant pour une enzyme) ; E (‘)
(1,2,3) : enzymes ; S : substrat ; P : produit ; a, b, c, d, α, β, γ, δ métabolites. Dans l’exemple du haut, le produit d’une réaction enzymatique inhibe (>-) la répression de l’expression du gène codant pour l’enzyme. Il s’agit d’une version de la boucle de rétroaction positive. Dans l’exemple du bas, le produit final d’une voie métabolique inhibe la première réaction d’une autre voie métabolique, et réciproquement. Il en résulte un système bistable où une seule de ces deux voies métaboliques peut être active à la fois. |
|
Biologie systémique : des concepts historiques… Les origines de la biologie systémique remontent aux années 1950, lorsque C. H. Waddington établit le concept de « paysage épigénétique » [2]. Il imagine les cellules passer d’un état de différenciation à l’autre en suivant un trajet dicté par la forme d’un paysage constitué de monts et de vallées (Figure 1B, panneau supérieur), paysage lui-même créé par les interactions entre gènes (les « piliers » du panneau inférieur de la Figure 1B). Cette vision de la cellule comme système évoluant d’état en état s’inspire des travaux de M. Delbrück [
3], F. Jacob et J. Monod [4] qui, après la Seconde Guerre mondiale, introduisent la notion de système en biochimie (Figure 1C), comme un mécanisme susceptible d’expliquer le mystère de la différenciation : comment des cellules au génome identique peuvent-elles exprimer des formes et des propriétés aussi différentes que celles d’un lymphocyte et d’un myocarde ? Ils proposent de voir les enzymes et leurs substrats comme les composants de circuits dynamiques, dont les exemples les plus simples sont les boucles de rétroaction négatives et positives. Dans le cas d’une boucle négative, l’augmentation du niveau d’un élément entraîne la diminution de son taux de production, ce qui a pour résultat une stabilisation de sa production et de son abondance, à la manière d’un thermostat. Une boucle positive en revanche a l’effet inverse, et donne lieu à deux scénarios opposés : si la boucle est enclenchée, l’élément encourage sa propre production, sinon il n’est pas produit. Ce type de circuits moléculaires et d’autres plus complexes ont depuis été très étudiés théoriquement, notamment par R. Thomas et ses collègues [
5]. La réalité de ces systèmes a été démontrée expérimentalement dès la fin des années 1950 avec l’exemple de l’opéron lactose inductible de A. Novick et M. Weiner chez la bactérie E. coli [
6], puis à de multiples reprises au cours des cinquante dernières années, ce qui a permis à la biologie systémique de s’affirmer aujourd’hui comme discipline à part entière. |
…remis à jour grâce au développement de technologies expérimentales et de nouveaux outils d’analyse Biologie synthétique : reconstruire un système pour mieux le comprendre À la frontière de la science-fiction, cette discipline reconstitue des circuits moléculaires in vivo, ou bien en invente de toutes pièces en fusionnant des domaines d’ADN provenant de multiples espèces. Parmi ses travaux fondateurs [
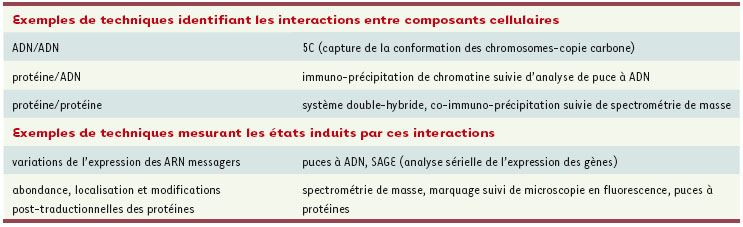
7], l’« interrupteur » est un système artificiel bistable composé de deux promoteurs et deux répresseurs de transcription croisés chez E. coli. Le résultat est une bactérie qui produit une protéine recombinante si et seulement si elle a été en contact avec l’inducteur de l’un des promoteurs dans le passé, sans que son patrimoine génétique n’ait été modifié d’aucune manière. En d’autres termes, la bactérie se « différencie » à travers un processus de « mémorisation » d’un changement purement environnemental. La preuve qu’une boucle de rétroaction positive peut être à l’origine de la différenciation cellulaire a donc été faite. Génomique fonctionnelle : expérimentation à l’échelle de la cellule entière Aussi fondamentaux soient-ils, les travaux de la biologie synthétique sont encore loin d’atteindre la complexité du système « cellule vivante ». C’est à cette échelle que les défis de la biologie systémique se posent aujourd’hui. Comment ces petits circuits moléculaires sont-ils liés les uns aux autres ? Comment communiquent-ils pour répondre aux besoins du « tout » cellulaire ? Pour parvenir à une compréhension globale de la cellule, il faut pouvoir observer simultanément tous les gènes, toutes les protéines, tous les ARN, ainsi que toutes leurs interactions. À cette fin se développent de nombreuses techniques systématiques à haut débit, souvent par miniaturisation et robotisation de techniques préexistantes (Tableau I). Parmi les exemples emblématiques de ces efforts, on peut citer la puce à ADN (une seule puce mesure quantitativement l’expression des 6 000 gènes de la levure à la fois), la cartographie du réseau « interactome » des interactions moléculaires à l’échelle du protéome, ou encore l’établissement de réseaux génétiques. On comprendra aisément que l’analyse et l’intégration [
8] de telles quantités d’information s’accompagnent nécessairement de l’introduction de nouvelles méthodes mathématiques et informatiques.  | Tableau I.
Exemples de techniques expérimentales utilisées à haut débit (liste non exhaustive) (d’après [
9]). |
Gestion des données et modélisation : transfert de savoir des « sciences dures » et apparition de nouvelles problématiques Prenons l’exemple d’une simple boucle de rétroaction positive où l’élément encourage sa propre production. À quelle vitesse ? Quelle quantité d’inducteur permet de générer une quantité souhaitée de produit ? En fait, indépendamment de l’échelle d’étude, la compréhension quantitative de tout système nécessite une analyse numérique. Répondre aux problèmes spécifiques à la biologie s’est révélé un défi fascinant pour les sciences exactes qui ont non seulement adapté leurs concepts, mais ont aussi trouvé dans les systèmes biologiques une source de nouvelles recherches théoriques. Réciproquement, l’apport de nouvelles méthodes d’analyse a permis aux biologistes de s’ouvrir à de nouvelles problématiques. Ainsi, les biologistes manient à présent le contrôle de qualité, l’estimation de paramètres à partir d’un nombre limité de mesures ou le contrôle de la stochasticité, problèmes classiques pour les ingénieurs, afin de parvenir à des analyses plus précises de leurs données. Au cœur de la biologie systémique se trouvent l’identification et la modélisation des réseaux à travers lesquels gènes et protéines interagissent pour effectuer les opérations cellulaires. Les outils mathématiques utilisés pour aborder ces questions correspondent à différents niveaux d’abstraction (Tableau II). De façon générale, les analyses à haut niveau d’abstraction décrivent les propriétés qualitatives des systèmes, tandis que les modèles à bas niveau d’abstraction produisent des prédictions quantitatives [ 9]. En effet, ces efforts dépendent étroitement de l’acquisition systématique de données biologiques chiffrées.  | Tableau II.
Exemples de méthodologies mathématiques et computationnelles pour l’analyse des systèmes biologiques, des plus abstraites aux plus mécanistiques (liste non exhaustive) (d’après [ 9]). |
|
La biologie systémique, porteuse d’espoir en recherche pharmaceutique Classiquement, l’industrie pharmaceutique procède de façon réductionniste. Après identification d’une cible thérapeutique potentielle, des substances chimiques interagissant spécifiquement avec cette cible sont développées, puis leurs effets sont testés dans des modèles in vitro et animaux. Ce n’est que lors des essais cliniques que les médicaments se trouvent enfin dans le contexte du patient, et c’est souvent à ce moment que des effets indésirables comme la toxicité ou le manque d’efficacité sont révélés. Ainsi, la moitié des essais cliniques aux États-Unis est un échec, la mise sur le marché d’un médicament prend en moyenne entre sept et douze ans, et environ 250 milliards de dollars publics et privés sont investis chaque année pour seulement une soixantaine de nouveaux traitements, dont la plupart sont de nouvelles versions de médicaments existants, seulement une quinzaine sont vraiment nouveaux. Comme en recherche fondamentale, la biologie systémique est perçue comme l’approche qui améliorera à l’avenir le rendement des découvertes pharmaceutiques en considérant le « contexte biologique » plus tôt dans le processus. Ses succès sont déjà visibles… L’application de la biologie systémique par l’industrie pharmaceutique se caractérise par l’introduction de modélisations à l’échelle systémique, de techniques de mesures associées, et par l’utilisation de bases de données. Le simple enregistrement dans ces bases de données de résultats disponibles dans la littérature clinique et les archives des hôpitaux et entreprises représente déjà un progrès immense qui permet de prédire l’effet clinique d’une espèce chimique en analysant les résultats d’autres espèces de structure similaire. Ce sont les start-up, comme Genestruct, BioSeek ou Merrimack Pharmaceuticals qui les premières ont choisi la biologie systémique, soit en proposant aux grandes entreprises de tester expérimentalement leurs molécules candidates par les techniques expérimentales de la biologie systémique, soit en utilisant la modélisation pour révéler de nouvelles cibles thérapeutiques potentielles. Les effets bénéfiques sont déjà visibles sur l’efficacité et la sécurité des nouveaux traitements, et on prédit à long terme une diminution générale du coût et du temps nécessaires à la production. …mais ses limites se profilent aussi Les nouveaux médicaments ainsi rationnellement conçus ont tendance à être ultra-spécifiques. Ainsi certains traitements contre le cancer, comme Tarceva 1, sont extrêmement efficaces lorsque la tumeur porte une mutation précise, mais généralement inutiles dans le reste des cas. Malheureusement, comme les technologies de séquençage disponibles aujourd’hui ne permettent pas d’identifier le profil génétique de chaque patient, les hôpitaux doivent trop souvent soumettre leurs patients à des chimiothérapies douloureuses et coûteuses sans savoir si leurs tumeurs portent ou non ces mutations. C’est pourquoi la recherche de « bio-marqueurs », groupes de gènes ou protéines faciles à mesurer et assez indicatifs de l’état du système et donc susceptibles de permettre d’établir un diagnostic ou un pronostic, suscite beaucoup d’enthousiasme. L’un de ces succès concerne le cancer du sein : les profils de transcription d’une soixantaine de gènes sont suffisamment discernables pour constituer les signatures de différents types de cancer, et donc d’identifier les patientes candidates à une chimiothérapie sans besoin de séquençage [
10]. Cependant, l’approche par les « bio-marqueurs » reste purement corrélative : savoir qu’un profil est statistiquement lié à un état du système n’informe pas directement sur les événements responsables des phénotypes observés. Nos efforts pour améliorer la vision systémique des maladies ne pourront donc vraiment porter leurs fruits que lorsque la biologie des systèmes sains sera elle-même mieux élucidée. |
La science des réseaux, une branche prometteuse de la biologie systémique Bien que quelques start-up s’y consacrent, la recherche sur les mécanismes par lesquels les maladies perturbent les systèmes reste majoritairement fondamentale. Certains groupes de recherche, dont le nôtre, cartographient les interactions entre protéines virales et protéines hôtes [
12,
13], et nous avons entrepris de mesurer quelles interactions protéiques sont perdues ou retenues par les protéines lorsqu’on leur impose des mutations mendéliennes connues pour être associées au cancer. Ce type d’approche s’inscrit dans le contexte d’une nouvelle discipline qui émerge des sciences théoriques traditionnelles : la science des réseaux. Sa plus grande découverte est que les propriétés structurelles des réseaux informent sur la nature des tâches qu’ils peuvent accomplir. Ainsi, la connectivité des réseaux réels (Internet, chaînes alimentaires, transports publics, interactions protéiques, etc.) les distingue de réseaux aléatoires. Par exemple, la distribution des degrés (nombre de connexions par composant) dans les réseaux réels tend à suivre une loi de puissance, tandis que celle de réseaux purement aléatoires suit typiquement une loi en forme de cloche. Cela signifie que dans les réseaux réels, un petit nombre de composants font beaucoup de connexions (on les appelle les hubs), tandis que la plupart des composants font peu de connexions. Cette propriété rend les réseaux réels très robustes en cas d’« erreur » ou de dysfonctionnement de leurs composants, mais en revanche très sensibles aux « attaques » dirigées contre les hubs [
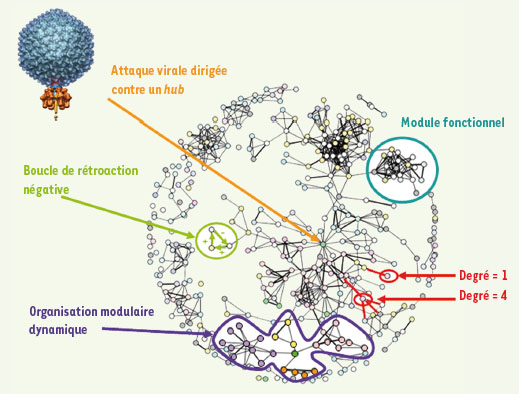
14]. En biologie (Figure 2), cette observation soulève des questions fondamentales : l’évolution favorise-t-elle ces structures pour protéger les réseaux cellulaires contre les erreurs induites par les mutations ? Les pathogènes attaquent-ils de préférence les hubs ?  | Figure 2.
Représentation théorique d’un réseau d’interactions entre protéines. Dans ce réseau, chaque nœud représente une protéine et chaque lien entre deux nœuds une interaction biophysique ou biochimique. Les différentes couleurs attribuées aux nœuds représentent des classes fonctionnelles (exemples : enzyme, facteur de transcription, localisation membranaire, coexpression, etc.). Les différentes épaisseurs des liens illustrent que les interactions peuvent être plus ou moins stables, ou bien démontrées avec plus ou moins de certitude. La notion de degré est représentée en rouge : une protéine n’interagissant qu’avec un seul partenaire est de degré 1, alors qu’une autre avec quatre partenaires est de degré 4. Lorsque dans un groupe les protéines partagent plus d’interactions entre elles que la moyenne, on peut supposer qu’elles forment un module fonctionnel [
11] (en bleu). Si ce module contient des protéines de fonction inconnue, on peut prédire qu’elles partagent certaines des fonctions des autres membres. Bien que la plus grande partie de ce que nous connaissons sur le réseau d’interactions physiques entre protéines soit statique, ce savoir peut servir de plate-forme sur laquelle surimposer des informations dynamiques, comme la coexpression. Au sein de la forme violette, les nœuds de la même couleur sont des protéines dont l’expression est corégulée. Les nœuds roses, jaunes, violets et oranges sont regroupés par couleur, tandis que le nœud vert lie ces différents groupes entre eux. Cela suggère que le nœud vert a probablement une fonction d’intégration et de coordination dynamique des modules unicolores [ 8]. De la même façon, des données cinétiques peuvent se superposer aux interactions physiques statiques et placer dans un contexte plus général de petits systèmes dynamiques [ 8] (en vert). La flèche orange illustre que les cibles préférées des virus sont les protéines les plus connectées, ou hubs. |
Parmi les réseaux réels, des différences topologiques révèlent des classes universelles. Ainsi, les motifs de trois ou quatre composants surreprésentés dans des systèmes de transfert d’énergie (chaînes alimentaires) ne sont pas les mêmes que ceux surreprésentés dans des systèmes de traitement d’information (réseaux de transcription, réseaux neuronaux, puces électroniques) [
15]. Placer dans un même cadre théorique des systèmes de natures diverses promet donc de révéler encore bien des lois propres à tous les systèmes complexes. Quelles seront les retombées médicales de la biologie des réseaux ? De nombreux axes de recherche comme ceux que nous venons de citer sont déjà en cours d’étude, mais il est clair que l’avenir nous réserve de grandes découvertes. |
Aujourd’hui la biologie systémique réunit informaticiens, statisticiens, mathématiciens, physiciens, ingénieurs, chimistes, médecins et biologistes autour des mêmes questions scientifiques. Économistes et politiciens sont prêts à s’engager demain dans la même direction pour traiter les défis de santé publique de manière systémique, qu’il s’agisse de comprendre la dynamique de propagation de maladies contagieuses à travers les structures humaines ou de mesurer l’impact des programmes sociaux sur l’obésité [
16]. Ainsi, de l’identification de cibles thérapeutiques à l’invention de nouveaux outils diagnostiques en passant par l’établissement de politiques de santé publique, la biologie systémique est présente à toutes les étapes du processus médical. En recherche fondamentale, son succès entraîne un véritable changement de paradigme, remplaçant la notion de gène comme unité centrale de la biologie par une vision holistique. La biologie systémique porte donc beaucoup d’espoir pour mieux comprendre le vivant et les maladies. Sa force provient sans doute de son inhérente interdisciplinarité. Nul champ scientifique n’est plus à même qu’un autre de trouver les réponses aux grandes questions posées par la nature, mais c’est l’échange entretenu entre les disciplines qui peut mener aux grandes découvertes scientifiques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêt.
|
Nous remercions les docteurs Nicolas Simonis et Thomas Jubault pour leur aide à la rédaction de cette synthèse. M.V. est chercheur qualifié honoraire au Fonds de la recherche scientifique (FRS-FNRS, Communauté française de Belgique).
|
Footnotes |
1. Borneman AR, Chambers PJ, Pretorius IS. Yeast systems biology: modeling the winemaker’s art. Trends Biotechnol 2007; 25 : 349–55. 2. Waddington C. H. The strategy of the genes. London : George Allen and Unwin, 1957. 3. Delbrück, M. Discussion. In : Unités biologiques douées de continuité génétique. Paris : Éditions du CNRS, 1949 : 33–5. 4. Monod J, Jacob F. Teleonomic mechanisms in cellular metabolism, growth, and differentiation. Cold Spring Harb Symp Quant Biol 1961; 26 : 389–401. 5. Thomas R, D’Ari R. Biological feedback. Boca Raton, Florida : CRC Press, 1990 : 316 p. 6. Novick A, Weiner M. Enzyme induction as an all-or-none phenomenon. Proc Natl Acad Sci USA 1957; 43 : 553–66. 7. Hasty J, McMillen D, Collins JJ. Engineered gene circuits. Nature 2002; 420 : 224–30. 8. Ge H, Walhout AJ, Vidal M. Integrating “omic” information: a bridge between genomics and systems biology. Trends Genet 2003; 19 : 551–60. 9. Ideker T, Lauffenburger D. Building with a scaffold: emerging strategies for high- to low-level cellular modeling. Trends Biotechnol 2003; 21 : 255–62. 10. Van’t Veer LJ, Dai H, van de Vijver MJ, et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature 2002; 415 : 484–5. 11. Gunsalus KC, Ge H, Schetter AJ, et al. Predictive models of molecular machines involved in Caenorhabditis elegans early embryogenesis. Nature 2005; 436 : 861–5. 12. De Chassey B, Navratil V, Tafforeau L, et al. Hepatitis C virus infection protein network. Mol Syst Biol 2008; 4 : 230. 13. Calderwood MA, Venkatesan K, Xing L, et al Epstein-Barr virus and virus human protein interaction maps. Proc Natl Acad Sci USA 2007; 104 : 7606–11. 14. Albert R, Jeong H, Barabasi AL. Error and attack tolerance of complex networks. Nature 2000; 406 : 378–82. 15. Milo R, Shen-Orr S, Itzkovitz S, et al. Network motifs: simple building blocks of complex networks. Science 2002; 298 : 824–7. 16. Newell B, Proust K, Dyball R, et al. Seeing obesity as a systems problem. NSW Public Health Bulletin 2007; 18 : 214–8. |