| |
| Med Sci (Paris). 2009 December; 25(12): 999–1009. Published online 2009 December 15. doi: 10.1051/medsci/20092512999.De la sérothérapie aux anticorps recombinants « nus » Plus d’un siècle de succès en thérapie ciblée Hervé Watier* Université François Rabelais de Tours ; CHRU de Tours ; CNRS UMR 6239 et GDR 3260 « Anticorps et ciblage thérapeutique », Laboratoire d’immunologie, Faculté de médecine, 10, boulevard Tonnellé, 37032 Tours Cedex, France |
Si les anticorps recombinants apparaissent aujourd’hui comme une formidable avancée thérapeutique, ils sont l’aboutissement d’un long processus lui-même émaillé de victoires non moins spectaculaires. Remettre en perspective cette histoire permet de mieux appréhender l’évolution des concepts, tout autant que la maturation des outils, les deux étant intimement liés. Cette grande fresque aborde les uns après les autres les différents principes de ciblage thérapeutique, depuis leur conception jusqu’aux derniers développements cliniques, afin d’illustrer que nombre d’entre eux ont été élaborés il y a plus de cent ans. Ce découpage met aussi en évidence que la découverte des anticorps monoclonaux (Acm) par César Milstein et Georges Köhler en 1975 [
1] (→), puis l’arrivée de l’ingénierie moléculaire, ont à chaque fois rénové l’antique sérothérapie qui, toutefois, continue à rendre de formidables services. Ce panorama sera enfin l’occasion de proposer une classification pharmacologique de l’ensemble de la classe des anticorps thérapeutiques.
(→) voir R. Abès et al., page 1011
|
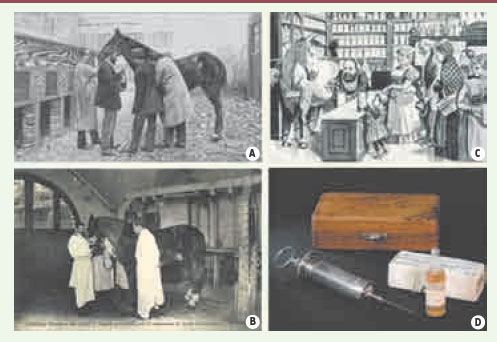
De la neutralisation de toxines à celle d’antigènes solubles Sérothérapie antidiphtérique Le premier succès clinique revient à Emil von Behring (Figure 1A) et à Shibasaburo Kitasato qui publient dès 1890 qu’une dose non létale de toxine diphtérique ou tétanique protège de l’administration ultérieure d’une dose létale, et que l’état d’immunité qui en résulte peut être transféré par le sérum 1 à des animaux naïfs [
2]. La tradition rapporte que le premier enfant guéri du croup (angine diphtérique) par le sérum antidiphtérique le fut à Noël 1891. C’est ainsi qu’était née la Serum-Therapie, ou sérothérapie en français. Cette victoire allemande suscita une vive réaction à l’Institut Pasteur de Paris où Émile Roux (Figure 1b) avait identifié quelques années plus tôt la toxine diphtérique. De part et d’autre du Rhin, les deux équipes réfléchirent à la façon de produire des quantités importantes de sérum (Figure 2), choisirent d’immuniser des chevaux et réalisèrent les premières expériences cliniques avec du sérum équin. À Paris, à l’Hôpital des enfants malades, trois cents enfants furent traités, avec des résultats spectaculaires publiés en 1894 [
3]. Il est difficile d’imaginer aujourd’hui ce que fut alors cette révolution thérapeutique et médicale (Figure 1C-E). Il fallut dès lors produire d’énormes quantités de sérum, le standardiser, le conditionner et assurer sa distribution dans les territoires les plus reculés ; le développement de la sérothérapie participa indéniablement à la naissance d’une industrie biotechnologique (Figure 2), même si le terme n’existait pas encore…  | Figure 1.
La sérothérapie antidiphtérique victorieuse du croup. (A) Emil von Behring (1854-1917) à Berlin [ 2] et (B) Émile Roux (1853-1933) à l’Institut Pasteur de Paris [ 3], les deux grands promoteurs de la sérothérapie antidiphtérique, sont très rapidement présentés dans la presse de l’époque, chacun dans leur pays, comme les sauveurs des petits enfants [ (C)
Das Buch für Alle 1897 et (D)
La France Illustrée du 3 novembre 1894]. La victoire paraît si éclatante, voire miraculeuse, que certains journaux n’hésitent pas à publier des figures allégoriques à connotation religieuse (E), représentant le Dr Roux, médecin tout-puissant, sauvant l’enfant des griffes du démon, sous le regard de sa mère éplorée (© Le Journal Illustré, 28 juillet 1895). Droits réservés ; documents issus du fonds Watier du service commun de documentation de l’Université de Tours. |
 | Figure 2.
La sérothérapie, aux origines d’une industrie biotechnologique. Même si le vaccin antivariolique (vaccine) était déjà produit par propagation sur la vache, la sérothérapie franchit un pas supplémentaire en utilisant comme médicament le sérum de l’animal lui-même. Les chevaux immunisés étaient régulièrement saignés ; certaines bêtes ont pu donner plus de 200 litres de sang en douze ans de carrière… Tant en Allemagne dans la grande presse [(A)
Das Buch für Alle, 1897] qu’en France à travers les cartes postales (B), l’origine équine du sérum frappe les esprits. La caricature parue dans le Lustige Blätter en 1894 (C) illustre bien la perception que pouvait en avoir alors le grand public. Droits réservés ; documents issus du fonds Watier du service commun de documentation de l’Université de Tours. Le sérum équin était évidemment titré (en unités de neutralisation), stérilisé, conditionné en ampoules et distribué, ainsi que les seringues permettant son utilisation (D).
Université de Tours © Daniel Bourry, objets de la collection Watier.
|
Antidotes et fragments d’anticorps Le concept de neutralisation de toxines par la sérothérapie fut rapidement transposé par Césaire Phisalix ou Albert Calmette au traitement des envenimations. On commença à préparer des sérums contre les venins de différentes espèces de serpent puis de scorpion, et à les employer avec succès (Figure 3A), ce qui reste toujours vrai de nos jours. On chercha aussi à préparer des antidotes, ce dont témoigne la pharmacopée actuelle avec le Digidot ®, préparé par immunisation de moutons et destiné au traitement des intoxications par les digitaliques. Dès le début du XX e siècle, on glissa rapidement de la notion d’antitoxines au concept plus général d’anticorps, mais ce n’est qu’à la veille de la Seconde Guerre mondiale qu’on montra que les anticorps se trouvaient parmi les gammaglobulines du sérum, ouvrant la porte aux études biochimiques de l’après-guerre. La protéolyse ménagée des immunoglobulines par la papaïne puis par la pepsine, apparue dans les années 1950, permit non seulement à Rodney Porter de proposer la première structure de l’immunoglobuline G (IgG), mais trouva également l’une de ses meilleures applications cliniques dans la sérothérapie antitoxique. Débarrassés de leur portion Fc, les fragments d’anticorps d’origine animale gardent leurs propriétés de neutralisation, diffusent plus vite, et sont surtout beaucoup mieux tolérés, avec une très nette diminution des accidents hypotensifs et des maladies sériques 2 [
4]. Évolution vers l’utilisation d’anticorps neutralisants d’origine humaine L’application en clinique de la sérothérapie antitétanique fut extrêmement rapide bien que beaucoup moins médiatique que la sérothérapie antidiphtérique [
5,
6]. Il fallut attendre le conflit de 1914-1918 pour qu’elle connaisse son heure de gloire, épargnant des milliers de morts en dépit des difficultés d’approvisionnement. Au contraire de la sérothérapie antidiphtérique qui disparut avec l’avènement de la vaccination puis de l’antibiothérapie, la séroprophylaxie du tétanos continua à se révéler indispensable chez tous les blessés non ou mal vaccinés. Malheureusement, elle nécessitait l’injection d’immunoglobulines entières pour assurer une couverture prolongée (nécessité de la présence de la portion Fc pour une longue demi-vie) (→) et, de ce fait, entraînait de nombreux accidents anaphylactiques. À partir des années 1960, du fait des programmes de vaccination systématique et du développement des dons du sang, il devint possible de disposer d’immunoglobulines humaines enrichies en anticorps antitétaniques. Ces préparations se révélèrent plus efficaces parce que les IgG humaines ont une demi-vie plus longue que les IgG équines, d’où une couverture prolongée, et qu’elles sont surtout beaucoup mieux tolérées que les sérums équins [
7,
8]. Elles se sont donc imposées malgré leur coût plus élevé et ce sont elles qu’on utilise encore de nos jours.
(→) voir C. Magdelaine-Beuzelin et al., page 1053
Le renouveau apporté par les anticorps monoclonaux L’avènement des anticorps monoclonaux (Acm) et leur développement dans les années 1980 eurent pour conséquence de faire resurgir ce concept de neutralisation de toxine (→), en ciblant cette fois les endotoxines responsables du choc septique (→). Après des résultats initiaux encourageants à la fin des années 1980, il apparut dès 1993 que ces traitements étaient en réalité inefficaces et l’un d’eux, le Centoxin ®, induisait même une plus grande mortalité chez les patients non bactériémiques ; leur développement clinique fut donc brutalement stoppé [
9]. À la même période, le TNF-α (tumor necrosis factor) avait été identifié comme le médiateur endogène du choc endotoxinique, et des Acm capables de le neutraliser avaient été développés par la firme Centocor, Inc. Le glissement qui conduisait d’un anticorps dirigé contre une toxine exogène à un anticorps dirigé contre une « toxine » endogène, c’est-à-dire ni plus ni moins qu’un autoanticorps, était un véritable saut conceptuel… Malheureusement, ces anticorps anti-TNF furent eux aussi brutalement arrêtés dans leur développement en 1993, par crainte qu’ils induisent les mêmes problèmes que les anticorps anti-endotoxines. Ils n’auraient d’ailleurs sans doute jamais vu le jour en clinique si Marc Feldmann et Ravinder Maini n’avaient persuadé Centocor de recycler leur Acm anti-TNF-α, l’infliximab, dans la polyarthrite rhumatoïde [
10]. L’idée était la bonne et le Rémicade ® fut approuvé dès 1998 (→).
(→) voir R. Abès et al., page 1011
(→) voir R. Abès et al., page 1011
(→) voir L. Semerano et M.C. Boissier, page 1108 ; J. Sibilia, page 1033
Quelles cibles endogènes neutraliser ? La firme Genentech fut particulièrement visionnaire en réussissant ces dernières années le développement clinique de trois anticorps neutralisants, deux dirigés contre le VEGF ( vascular endothelial growth factor), le bévacizumab (Avastin ®, IgG1κ) et le ranibizumab (Lucentis ®, Fab d’IgG1κ) (→), et le troisième dirigé contre la molécule IgE, l’omalizumab (Xolair ®, IgG1κ). D’autres firmes éprouvèrent plus de difficultés. L’éculizumab (Soliris ®, IgGκ dont les domaines CH1 et charnière dérivent d’une IgG2, et les domaines CH2 et CH3 d’une IgG4), neutralisant la fraction C5 du complément, fut très décevant en transplantation et dans plusieurs maladies inflammatoires chroniques, mais il finit par trouver sa place dans une indication de niche, l’hémoglobinurie nocturne paroxystique dont il a révolutionné la prise en charge (→). Les énormes succès de ces biomédicaments ne doivent cependant pas cacher les innombrables déceptions des équipes ayant cherché à développer des Acm anticytokines et antifacteurs de croissance, car la principale difficulté réside dans l’identification de la bonne indication thérapeutique. De fait, plutôt que de chercher de nouvelles cibles, il est beaucoup plus facile, partant d’un anticorps parvenu sur le marché, d’en étendre les indications. C’est ce qui est arrivé avec les anticorps anti-TNF qui ne cessent de se multiplier (infliximab/Rémicade ®, adalimumab/Humira ®, certolizumab pégol/Cimzia ®, etc.) et dont les indications se sont étendues au traitement de la maladie de Crohn, du rhumatisme psoriasique, du psoriasis, de la spondylarthrite ankylosante, de la rectocolite hémorragique…
(→) voir N. Cézé et al., page 1099 ; N. Leveziel et al., page 1105
(→) voir G. Socié et al., page 1126
Quelles recettes pour neutraliser les cibles ? La neutralisation des toxines étant par nature une fonction strictement dépendante de la portion Fab, les anticorps recombinants ayant cette fonction peuvent donc être aussi bien des fragments Fab (ranibizumab), éventuellement pégylés pour augmenter leur demi-vie (certolizumab pégol), ou des IgG entières, IgG1 (infliximab, bévacizumab, omalizumab, adalimumab) ou autre (éculizumab). En revanche, le combat contre les toxines bactériennes, qui prend dorénavant l’allure d’un bouclier contre le bioterrorisme, continue de faire progresser les connaissances. Les essais de mise au point d’un anticorps protecteur contre la toxine charbonneuse ont permis de démontrer formellement ce qui était pressenti de longue date, à savoir que l’efficacité de neutralisation dépend directement de l’affinité de l’anticorps pour son antigène [
11]. Néanmoins, cela ne suffit pas pour des toxines plus complexes et ayant plusieurs sites actifs comme la toxine botulique, où seule l’association de plusieurs Acm permet d’obtenir une activité neutralisante [
12]. |
Anticorps antimicrobiens et antiviraux Lorsqu’apparut la sérothérapie antidiphtérique dans les années 1890, les doctrines microbiennes s’étaient déjà imposées, mais la médecine n’était pas pour autant capable de s’attaquer avec efficacité aux grands fléaux infectieux. La sérothérapie laissait donc entrevoir d’énormes espoirs (Figure 1). Les tout premiers essais chez l’homme [
13,
14], antérieurs aux travaux cliniques de von Behring, avaient d’ailleurs cherché à guérir la tuberculose. Dans les années qui suivirent, on vit apparaître d’innombrables sérums destinés à combattre bactéries et virus. Les articles de l’époque font état de nombreux succès thérapeutiques, sans que l’on dispose de réelles statistiques d’efficacité ni d’essais randomisés en double aveugle contre placebo ! En l’absence de tout autre anti-infectieux efficace, sans doute y avait-il d’authentiques résultats et de réels succès dans les méningites, la pneumonie, etc. L’arrivée des sulfamides puis des antibiotiques dans les années 1940 finit néanmoins par avoir raison de tous les sérums anti-infectieux d’origine animale. Dans ce combat contre les agents infectieux, il est intéressant de noter qu’Émile Legrain, un médecin militaire, utilisa dès 1895 un sérum de convalescent pour enrayer une attaque de typhus exanthémique [
15]. C’est à notre connaissance la toute première utilisation de sérum humain dans un but thérapeutique. Le procédé fut ensuite repris et développé par Charles Nicolle à l’Institut Pasteur de Tunis à partir de 1910, dans la même indication. Le recours aux sérums de convalescents s’amplifia dans les années 1920 pour la prévention de la rougeole, et plus tard de la varicelle, de la poliomyélite, etc. La promotion de la « séroprophylaxie » de ces maladies virales dans les crèches fut notamment soutenue par le pédiatre Robert Debré [
16]. Un peu partout dans le monde, on commença à établir dans les années 1930 des centres de collecte des sérums de convalescents qui, pour certains, prirent le nom de « centres de sérothérapie humaine ». Ces derniers ont été progressivement remplacés par les centres de collecte des dons du sang et par les établissements chargés de l’élaboration des produits sanguins stables. Il est encore possible de se procurer pour un usage thérapeutique des immunoglobulines humaines enrichies en anticorps antivaricelle, antihépatite A, antihépatite B. En pratique, ce sont surtout les immunoglobulines antihépatite B (en particulier IVHeBex®, Laboratoire français du fractionnement et des biotechnologies, LFB) qui gardent une certaine utilité en cas de contact accidentel avec du sang, chez les patients nouvellement hémodialysés (la vaccination étant faite concomitamment), chez les nouveau-nés de mère contaminée, et dans la prévention des récidives d’hépatite B après transplantation hépatique. Avec l’ère des anticorps recombinants, la séroprévention a repris quelques couleurs grâce au palivizumab (Synagis®) dans la prophylaxie des infections à virus respiratoire syncytial chez les nourrissons fragiles. Il s’agit pour l’instant du seul anticorps recombinant antiviral sur le marché. Différentes pistes sont actuellement à l’étude pour cibler des maladies virales graves (virus de l’hépatite C, virus des fièvres hémorragiques, etc.) mais le développement de tels agents se heurte à la grande diversité des sérotypes viraux et aux phénomènes de variation antigénique qui permettent justement aux virus d’échapper aux réponses immunitaires humorales. |
Le sérum antilymphocytaire L’idée de cibler et de détruire des cellules sanguines par des anticorps découle des premiers travaux d’Elie Metchnikoff à l’Institut Pasteur de Paris en 1899 [ 16], suivis de quelques autres. Même si Metchnikoff avait pressenti que son « sérum antiphagocytaire pourrait être employé dans le but d’affaiblir la réaction de l’organisme » [ 16], plusieurs décennies furent nécessaires avant qu’un sérum antilymphocytaire (SAL) ne soit utilisé comme immunosuppresseur. Les premiers sérums, préparés par immunisation avec des tissus (extraits spléniques) souffraient d’un manque évident de spécificité cellulaire, problème qui ne fut solutionné qu’à partir des années 1930. L’effet immunosuppresseur du SAL se révéla au début des années 1950 et son intérêt pour la prévention des rejets de greffe au début des années 1960. Les premiers essais chez l’homme eurent lieu en 1967 et furent rapidement concluants [
18]. Depuis lors, le SAL n’a cessé d’être utilisé et il existe même à l’heure actuelle un regain d’intérêt pour ce vieux produit dont la spécificité antigénique reste pourtant mal définie, le mécanisme d’action débattu, la standardisation difficile et l’immunogénicité toujours responsable de maladies sériques. Prévention de l’allo-immunisation antirhésus Avec le même concept de ciblage de cellules sanguines circulantes, il fut proposé dans les années 1960 de prévenir l’allo-immunisation antirhésus chez les femmes de groupe sanguin rhésus D négatif, en leur administrant des anticorps antirhésus récoltés dans le plasma d’autres femmes qui s’étaient immunisées. Les premiers essais furent réalisés dès 1961 [
19] et le traitement systématique mis en place à partir de 1968 (Figure 3B). Le succès fut tel que la source même de ces anticorps se tarit et qu’il fallut procéder à l’immunisation de donneurs rhésus négatif par des hématies rhésus D positif. Cette pratique n’étant plus autorisée en France depuis le scandale du sang contaminé, les immunoglobulines anti-D actuellement administrées aux patientes françaises proviennent de donneurs étrangers, le plus souvent rémunérés pour être immunisés et donner leur sang. Il est sans doute urgent de faire cesser cette hypocrisie en parvenant enfin à obtenir des Acm cliniquement efficaces (→). L’idée n’est évidemment pas nouvelle, et beaucoup d’efforts ont été déployés ces vingt dernières années pour surmonter les difficultés rencontrées. L’impossibilité de produire des Acm antirhésus D chez la souris poussa les équipes à développer la technologie des hétérohybridomes et des lignées B transformées par l’EBV ( Epstein Barr virus), ce qui permit d’obtenir les premiers Acm thérapeutiques « intégralement humains » et de les tester en clinique [
20]. Ils se révélèrent pour la plupart inefficaces, ce qui conduit actuellement à développer des Acm sélectionnés sur la base d’une meilleure affinité pour le récepteur FcγRIIIa [
21], récepteur déterminant pour l’activité cytolytique des anticorps et dont il sera question un peu plus loin (→).  | Figure 3.
Les grandes étapes de l’évolution des anticorps, vues par la publicité. Dès la fin du XIX e siècle, on voit apparaître des annonces publicitaires vantant les mérites des anticorps. À gauche, tiré d’un journal grand public de 1907 ( Vie à la campagne, n° 17 du 1 er juin 1907), un distributeur des sérums antivenimeux de l’Institut Pasteur de Lille (A. Calmette) suggère aux touristes, chasseurs et explorateurs d’emporter avec eux la trousse sérothérapique ! Droits réservés ; documents issus du fonds Watier du service commun de documentation de l’Université de Tours. Au centre, les années 1960 et 1970 voient se généraliser l’utilisation d’anticorps anti-rhésus D pour la prévention de l’allo-immunisation fœto-maternelle [ 19], et célèbrent la tranquillité des familles dont les mères sont rhésus négatif, tout autant que celle du gynécologue-obstétricien cible de cette campagne publicitaire ! À droite, la mise sur le marché en 1986 du premier anticorps monoclonal thérapeutique [
22] s’accompagne d’une campagne publicitaire dans les journaux de transplantation, mettant en exergue les avantages des anticorps monoclonaux par rapport au sérum antilymphocytaire. Ailleurs, le muromonab est présenté comme « the first therapy with monoclonal antibody reproducibility and specificity ». |
(→) voir R. Urbain et al., page 1141
(→) voir R. Abès et al., page 1011 ; R. Urbain et al., page 1141
Anticorps antilymphocytaires Dans le domaine de l’immunosuppression, l’apparition de la technologie des hybridomes suggéra qu’on pourrait substituer le SAL par un Acm, mieux défini quant à sa spécificité antigénique et bien mieux standardisable. L’OKT3, isolé en 1979 et qui s’avérait reconnaître tous les lymphocytes T, fut testé moins de deux ans plus tard chez des patients ayant subi une transplantation rénale [ 22], permettant l’induction d’une lymphopénie et le contrôle des rejets. Personne ne savait alors que cet anticorps reconnaissait la chaîne ε du CD3 et que celle-ci était associée au TCR ( T cell receptor)
3. Cette IgG2a murine fut mise sur le marché en 1986, sous le nom de muromonab (pour murine monoclonal antibody) (Figure 3C), et non muromomab, car les règles internationales de nomenclature n’avaient pas encore été établies. Il est le seul Acm de souris ayant été approuvé. Son immunogénicité ne pose pas de réel problème en pratique puisqu’il est utilisé en flash thérapeutique. L’objectif de substituer le SAL par un Acm était aussi poursuivi par le département de pathologie de Cambridge (Campath) qui recherchait un Acm antilymphocytes T humains capable d’égaler le SAL in vitro [
23]. Le Campath-1M, une IgM de rat dirigée contre un antigène inconnu (plus tard identifié comme le CD52), se montra ainsi capable de purger en lymphocytes T les greffons médullaires et d’éviter la réaction du greffon contre l’hôte. Bien que plus manipulable, le variant IgG2b du Campath (commutation spontanée) fut décevant du fait de son immunogénicité, ce qui amena l’équipe à entreprendre d’une part l’humanisation des domaines variables et d’autre part à tester différentes chaînes lourdes humaines, γ1 et γ4 notamment. C’est encore à l’heure actuelle le seul anticorps qui ait été administré à l’homme sous deux formats : IgG1, constamment lymphopéniant et IgG4, rarement lymphopéniant. Finalement, la forme IgG1 du Campath (alemtuzumab, MabCampath ®) fut approuvée dans le traitement de la leucémie lymphoïde chronique (LLC) du fait de ses propriétés cytotoxiques sur les cellules B de LLC (→), tout en ayant gardé ses propriétés immunosuppressives et les effets indésirables qui lui sont liés.
(→) voir G. Cartron et J.F. Rossi, page 1085
Le règne de l’anticorps anti-CD20 En matière de ciblage des cellules circulantes par des Acm, ceux qui recherchaient de bons antigènes cibles pour traiter les hémopathies B ont pu bénéficier des efforts déployés pour démembrer les antigènes membranaires des leucocytes (Tableau I). Parmi les anticorps disponibles, le 1F5 (IgG2a de souris) fut choisi parce qu’il était spécifique de la lignée B, que son antigène n’était pas modulé, tout au moins par les phénomènes classiques d’internalisation ou de décapage, et qu’il n’était pas internalisé après fixation de l’anticorps. Cet antigène était le CD20… Le 1F5 fut injecté chez quatre patients atteints de lymphome, avec une réduction transitoire de 90 % de la masse ganglionnaire chez le patient ayant reçu la plus forte dose [
24]. Sur la base de ces résultats encourageants, la firme IDEC entreprit de chimériser l’anticorps anti-CD20 2B8 et sélectionna une version IgG1, inductrice de lymphopénie B chez le macaque [
25]. Ce C2B8 n’est autre que le rituximab (MabThéra ®, Rituxan ®) dont les résultats cliniques se révélèrent exceptionnels, non seulement pour la prise en charge des hémopathies mais aussi pour le traitement de nombreuses affections auto-immunes, du fait de ses propriétés immunosuppressives (→). Un tel succès commercial ne peut laisser indifférent, et de nombreuses autres firmes pharmaceutiques développent maintenant des me too, c’est-à-dire d’autres anticorps anti-CD20, en cherchant cependant à se distinguer du rituximab et à obtenir une plus grande efficacité clinique. Ceci ne fait que renforcer la place du rituximab comme modèle d’étude des anticorps thérapeutiques cytolytiques [
26]. Parmi les nombreuses équipes ayant contribué à étudier son action, nous avons été les premiers à montrer que le polymorphisme du gène codant FcγRIIIa influençait la réponse clinique au rituximab [
27] et c’est sur la base de ces données que sont actuellement testés des anticorps anti-CD20 dont le Fc a une affinité accrue pour le FcγRIIIa [
28,
29].  | Tableau I.
Résumé des ateliers HLDA responsables de la définition des clusters of differentiation (CD).
|
(→) voir G. Cartron et J.F. Rossi, page 1085
|
Anticorps ciblant spécifiquement les tumeurs cancéreuses ? Si l’indication première du rituximab est bien le traitement d’une pathologie cancéreuse, comme le radical [tu] de sa dénomination en témoigne, cet anticorps n’est pourtant vraiment pas spécifique de tumeur puisqu’il éradique l’ensemble des lymphocytes B, tumoraux aussi bien que normaux. L’histoire du rituximab et celle de l’alemtuzumab s’inscrivent d’ailleurs plutôt dans celle des anticorps antileucocytaires que dans celle des anticorps spécifiques du cancer qui remonte à 1895 avec Jules Héricourt et Charles Richet (Figure 4). Ces derniers avaient posé les principes de la sérothérapie dès 1888 [
30] et en recherchaient de nouvelles applications. Partant de l’hypothèse d’une possible origine microbienne des tumeurs, ils immunisèrent des chiens avec des extraits de sarcomes ou de carcinomes, et traitèrent leurs premiers patients [
31,
32]. Devant l’efficacité apparente de ce nouveau traitement, les résultats furent très rapidement publiés et connurent un énorme succès (Figure 4). Il fallut hélas se rendre à l’évidence que l’effet n’était que transitoire et que la maladie reprenait son cours inexorable, quel que soit le sérum utilisé et la façon dont il était préparé. Le concept que des anticorps pourraient reconnaître spécifiquement une tumeur cancéreuse avait cependant été formulé.  | Figure 4.
Jules Héricourt et Charles Richet, inventeurs de la sérothérapie, et premiers expérimentateurs de la sérothérapie anticancéreuse. Jules Héricourt (à gauche) (1850-1938), ici en 1914 (La Science et la Vie, n° 11, février 1914) et Charles Richet (au centre) (1850-1935) étaient amis de lycée. Tandis que Jules Héricourt, de condition modeste, devenait médecin militaire, Charles Richet gravissait rapidement les échelons universitaires et devenait professeur de physiologie à la faculté de médecine de Paris, ce qui lui permit d’accueillir son ami dans son laboratoire lorsque ce dernier quitta l’armée. Jules Héricourt, grand adepte des théories microbiennes, poussa Charles Richet dans cette voie, tandis que ce dernier orienta leurs recherches sur des questions physiologiques, s’interrogeant sur le support de l’immunité. Dès 1888, ils publièrent que le sang pouvait transférer un état d’immunité et que l’« hématothérapie » pourrait permettre de soigner les maladies infectieuses [ 30]. En utilisant du sérum de chien, ils tentèrent d’appliquer cette méthode à la tuberculose [ 13, 14] puis à la syphilis, sans succès. Toute leur vie, ils regrettèrent de ne pas avoir essayé l’hématothérapie dans la diphtérie. En 1895, formulant l’hypothèse que les tumeurs pouvaient être d’origine microbienne, ils immunisèrent des chiens avec des extraits tumoraux et préparèrent du sérum anticancéreux. Devant l’amélioration clinique constatée (et dont l’origine reste encore de nos jours bien mystérieuse…), ils publièrent rapidement leurs premiers cas [ 31, 32]. Déjà confortée par les résultats de la sérothérapie antidiphtérique, la presse spécialisée réserva un accueil exceptionnel à la découverte et titra sur la guérison du cancer ( La Science illustrée, n° 392, 1895), alors même qu’un seul malade avait été traité et un second venait de l’être. Prudent, et regrettant peut-être déjà cette précipitation, Charles Richet répondait au journaliste : « La cure, dit-il, est très belle ; mais il n’y en a qu’une, et cela ne suffit pas ; observons, étudions et nous nous prononcerons plus tard. » Les études se multiplièrent, à Paris, à Tours, en France et à l’étranger, et le verdict tomba… Partout des effets bénéfiques transitoires étaient observés, mais sans réel impact sur les tumeurs cancéreuses. Jules Héricourt et Charles Richet reprirent leurs études sur la tuberculose et proposèrent de traiter les patients par zomothérapie (jus de viande crue). Puis, tandis que Jules Héricourt quittait le laboratoire pour s’occuper du dispensaire-sanatorium Jouye-Rouvre-Taniès à Paris, Charles Richet poursuivait ses études physiologiques et découvrait l’anaphylaxie en 1902 avec Paul Portier, découverte pour laquelle ils reçurent le prix Nobel en 1913. Droits réservés ; documents issus du fonds Watier du service commun de documentation de l’Université de Tours.
|
Les preuves expérimentales de l’existence d’antigènes spécifiquement tumoraux commencèrent à apparaître dans les années 1960 mais il s’agissait de tumeurs viro-induites, peu représentatives de la réalité clinique. Seule l’arrivée des Acm rendit possible la recherche de marqueurs spécifiques de tumeurs. Plus de trente ans après, beaucoup s’accordent à penser qu’un tel ciblage, laissant intacts les tissus sains, est illusoire, avec cependant deux exceptions : les anticorps anti-idiotype et le trastuzumab (Herceptin®). L’idiotype définit le motif antigénique unique porté par les boucles hypervariables de chaque récepteur d’antigène. En cas de prolifération lymphoïde B, les cellules malignes expriment une immunoglobuline de membrane (BCR) porteuse d’un idiotype unique, propre à la tumeur. Il devient donc envisageable de produire un Acm spécifique de cet idiotype, ce qui fut tenté avec un certain succès chez les patients atteints de lymphome [
33]. Cette approche séduisante se heurte malgré tout à des difficultés pratiques majeures, puisqu’il faut préparer un médicament pour chaque nouveau patient. Le trastuzumab est quant à lui le fruit de la recherche sur l’oncogène ERBB2 (Her-2/neu) et son produit, ErbB2, dont la particularité est d’être membranaire et donc accessible aux anticorps. Cet Acm a été spécifiquement conçu pour interférer avec l’homodimérisation anormale de ce récepteur [
34], et il n’est donc efficace que sur les tumeurs surexprimant ErbB2. Si ErbB2 n’est pas à proprement parler un antigène spécifique de tumeur, le trastuzumab semble reconnaître une forme antigénique spécifiquement associée aux tumeurs. Malgré tout, le trastuzumab s’est révélé cardiotoxique lors de son utilisation clinique, sans que l’on sache encore si les cardiomyocytes expriment la même forme antigénique que les tumeurs, ou s’ils sont plus sensibles que d’autres cellules à l’antagonisation d’ErbB2. |
Anticorps agissant sur les fonctions cellulaires Agir sur la fonction d’un antigène, en bloquer l’activité par exemple, fut le premier succès de la sérothérapie antidiphtérique et antitétanique. Mais transposer ce type d’activité au niveau des antigènes membranaires ne fut possible qu’avec l’avènement des Acm qui ont permis de les caractériser et d’en révéler parfois les fonctions. Anticorps antagonistes de récepteurs Aux mains des immunologistes, les Acm furent utilisés en premier lieu pour décrypter le système immunitaire. C’est ainsi qu’on identifia des Acm capables d’empêcher l’interleukine (IL)-2 d’agir sur les lymphocytes T et donc de bloquer la prolifération et les réponses de ces derniers. L’un de ces Acm dirigés contre l’IL-2Rα (CD25), développé à Marseille, fut testé avec succès dans la prévention du rejet de greffe par une équipe de Nantes dès 1987 [
35]. Son développement pharmaceutique ne fut malheureusement pas poursuivi, mais l’idée fut reprise plusieurs années plus tard par Novartis avec le basiliximab (Simulect ®) et par Roche avec le daclizumab (Zénapax ®). Antagoniste de l’intégrine plaquettaire GPIIbIIIa (αIIbβ3), récepteur du fibrinogène, l’abciximab (RéoPro®) est le premier anticorps recombinant approuvé en clinique (1995) ; il fait suite à des premiers essais concluants avec son parent murin [
36]. Pour ce fragment Fab à activité antiagrégante plaquettaire, l’absence de portion Fc évite l’engagement des récepteurs Fc plaquettaires et l’activation des plaquettes (ce qui aurait provoqué l’inverse de l’effet souhaité), et confère au médicament une courte demi-vie, cohérente avec son indication dans la phase aiguë de l’infarctus du myocarde et la maîtrise du risque hémorragique. L’antagonisation de récepteurs membranaires peut aussi priver des cellules tumorales des facteurs de croissance nécessaires à leur prolifération et exercer un effet anti-tumoral, ce qui fut démontré dans les années 1980 avec un Acm dirigé contre le récepteur de l’EGF (epidermal growth factor) [
37]. Cet anticorps, chimérisé en IgG1κ humaine, est maintenant commercialisé sous le nom de cétuximab (Erbitux®) pour le traitement de divers carcinomes tandis que son concurrent est une IgG2κ intégralement humaine (panitumumab, Vectibix®). L’expérience clinique a montré que le cétuximab et le panitumumab ne sont efficaces que chez les patients dont le gène KRAS n’est pas muté [
38], signifiant que la tumeur doit être encore dépendante de facteurs de croissance pour que les anticorps soient efficaces. Le fait que le polymorphisme de FcγRIIIa influence la réponse au cétuximab chez des patients dont le gène KRAS est muté, situation où l’effet antagoniste de l’anticorps disparaît, suggère qu’il peut y avoir un effet cytotoxique propre de la molécule, par recrutement de mécanismes effecteurs [
39] (→). En cancérologie, même pour un anticorps antagoniste (de nombreux sont actuellement en développement : anti-IGF1-R, anti-cMet, etc.), le choix d’une IgG1 semble donc préférable à celui d’une IgG2 ou d’une IgG4, afin que les mécanismes de cytotoxicité dépendant des FcγR puissent venir compléter les effets antagonistes propres à l’anticorps.
(→) voir A. Bodmer et al., page 1090
Anticorps bloquant les interactions cellulaires L’identification des premières intégrines leucocytaires et de leur rôle dans l’adhérence et l’activation lymphocytaires conduisit rapidement à l’idée que des Acm interférant avec leurs fonctions puissent être exploités pour leurs fonctions immunosuppressives. C’est ainsi qu’un Acm murin anti-LFA-1 (lymphocyte function-associated antigen-1) fut testé en France à la fin des années 1980 dans des situations d’allogreffe de moelle [
40] puis d’organe, hélas sans succès. Ce n’est d’ailleurs que plus de dix ans plus tard qu’un anticorps humanisé IgG1 anti-LFA-1 (éfalizumab, Raptiva ®) obtint une approbation dans le traitement du psoriasis, bien que celle-ci vienne d’être suspendue en raison des risques infectieux inhérents à une trop forte immunosuppression (→). Dans le même esprit, la firme Elan développa un anticorps humanisé contre les intégrines α4 (α4β1/VLA-4 et α4β7) puisque ces dernières et leurs ligands sont nécessaires à la diapédèse des lymphocytes T inflammatoires au niveau de certains territoires comme le système nerveux central. Afin de limiter l’effet lymphopéniant et immunosuppresseur systémique, la sous-classe IgG4 fut choisie du fait de ses moindres interactions avec les effecteurs de l’immunité (→). Cet anticorps est le natalizumab (Tysabri ®), actuellement indiqué dans le traitement de la sclérose en plaques.
(→) voir E. Rigal et al., page 1135
(→) voir E. Rigal et al., page 1135
|
Autres voies de ciblage thérapeutique Par criblage de milliers d’Acm, il est possible de sélectionner un candidat médicament ciblant un épitope particulier d’un antigène donné et doué de propriétés pharmacologiques uniques. Il a ainsi été possible de trouver un anticorps capable de s’opposer au recrutement de la protéine prion PrPC [
41], ou d’empêcher la protéine Aβ de s’intégrer dans les plaques amyloïdes de la maladie d’Alzheimer [
42], ce qui suscite énormément d’espoir pour le traitement des maladies neurodégénératives. Du côté des antigènes membranaires, la découverte de Fas dans les années 1980 provient de l’observation que de très rares Acm anti-lymphocytaires pouvaient induire une cytotoxicité cellulaire [
43]. Même s’il apparut rapidement que les anticorps anti-Fas ne pourraient pas être utilisés in vivo, du fait de la cytolyse hépatique massive qu’ils provoquent, d’autres récepteurs de la famille FAS furent découverts, et en particulier les récepteurs de TRAIL (TNF-related apoptosis inducing ligand), majoritairement exprimés sur des cellules cancéreuses. Différents anticorps anti-TRAIL (mapatumumab, lexatumumab, etc.) sont actuellement en phase d’essais cliniques. Par ailleurs, dès le début de l’utilisation clinique du muromonab (OKT3), on a pu se rendre compte que des lymphocytes T n’exprimant plus la molécule CD3 pouvaient persister, et que cette disparition de l’antigène CD3 correspondait à un phénomène de modulation antigénique [
44]. Ce phénomène qui était déjà connu in vitro peut faire suite à la micro-agrégation de l’antigène par l’anticorps et à son internalisation, ou à son décapage enzymatique. Les lymphocytes T ayant subi une modulation antigénique de leur TCR se trouvant dans un état d’anergie, des anticorps anti-CD3 dépourvus de toute activité cytolytique sont actuellement en développement dans différentes maladies auto-immunes dont le diabète [
45]. À côté des molécules membranaires activatrices (molécules d’adhérence, de costimulation, récepteurs d’activation), on sait maintenant qu’il existe des molécules inhibitrices qui contrôlent les récepteurs activateurs et dont le blocage par des Acm renforce l’activité de ces derniers. C’est ainsi que des anticorps anti-CTLA-4 (cytotoxic T-lymphocyte antigen 4 ou CD152) (ipilimumab, trémelimumab) actuellement en développement clinique semblent accroître les réponses immunitaires spécifiques dans le mélanome malin bien que leur bénéfice soit à mettre en balance avec les signes d’auto-immunité qu’ils génèrent [
46]. On peut aussi imaginer de potentialiser l’action des cellules NK en bloquant leurs récepteurs KIR (killer inhibitory receptor), ce qui est à l’étude dans la leucémie aiguë myéloblastique et le myélome, avec l’anticorps candidat IPH 2101 développé par Innate Pharma à Marseille. Toujours dans l’esprit de stimuler les réponses immunitaires, certaines équipes cherchent à utiliser des anticorps anti-idiotypiques dans des protocoles de type vaccinal comme substituts d’antigènes tumoraux difficiles à extraire ou à synthétiser (antigènes glycolipidiques par exemple). Cette approche repose sur le fait que l’idiotype d’un anticorps peut être immunogène et que le paratope (site de reconnaissance de l’antigène) d’un anticorps anti-idiotypique mime la structure de l’antigène. Les anticorps ainsi synthétisés lors des réponses humorales sont à la fois dirigés contre l’idiotype de l’anticorps anti-idiotypique et contre l’antigène glycolipidique [
47], mais ces réponses restent encore loin d’être maîtrisées pour l’utilisation clinique. |
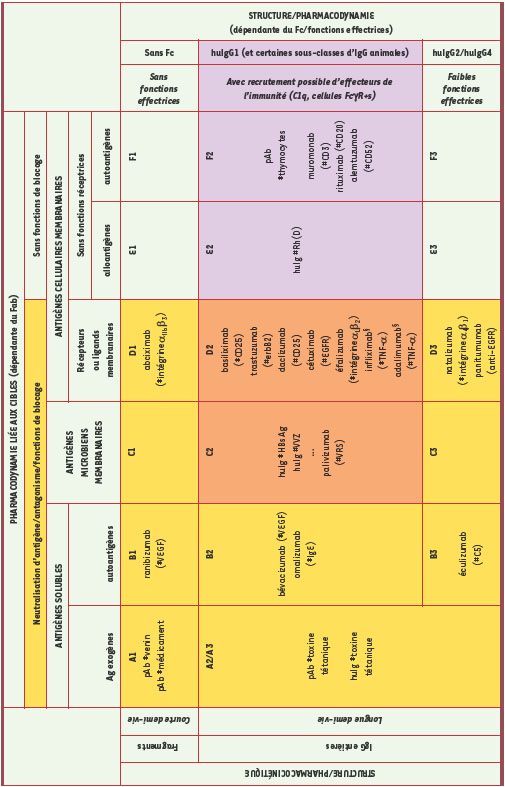
Les règles de nomenclature de la dénomination commune internationale des Acm (INN, international non-proprietary names) mettent en avant l’indication (-tu, -li, -ci, -vi, -bac, etc.) et le degré d’humanisation (-mo, -xi, -zu, -mu), sans tenir compte de différences aussi essentielles d’un point de vue pharmacologique que le ciblage d’un antigène soluble ou d’une protéine membranaire, ou que le fait qu’il s’agisse d’un anticorps entier ou d’un fragment, d’une IgG1, une IgG2 ou une IgG4. En conséquence, et pour conclure ce vaste panorama, nous proposons une classification pharmacologique unifiée de tous les anticorps thérapeutiques (Tableau II). Cette classification intègre aussi bien les anticorps monoclonaux que les préparations d’anticorps dérivés de sérums animaux ou de plasmas de donneurs (dénommés par opposition anticorps polyclonaux, puisque provenant par nature de plusieurs clones), et met l’accent sur leurs mécanismes d’action (leur pharmacodynamie) en intégrant des éléments de pharmacocinétique. Les immenses possibilités d’intervention thérapeutique offertes par les anticorps se reflètent sans doute dans la complexité du tableau. Pour simplifier, nous avons fait apparaître dans les plages jaunes les anticorps pour lesquels comptent principalement les fonctions liées à la portion Fab (neutralisation, antagonisation, etc.), et dans les plages roses les anticorps dont l’action repose sur le recrutement de fonctions effectrices par la portion Fc. Au carrefour (plages oranges) se trouvent les anticorps pour lesquels les fonctions strictement Fab et les fonctions Fc peuvent coopérer. Parions que l’avenir verra cette classification se compléter, au fur et à mesure que de nouveaux anticorps seront approuvés, fondés sur des principes thérapeutiques nouveaux et encore insoupçonnés.  | Tableau II.
Classification pharmacologique des anticorps thérapeutiques s’appuyant sur la nature des cibles et la pharmacodynamie dépendante du Fab (colonnes). Les relations structure/fonction déterminant la pharmacocinétique (lignes, à gauche) et les relations structure/fonction déterminant la pharmacodynamie dépendante du Fc (lignes, à droite). Abréviations : # : cible de l’AC ; pAb : anticorps polyclonaux d’origine animale ; huIg : IgG provenant de plasmas de donneurs ; HBs Ag : Ag de surface de l’hépatite B ; VVZ : virus varicelle zona ; VRS : virus respiratoire syncytial. § Les Acm anti-TNF-α ont été placés dans cette catégorie parce que le TNF-α est aussi une protéine membranaire et qu’ils peuvent exercer des effets sur les cellules qui l’expriment. |
|
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256 : 495–7. 2. Von Behring E, Kitasato S. Über das Zustandekommen der Diphterie-Immunität und der Tetanus-Immunität bei Thieren. Dtsch Med Wochenschr 1890; 49 : 1113–45. 3. Roux E, Martin L, Chaillou A. Trois cents cas de diphtérie traités par le sérum antidiphtérique. Ann Inst Pasteur 1894; 8 : 640–61. 4. Theakston RD, Warrell DA, Griffiths E. Report of a WHO workshop on the standardization and control of antivenoms. Toxicon 2003; 41 : 541–57. 5. Rénon L. Deux cas de tétanos traités par des injections de sang antitoxique (méthode de MM. Behring et Kitasato). Ann Inst Pasteur 1892; 6 : 233–41. 6. Roux E, Vaillard L. Contribution à l’étude du tétanos ; prévention et traitement par le sérum antitoxique. Ann Inst Pasteur 1893; 7 : 65–140. 7. Smolens J, Vogt A, Crawford M, Stokes JJ. The persistence in the human circulation of horse and human tetanus antitoxins. J Pediatr 1961; 59 : 899–902. 8. Rubbo SD, Suri JC. Passive immunization against tetanus with human immune globulin. Br Med J 1962; 2 : 79–81. 9. Gibaldi M. Anatomy of an antibody, and related misadventures in developing an effective treatment for septic shock. Pharmacotherapy 1993; 13 : 302–8. 10. Feldmann M, Maini RN. Discovery of TNF-alpha as a therapeutic target in rheumatoid arthritis: preclinical and clinical studies. Joint Bone Spine 2002; 69 : 12–8. 11. Maynard JA, Maassen CB, Leppla SH, et al. Protection against anthrax toxin by recombinant antibody fragments correlates with antigen affinity. Nat Biotechnol 2002; 20 : 597–601. 12. Nowakowski A, Wang C, Powers D, et al. Potent neutralization of botulinum neurotoxin by recombinant oligoclonal antibody. Proc Natl Acad Sci USA 2002; 99 : 11346–50. 13. Héricourt J, Richet C. Technique des procédés pour obtenir du sérum pur de chien et innocuité des injections de ce liquide chez l’homme. CR Soc Biol 1891; 3 : 33–5. 14. Héricourt J, Langlois P, Saint-Hilaire A. Effet thérapeutique des injections de sérum de chien (hémocyne) chez l’homme, dans le cours de la tuberculose. CR Soc Biol 1891; 3 : 45–53. 15. Legrain E. Histoire d’une épidémie de typhus exanthématique ; essais de sérothérapie ; action bienfaisante des injections sous-cutanées de sérum de typhiques convalescents. Gaz Hôp 1895; 68 : 766–8. 16. Debré R. La séroprophylaxie de la rougeole et ses applications pratiques. Monde Med 1925; 35 : 822–35. 17. Metchnikoff E. Études sur la résorption des cellules. Ann Inst Pasteur 1899; 13 : 737–69. 18. Brent L. A history of transplantation immunology. San Diego : Academic Press, 1997 : 247–65 et 319–20. 19. Finn R, Clarke CA, Donohoe WT, et al. Experimental studies on the prevention of Rh haemolytic disease. Br Med J 1961; 1 : 1486–90. 20. Kumpel BM. Efficacy of RhD monoclonal antibodies in clinical trials as replacement therapy for prophylactic anti-D immunoglobulin: more questions than answers. Vox Sang 2007; 93 : 99–111. 21. Béliard R, Waegemans T, Notelet D, et al. A human anti-D monoclonal antibody selected for enhanced FcgammaRIII engagement clears RhD+ autologous red cells in human volunteers as efficiently as polyclonal anti-D antibodies. Br J Haematol 2008; 141 : 109–19. 22. Cosimi AB, Burton RC, Colvin RB, et al. Treatment of acute renal allograft rejection with OKT3 monoclonal antibody. Transplantation 1981; 32 : 535–9. 23. Waldmann H. A personal history of the CAMPATH-1H antibody. Med Oncol 2002; 19 : S3–9. 24. Press OW, Appelbaum F, Ledbetter JA, et al. Monoclonal antibody 1F5 (anti-CD20) serotherapy of human B cell lymphomas. Blood 1987; 69 : 584–91. 25. Reff ME, Carner K, Chambers KS, et al. Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20. Blood 1994; 83 : 435–45. 26. Cartron G, Watier H, Golay J, Solal-Celigny P. From the bench to the bedside: ways to improve rituximab efficacy. Blood 2004; 104 : 2635–42. 27. Cartron G, Dacheux L, Salles G, et al. Therapeutic activity of humanized anti-CD20 monoclonal antibody and polymorphism in IgG Fc receptor FcgammaRIIIa gene. Blood 2002; 9 : 754–8. 28. Nopora A, Preiss S, Nicolini V, et al. Contribution of enhanced ADCC to superior in vivo efficacy of a novel type II humanized, third generation CD20 antibody (GA101) in NHL xenograft models. AACR Meeting Abstracts 2008 : 3991.
29. De Romeuf C, Dutertre CA, Le Garff-Tavernier M, et al. Chronic lymphocytic leukaemia cells are efficiently killed by an anti-CD20 monoclonal antibody selected for improved engagement of FcgammaRIIIA/CD16. Br J Haematol 2008; 140 : 635–43. 30. Héricourt J, Richet C. De la transfusion péritonéale, et de l’immunité qu’elle confère. CR Acad Sci 1888; 107 : 748–50. 31. Héricourt J, Richet C. Traitement d’un cas de sarcome par la sérothérapie. CR Acad Sci 1895; 120 : 948–50. 32. Héricourt J, Richet C. De la sérothérapie dans le traitement du cancer. CR Acad Sci 1895; 121 : 567–9. 33. Miller RA, Maloney DG, Warnke R, Levy R. Treatment of B cell lymphoma with monoclonal anti-idiotype antibody. N Engl J Med 1982; 306 : 517–22. 34. Carter P, Presta L, Gorman CM, et al. Humanization of an anti-p185HER2 antibody for human cancer therapy. Proc Natl Acad Sci USA 1992; 89 : 4285–9. 35. Soulillou JP, Peyronnet P, Le Mauff B, et al. Prevention of rejection of kidney transplants by monoclonal antibody directed against interleukin 2. Lancet 1987; 1 :1339–42. 36. Gold HK, Gimple LW, Yasuda T, et al. Pharmacodynamic study of F(ab’)2 fragments of murine monoclonal antibody 7E3 directed against human platelet glycoprotein IIb/IIIa in patients with unstable angina pectoris. J Clin Invest 1990; 86 : 651–9. 37. Masui H, Kawamoto T, Sato JD, et al. Growth inhibition of human tumor cells in athymic mice by anti-epidermal growth factor receptor monoclonal antibodies. Cancer Res 1984; 44 : 1002–7. 38. Lièvre A, Bachet JB, Le Corre D, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66 : 3992–5. 39. Bibeau F, Lopez-Crapez E, Di Fiore F, et al. Impact of FcγRIIa-FcγRIIIa polymorphisms and KRAS mutations on the clinical outcome of patients with metastatic colorectal cancer treated with cetuximab plus irinotecan. J Clin Oncol 2009; 27 : 1122–9. 40. Perez N, Le Deist F, Chatenoud L, et al. In vivo infusion of anti LFA-1 antibody in HLA non-identical bone marrow transplantation in children: serum concentrations and biological effects. Bone Marrow Transplant 1989; 4 : 379–84. 41. Antonyuk SV, Trevitt CR, Strange RW, et al. Crystal structure of human prion protein bound to a therapeutic antibody. Proc Natl Acad Sci USA 2009; 106 : 2554–8. 42. Levites Y, Smithson LA, Price RW, et al. Insights into the mechanisms of action of anti-Abeta antibodies in Alzheimer’s disease mouse models. FASEB J 2006; 20 : 2576–8. 43. Yonehara S. Effects of anti-Fas antibodies on lymphocytes and other organs: preparation of original and new monoclonal antibodies and amelioration of systemic autoimmune disease. Int Rev Immunol 1999;18 : 329–45. 44. Chatenoud L, Baudrihaye MF, Kreis H, et al. Human in vivo antigenic modulation induced by the anti-T cell OKT3 monoclonal antibody. Eur J Immunol 1982; 12 : 979–82. 45. Chatenoud L, Bluestone JA. CD3-specific antibodies: a portal to the treatment of autoimmunity. Nat Rev Immunol 2007; 7 : 622–32. 46. Weber J. Ipilimumab: controversies in its development, utility and autoimmune adverse events. Cancer Immunol Immunother 2009; 58 : 823–30. 47. Hernández AM, Toledo D, Martínez D, et al. Characterization of the antibody response against NeuGcGM3 ganglioside elicited in non-small cell lung cancer patients immunized with an anti-idiotype antibody. J Immunol 2008; 181 : 6625–34. |