| |
| Med Sci (Paris). 2009 December; 25(12): 1053–1056. Published online 2009 December 15. doi: 10.1051/medsci/200925121053.FcRn, un récepteur d’IgG aux multiples facettes Charlotte Magdelaine-Beuzelin,1 Marc Ohresser,1 and Hervé Watier1* 1Université François Rabelais de Tours , CNRS, UMR 6239, équipe Immunogénomique et anticorps thérapeutiques , CHRU de Tours, Laboratoire d’immunologie, 10, boulevard Tonnellé, 37032 Tours Cedex 1, France |
Il y a cent ans, Ransom rapporta le cas d’une femme enceinte atteinte de diphtérie qu’il traita par sérothérapie. La patiente accoucha 24 heures après avoir reçu les deux injections curatives et curieusement l’enfant nouveau-né ne présenta pas de signes de maladie. Il conclut alors son observation en supposant avoir donné une dose prophylactique à l’enfant « via le sang de sa mère » [
1]. Il fallut attendre plus d’un demi-siècle avant que Brambell n’élucide le phénomène : partant de l’observation que seules les IgG, et non les autres classes d’immunoglobulines, avaient une demi-vie plasmatique longue et traversaient le placenta, que le phénomène était saturable et que la portion Fc était nécessaire, il postula l’existence d’un récepteur dédié [
2]. Puisque les cellules impliquées dans le transfert des IgG présentaient des microvillosités, il imagina que les IgG pouvaient être internalisées et avança que la fixation à ce récepteur les protègerait de la dégradation par les enzymes lysosomales, retardant leur catabolisme [2,
3]. Tout était dit ! Ce que Brambell n’avait pas démontré, il l’avait pressenti. Ce mystérieux récepteur prit définitivement le nom de FcRn, neonatal Fc receptor, lorsqu’il fut identifié chez le rat [
4]. FcRn est maintenant parfaitement caractérisé du point de vue de sa structure et de sa très vaste distribution dans les organismes, du fœtus à l’adulte, et son rôle clé dans la protection des IgG vis-à-vis du catabolisme des protéines plasmatiques en fait un acteur incontournable de la pharmacocinétique des anticorps thérapeutiques. |
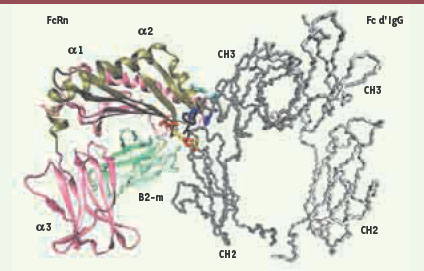
Structure du FcRn et interaction avec les IgG La première surprise fut de découvrir qu’à la différence des autres FcγR, FcRn appartenait à la famille des molécules du CMH (complexe majeur d’histocompatibilité) de classe I [4] (Figure 1). La cocristallisation de l’ectodomaine du FcRn avec une portion Fc d’IgG montre cette dernière « tête en bas », prise en tenaille entre deux molécules de FcRn (Figures 1 et 2). Sur l’IgG, la région de liaison au FcRn chevauche les domaines CH2 et CH3 (Figure 1) et implique notamment les résidus His310 du domaine CH2 et His435 du domaine CH3 (remplacée par une arginine sur les IgG3) [
5]. Ces deux histidines sont chargées positivement à pH inférieur à 6,5, formant des ponts salins avec les résidus correspondants sur le FcRn, ce qu’un pH supérieur à 7,0 fait disparaître [5].  | Figure 1.
Représentation tridimensionnelle de l’interaction entre FcRn et IgG. Le FcRn est un hétérodimère composé de la β2-microglobuline (β2-m en vert) associée de façon non covalente à une chaîne lourde α transmembranaire (45 kDa) repliée en trois domaines extracellulaires : α1 (rose), α2 (bronze) et α3 (rose) seuls ici représentés. Bien que le FcRn soit apparenté aux molécules de classe I du CMH, la cavité localisée entre les domaines α1 et α2 est trop étroite pour accueillir un peptide et exercer une fonction de présentation d’antigène. Le site de fixation des IgG sur FcRn est différent de celui de l’albumine et la fixation des IgG n’influence pas celle de l’albumine [
7]. Le FcRn se lie au Fc de l’IgG (gris) à l’interface entre les domaines constants CH2 et CH3, c’est-à-dire un site distinct de celui impliqué dans la liaison au C1q et aux FcγR. L’interaction est centrée sur des résidus hydrophobes associant le Trp133 du FcRn et l’Ile253 du Fc (résidus noirs), renforcée par des ponts salins impliquant sur FcRn Glu117, Glu118, Asp132 et sur Fc His310, Gln311 et His435 respectivement [ 5]. Les acides aminés impliqués dans ces liaisons sont respectivement figurés en jaune, rouge, bleu et cyan. La figure a été obtenue à partir du cocristal FcRn-Fc d’IgG de rat ( protein data bank (PDB) 1frt). La portion Fc du cocristal a été remplacée par son équivalent humain (PDB 1e4k) en superposant les deux Fc afin de donner à la portion humaine une bonne orientation vis-à-vis du FcRn. |
Les séquences du FcRn de l’homme et de la souris ne sont homologues qu’à 65 % [
6], l’une des différences notables étant que le FcRn murin présente un site de N-glycosylation (Asn128) absent du FcRn humain et que ce glycanne semble influencer l’affinité de la liaison [5]. |
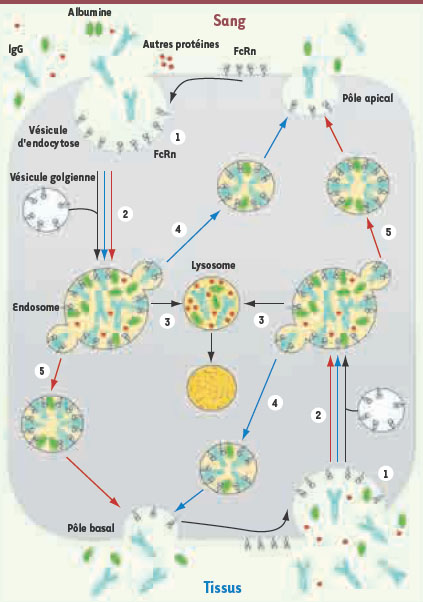
L’une des fonctions majeures du FcRn est connue sous le nom de recyclage. Elle consiste à extraire les IgG de la voie du catabolisme endothélial des protéines plasmatiques pour les restituer intactes dans la circulation (Figure 2, fléchage bleu). Les IgG partagent cette propriété en exclusivité avec l’albumine qui se lie aussi à FcRn et bénéficie du recyclage [7]. Chez la souris, on a pu calculer que FcRn protège de la dégradation la moitié des molécules d’albumine internalisées et quatre cinquièmes des IgG, ce qui pourrait être un mécanisme énergétiquement plus économique pour l’organisme que la synthèse de novo de ces molécules [7]. Ce recyclage explique leur demi-vie longue (trois semaines pour les IgG), tout en permettant le maintien de concentrations plasmatiques élevées puisqu’IgG et albumine représentent 70 % des protéines plasmatiques. Le catabolisme des IgG et de l’albumine augmente lorsque leurs concentrations sanguines sont trop élevées, suite à la saturation du FcRn qui ne peut en recycler davantage [2]. La transcytose des IgG d’un pôle à l’autre des épithéliums ou des endothéliums est la deuxième fonction majeure du FcRn permettant d’assurer leur biodistribution dans l’organisme (Figure 2, fléchage orange). Comme pour le recyclage, FcRn se trouve ainsi étroitement associé au trafic vésiculaire et aux variations de pH qui l’accompagnent. À pH neutre (compartiment extracellulaire), la liaison des IgG au FcRn est négligeable mais la protonation des résidus histidine de l’IgG à pH légèrement acide permet de créer la liaison à FcRn.  | Figure 2.
Représentation schématique du trafic cellulaire de FcRn. Le FcRn est largement exprimé dans les cellules endothéliales, comme dans le schéma, et épithéliales. Dans ces cellules polarisées, FcRn peut être exprimé au niveau de la membrane plasmique, se distribuant plus ou moins équitablement entre les pôles apical et basal selon les types cellulaires. En réalité, la majeure partie de FcRn se trouve dans les compartiments vésiculaires intracellulaires. 1. Les cellules exprimant FcRn sont douées de pinocytose et peuvent internaliser à leur pôle apical et/ou basal les protéines solubles présentes dans l’environnement, dont l’albumine (en vert) et les IgG (en bleu). Dans ces vésicules d’endocytose, le pH est neutre et FcRn ne s’associe ni aux IgG, ni à l’albumine. 2. La fusion de ces vésicules avec d’autres vésicules d’origine golgienne produit un endosome dont le pH s’acidifie, ce qui permet au FcRn de se lier aux IgG et à l’albumine, dans la limite des molécules de FcRn disponibles. 3. Les IgG et l’albumine excédentaires, ainsi que les autres protéines ne se liant pas à FcRn (en rouge), suivent la voie lysosomale de plus en plus acide (figurée en jaune, fléchage noir) conduisant à leur dégradation. 4. Les IgG et l’albumine captées par FcRn sont recyclées, c’est-à-dire reconduites à la surface apicale et/ou basale (fléchage bleu). En fusionnant avec la membrane plasmique, le pH remonte et les IgG comme l’albumine se dissocient de FcRn, ce qui permet leur libération dans le milieu extracellulaire. FcRn se retrouve alors temporairement exprimé en surface, avant d’être de nouveau internalisé. 5. Le FcRn assure aussi le transfert des IgG et de l’albumine d’un pôle à l’autre de la cellule (fléchage orange) dans le sens apical vers basal ou à l’inverse. |
Certains résidus de la portion intracytoplasmique de FcRn interviennent dans sa localisation vésiculaire, et il semble que ce soit la phosphorylation d’un résidu sérine qui permette d’orienter FcRn vers un mécanisme de transcytose plutôt que de recyclage [
8]. La fonction de transcytose intervient pour favoriser le passage des IgG au travers des endothéliums et des barrières fœtoplacentaire, intestinale, biliaire ou glomérulaire, ou à l’inverse probablement pour refouler les IgG ayant franchi la barrière hématoméningée ou hématorétinienne [
9]. Enfin, une troisième grande fonction du FcRn serait de coopérer avec les FcγR classiques dans les fonctions de phagocytose et de présentation des complexes immuns, en prenant peut-être le relais des FcγR pour la liaison aux IgG dans les compartiments endosomiaux acides. Cette fonction encore mal connue de FcRn explique sans doute qu’il soit exprimé dans les cellules présentatrices d’antigène [9] et les polynucléaires neutrophiles [6]. |
FcRn et Ac thérapeutiques On sait maintenant que l’échec clinique des anticorps monoclonaux murins vient de leur très courte demi-vie chez l’homme résultant de la faible affinité du FcRn humain pour les IgG de souris [
10]. La solution fut apportée par l’humanisation de la portion Fc qui réduit aussi l’immunogénicité et améliore l’interaction avec les mécanismes effecteurs. L’étape ultérieure serait maintenant de pouvoir augmenter la demi-vie des anticorps thérapeutiques afin d’accroître leur efficacité et/ou de réduire les doses administrées. Cette amélioration pourrait passer par la sélection d’anticorps à portion Fc mutée ayant une affinité pour le FcRn accrue à pH acide. Néanmoins, le gain d’affinité obtenu avec ces mutants (jusqu’à vingt-huit fois celle de l’IgG sauvage) n’est pas systématiquement associé à une amélioration de la pharmacocinétique et en particulier à un allongement de la demi-vie [
11]. FcRn n’a peut-être donc pas encore livré tous ses mystères…
FcRn, a multifaceted IgG receptor
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Ransom DR. Prophylactic effect of antitoxin on the child in utero. J Am Med Ass 1909; Iii : 556. 2. Brambell FWR, Hemmings WA, Morris IG. A theoretical model of γ-globulin catabolism. Nature 1964; 203 : 1352–5. 3. Brambell FWR. The transmission of immune globulins from the mother to the fœtal and newborn young. Proc Nutr Soc 1969; 28 : 35–41. 4. Simister NE, Mostov KE. An Fc receptor structurally related to MHC class I antigens. Nature 1989; 337 : 184–7. 5. Martin WL, West AP Jr, Gan L, Bjorkman PJ. Crystal structure at 2.8 Å of an FcRn/heterodimeric Fc complex: mechanism of pH-dependent binding. Mol Cell 2001; 7 : 867–77. 6. Vidarsson G, Stemerding AM, Stapleton NM, et al. FcRn: an IgG receptor on phagocytes with a novel role in phagocytosis. Blood 2006; 108 : 3573–9. 7. Anderson CL, Chaudhury C, Kim J, et al. Perspective-FcRn transports albumin: relevance to immunology and medicine. Trends Immunol 2006; 27 : 343–8. 8. McCarthy KM, Lam M, Subramanian L, et al. Effects of mutations in potential phosphorylation sites on transcytosis of FcRn. J Cell Sci 2001; 114 : 1591–8. 9. Roopenian DC, Akilesh S. FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol 2007; 7 : 715–25. 10. Ober RJ, Radu CG, Ghetie V. Differences in promiscuity for antibody-FcRn interactions across species: implications for therapeutic antibodies. Int Immunol 2001; 13 : 1551–9. 11. Datta-Mannan A, Witcher DR, Tang Y, et al. Monoclonal antibody clearance. Impact of modulating the interaction of IgG with the neonatal Fc receptor. J Biol Chem 2007; 282 : 1709–17. |