Les systèmes bactériens
Depuis l’avènement de la biologie moléculaire,
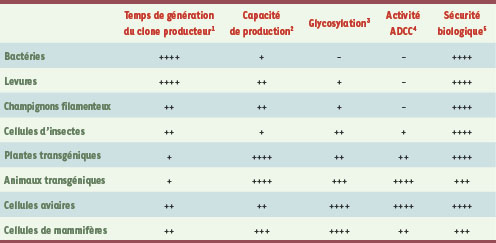
Escherichia coli est le système biologique de choix pour la production à grande échelle de protéines recombinantes, en raison notamment de la facilité et de la rapidité de génération de clones producteurs et de coûts de production avantageux
(Tableau I). Mais la limitation majeure de ce système réside dans l’incapacité des bactéries à synthétiser des protéines complexes correctement assemblées et glycosylées. Si des anticorps complets aglycosylés, et donc dépourvus d’activité effectrice, ont déjà été exprimés dans
Escherichia coli, les bactéries sont surtout utilisées pour la production de fragments artificiels d’anticorps tels que les fragments FV ou scFV, pour lesquels une modification post-traductionnelle n’est pas requise [
6] (→). Ces fragments d’anticorps conservent bien tout ou partie de leur capacité de fixation spécifique des antigènes ciblés, mais leur courte demi-vie, leur incapacité à activer les cellules effectrices, et la mauvaise expression par les bactéries des fragments nécessitant la formation de ponts disulfures (ex : Fab et F(ab’)
2) ont restreint leurs applications à la production de réactifs de recherche. Aucun anticorps ou fragment d’anticorps produit dans des bactéries n’est ainsi aujourd’hui commercialisé, et le ReoPro
®, seul fragment Fab ayant atteint le marché pour la prévention des complications cardiaques ischémiques, est produit dans des cellules murines Sp2/0 [
2] (→). La découverte en 1993 que les camélidés produisent naturellement des anticorps de forte affinité mais de petite taille, composés uniquement d’une chaîne lourde, plus résistants aux variations de température et de pH et donc plus aptes à être efficacement produits en bactéries, a relancé l’intérêt de ce système de production [
7]. Ainsi, la société Ablynx (Belgique), fondée en 2001 pour exploiter commercialement les anticorps de camélidés, produit ces molécules en bactéries ou en levures (
voir ci-dessous) avec des rendements supérieurs à 1 gramme par litre de fermentation. Ces anticorps naturels de camélidés présentent des avantages notables par rapport aux fragments artificiels d’anticorps humains, et attisent un intérêt certain dans l’industrie pharmaceutique. Mais leur faible demi-vie dans la circulation humaine, l’absence d’activité effectrice et leur éventuelle immunogénicité suscitent de nombreuses interrogations quant à la place réelle de cette technologie dans l’arsenal thérapeutique. Les études cliniques en cours devraient prochainement apporter des réponses à ces questions.
(→) voir P. Chames et D. Baty, page 1159
(→) voir O. Cochet et M. Chartrain, page 1078
Les levures et champignons filamenteux
Comme les systèmes bactériens, les levures et champignons filamenteux offrent une forte productivité (> 1 g/l), une robustesse des procédés industriels, un faible coût des milieux de culture et une présence sur le marché de produits approuvés par les autorités réglementaires. Mais contrairement à
Escherichia coli, ces organismes peuvent également produire des protéines complexes possédant des ponts disulfures, et certaines de ces souches disposent d’une machinerie de glycosylation permettant la synthèse de N-glycannes sur les protéines recombinantes
(Tableau I). Les industries agroalimentaires et textiles exploitent déjà commercialement ces organismes,
Aspergillus niger et
Trichoderma reesi étant utilisés notamment pour la production de nombreuses enzymes recombinantes par des sociétés telles que Genencor (États-Unis) ou NovoNordisk (Danemark). S
accharomyces cerevisiae est utilisée commercialement pour la production de nombreuses protéines thérapeutiques simples comme l’insuline, l’hirudine ou des protéines vaccinales contre l’hépatite B [
8]. La production d’Acm fonctionnels a été démontrée plus récemment pour la levure
Pichia Pastoris [
9] et pour
Aspergillus niger [
10], ces deux souches ayant la capacité de réaliser une N-glycosylation complexe mais caractérisée par la présence de structures riches en mannoses [
11]. Cette glycosylation particulière pouvant altérer les propriétés des anticorps, plusieurs équipes ont entrepris d’humaniser les voies de glycosylation de ces organismes en éliminant les gènes contrôlant l’hypermannosylation, et en introduisant des gènes catalysant la synthèse et l’addition de glycannes humains [
12,
13]. Les avancées en ingénierie de la glycosylation dans
Pichia pastoris ont ainsi permis la production d’anticorps biologiquement actifs avec un profil de glycosylation homogène proche de celui d’anticorps humains naturels. L’humanisation des voies de biosynthèse des glycannes chez la levure et les champignons filamenteux constitue donc une approche encore en développement mais très prometteuse ; une illustration est donnée par le rachat pour 400 millions de dollars de la société américaine GlycoFi (New Hampshire) par le géant pharmaceutique Merck.
Les cellules d’insectes
La production de protéines recombinantes en cellules d’insectes infectées par un vecteur dérivé du baculovirus est très populaire dans les laboratoires de recherche. Les baculovirus sont non pathogènes pour l’homme et les cellules d’insectes présentent l’avantage de pouvoir produire naturellement des protéines complexes glycosylées. De nombreuses glycoprotéines recombinantes, dont des anticorps biologiquement actifs, ont ainsi été produites dans ce système [
14]. Cependant, le profil de glycosylation naturellement retrouvé chez les cellules d’insectes se caractérise par la présence de structures glycanniques simples de type oligomannose ou pauci-mannose, pouvant également porter des résidus α1,3-fucose immunogènes pour l’homme [
15]. Bien que certaines cellules d’insectes comme les cellules High Five™ de la société américaine Invitrogen aient permis de produire des IgG présentant des résidus terminaux galactosylés [
16], des approches d’humanisation génétique des voies de glycosylation sont ici encore nécessaires [
17]. Par ailleurs, l’étape d’infection lytique par le baculovirus recombinant constitue une limitation contraignante pour tout développement industriel, car celle-ci impose de disposer de larges stocks de virus et d’effectuer de nombreuses campagnes d’infection et de production. Enfin, les cellules d’insectes sont caractérisées par une forte activité protéasique pouvant altérer la protéine exprimée. D’autres systèmes alternatifs ont été envisagés, tels que celui de la société américaine Chesapeake PERL (Maryland) qui infecte directement des larves d’insectes par voie orale par des vecteurs baculovirus et extrait la protéine recombinante des larves infectées. Ce système d’expression original a permis l’expression de fragments d’anticorps (Fab) fonctionnels dans les larves
Trichoplusia ni, avec un rendement supérieur à 1 gramme par kg de larves [
18], mais l’application de cette technologie se restreint encore aux réactifs de recherche, une mise à l’échelle industrielle étant difficilement envisageable, et à notre connaissance aucun Acm complet n’a été produit dans ces larves.
Les plantes transgéniques
L’utilisation de plantes transgéniques pour la production de protéines thérapeutiques complexes a longtemps été considérée comme une voie de fort potentiel technologique et économique
(Tableau I). La quantité de protéines recombinantes pouvant être produite dans les plantes est virtuellement infinie car elle ne dépend en principe que des surfaces mises en culture. De plus, les techniques de l’agriculture industrielle offrent une grande flexibilité pour l’augmentation en échelle (
scale up) et les coûts associés y sont comparativement faibles. Les plantes sont aujourd’hui aisément modifiables génétiquement et la conservation de clones producteurs est peu contraignante. Un Acm a été produit dès 1989 dans les feuilles de
Nicotiana tabacum, des productions transitoires ou stables ayant été également réalisées avec succès dans les graines de soja, de riz, de blé ou dans la laitue [
19,
20]. Ces travaux ont cependant également révélé la présence dans les protéines recombinantes de structures glycanniques non humaines potentiellement immunogènes chez l’homme (xylose et α1-3 fucose) et l’absence de galactose et d’acide sialique [
19,
20]. Comme pour les levures ou les champignons filamenteux, des travaux génétiques d’humanisation de la machinerie de glycosylation sont entrepris [
21,
22]. Mais malgré ces investissements scientifiques et financiers conséquents, le développement commercial de ces plateformes transgéniques est sérieusement compromis en raison d’une vive opposition publique, notamment en Europe, suscitée par les risques de dissémination incontrôlée des plantes transgéniques cultivées en plein champ. Une culture en serre fermée est possible, mais affecterait les coûts de production et donc l’attractivité du système. Une alternative combinant les avantages des plantes et des cellules en culture est considérée avec attention depuis peu, consistant en une culture en bioréacteur de cellules de plantes, de mousses ou de microalgues [
23–
25]. La société américaine Biolex Therapeutics a ainsi développé un système d’expression basé sur la culture des lentilles d’eau
Lemna minor. Ces plantes possèdent un temps de génération court d’environ 36 heures, peuvent être modifiées génétiquement et sont capables de produire des Acm à des taux pouvant atteindre 1 gramme d’anticorps solubles par kilogramme de biomasse. Cette société a par ailleurs réussi à humaniser sa plateforme
Lemna minor par expression d’ARN interférents bloquant la synthèse des enzymes β1.2-xylosyltransférase et α1.3-fucosyltransférase endogènes [
25]. Ces plantes génétiquement modifiées ont permis de produire des anticorps anti-CD30 dépourvus de xylose et d’α1-3 fucose, et dont l’activité ADCC est améliorée vis-à-vis du même anticorps produit en cellules CHO. De manière similaire, la société allemande Greenovation Biotech a quant à elle réussi à développer une plate-forme de production basée sur la mousse
Psyscomitrilla patens, et à démontrer sa capacité à modifier génétiquement cet organisme et à produire un Acm en photo-bioréacteur avec un profil de glycosylation proche de celui de l’anticorps naturel ainsi qu’une activité ADCC améliorée en raison de l’absence de résidus fucose [
26]. L’avantage principal de cette technologie réside dans des conditions de culture simples et peu coûteuses, la mousse ne nécessitant que de la lumière, du gaz carbonique, de l’eau et des sels minéraux. En revanche, le développement de la plate-forme est encore peu avancé et la capacité de la société à produire efficacement à grande échelle des anticorps fonctionnels n’est pas établie.
Les animaux transgéniques
De nombreuses sociétés de biotechnologies telles GTC Biotherapeutics aux États-Unis ou Pharming aux Pays-Bas investissent activement depuis des années dans la technologie des animaux transgéniques pour la production de protéines thérapeutiques [
27]. Ces animaux peuvent permettre en théorie une production industrielle économiquement compétitive dans des organes synthétisant naturellement des glycoprotéines complexes, comme les glandes mammaires
(Tableau I). L’intérêt de ce système pour la production d’Acm fonctionnels a été démontré dans le lait de souris transgéniques [
28] et de chèvres. Plus spécifiquement, la société GTC Biotherapeutics a démontré pour plusieurs Acm chimériques, humanisés ou humains sa capacité à produire des quantités supérieures à 1 gramme par litre de lait de chèvre. L’activité ADCC de certains anticorps était renforcée en raison d’un faible taux de fucose. En revanche les taux de mannose fortement élevés pourraient altérer les propriétés de ces Acm (→), bien que des études de pharmacologie
in vivo n’aient pas révélé de différences notables avec les anticorps produits en cellules CHO. Par ailleurs, la présence chez la chèvre d’acides sialiques non humains N-glycosyl neuraminiques [
29] pourrait également conférer une immunogénicité à ces anticorps. Les conséquences de ces différences de structure glycanniques par rapport aux anticorps humains devront donc être attentivement étudiées et caractérisées avant toute application clinique (→). Si le développement commercial de produits thérapeutiques issus d’animaux transgéniques s’est longtemps heurté à une réticence des autorités réglementaires vis-à-vis des produits d’origine transgénique, l’approbation donnée en 2006 par l’Agence européenne du médicament (EMEA) et en février 2009 par la
Food and drug administration (FDA) américaine, à GTC Biotherapeutics pour la mise sur le marché de l’ATryn
®, une antithrombine recombinante produite dans le lait de chèvres transgéniques, constitue une étape majeure validant l’acceptation réglementaire de la technologie, et elle en renforce l’intérêt.
(→) voir P. Stas et I. Lasters, page 1070
(→) voir L. Manache et al., page 1063
La production d’Acm dans le blanc d’œuf de poules transgéniques a été également longtemps considérée comme une stratégie à fort potentiel en raison de techniques d’élevage industriel bien établies, de la familiarité des autorités réglementaires avec les produits de santé issus d’œufs de poules - de nombreux vaccins sont produits depuis des décennies sur les œufs embryonnés - et du développement de techniques de modification génétique de cellules souches embryonnaires ou d’embryons de poules. Ainsi, en 2005, la société américaine Origen Therapeutics a réussi à générer des poules transgéniques exprimant un Acm anti-CD20 avec un rendement de production de 3 mg par œuf [
30]. Le profil de glycosylation de cet anticorps s’est révélé similaire à celui de l’anticorps produit en cellules CHO mais son activité ADCC s’est avérée bien supérieure en raison du taux en résidus fucose remarquablement bas, propriété caractéristique des systèmes aviaires [29, 30]. Malgré ces résultats encourageants, et contrairement aux mammifères transgéniques, cette plateforme reste peu développée en raison de difficultés techniques majeures dans l’obtention d’un taux d’animaux transgéniques satisfaisant. Bien que des progrès importants aient été réalisés dans l’isolement et la culture de cellules souches embryonnaires aviaires, leur exploitation pour la production d’animaux transgéniques reste donc encore un objectif lointain.
Les cellules aviaires
L’investissement constant dans les systèmes mammaliens a abouti au développement de matériels et technologies de culture adaptés à des cellules capables de croître en suspension dans un milieu dépourvu de sérum animal [
2]. Un système de production non mammalien adapté à ces matériels et technologies, et qui aurait la capacité de produire des anticorps normalement glycosylés mais ayant une meilleure activité biologique, présenterait des avantages certains. L’observation que les espèces aviaires produisent naturellement des anticorps pauvres en résidus fucose, et que les poules transgéniques expriment des Acm avec un profil de glycosylation normal mais un taux faible de fucose [
29,
30], suggère qu’une lignée cellulaire aviaire continue capable de croître en suspension pourrait constituer une plateforme précieuse pour la production d’Acm à activité ADCC renforcée. La société Vivalis (Saint-Herblain, France) a ainsi exploité avec succès les propriétés biologiques uniques des cellules souches embryonnaires de canard pour dériver une lignée cellulaire propriétaire appelée EB66, combinant les caractéristiques des cellules souches (immortalité et stabilité génétique) et des cellules CHO (croissance en suspension à de hautes densités cellulaires, croissance en milieu sans sérum, modification génétique aisée). Cette lignée cellulaire a été établie selon un procédé n’incluant aucune modification génétique, chimique ou virale, et un dossier réglementaire détaillé (
biological master file) décrivant son origine et son statut sanitaire a été constitué, permettant, s’il existe une licence d’exploitation de cette cellule, de déposer un dossier d’autorisation d’essais cliniques pour tout produit biologique manufacturé sur la cellule. Cette technologie est déjà exploitée sous licence par la majorité des industriels du vaccin dans le monde pour la production en bioréacteurs de vaccins traditionnellement produits sur des œufs embryonnés de poule, ce qui est le cas de nombreux vaccins humains et vétérinaires, notamment le vaccin contre la grippe. La cellule EB66 peut également être efficacement modifiée génétiquement et l’activité ADCC de plusieurs Acm produits dans cette lignée cellulaire était supérieure d’un facteur 20 à l’activité des mêmes anticorps produits en cellules CHO. La production d’Acm dans ces cellules aviaires EB66 permet en conséquence de combiner plusieurs avantages : (1) l’utilisation d’infrastructures et de procédés de production existants et bien maîtrisés, identiques à ceux mis en œuvre pour les systèmes mammaliens ; (2) une reconnaissance réglementaire conférée par les développements industriels en cours dans le domaine du vaccin ; (3) une production d’Acm recombinants présentant un profil de glycosylation normal mais avec la caractéristique remarquable - issue du règne aviaire - d’un taux très réduit de résidus fucose, et en conséquence d’une activité biologique ADCC fortement accrue. La technologie EB66 étant cependant récente, une optimisation des rendements de production est encore en cours afin d’atteindre des productivités proches de celles obtenues avec les cellules CHO.