| |
| Med Sci (Paris). 2009 August; 25(8-9): 673–675. Published online 2009 August 15. doi: 10.1051/medsci/2009258-9673.Un nouvel axe du mal tumoral ? Philippe Coulombe,1 Geneviève Rodier,2 and Sylvain Meloche3* 1Institut de génétique humaine, CNRS-UPR 1142, 34396 Montpellier, France 2Institut de génétique moléculaire de Montpellier, CNRS-UMII, 34293 Montpellier, France 3Institut de recherche en immunologie et cancérologie, Départements de pharmacologie et de biologie moléculaire, Université de Montréal, Montréal (Québec) H3C 3J7 Canada MeSH keywords: Carcinome papillaire, Cycle cellulaire, Dual-Specificity Phosphatases, Gènes suppresseurs de tumeur, Humains, Tumeurs du rein, Tumeurs, Antigène nucléaire de prolifération cellulaire, Protéines associées aux kinases de la phase S |
Les enzymes ubiquitines ligases au cours du cycle cellulaire Le cycle cellulaire est l’ensemble des événements qui permettent à une cellule d’engendrer deux cellules filles. La division cellulaire commence par la duplication des composants de la cellule, incluant la réplication fidèle des chromosomes lors de la phase de synthèse d’ADN (phase S). Ces composants sont ensuite répartis (le plus souvent également)entre deux cellules filles lors de la mitose (phase M). La phosphorylation et la protéolyse sélectives des protéines sont deux mécanismes qui coordonnent la progression au cours des phases du cycle cellulaire. Ainsi, les protéine kinases Cdk (cyclin-dependent kinases) favorisent la reproduction cellulaire en stimulant l’entrée des cellules en phase S et en mitose. Leur activité au cours du cycle cellulaire est régulée par l’expression de leurs sous-unités activatrices (cyclines) et inhibitrices (CKI, Cdk inhibitor). L’abondance de ces régulateurs dépend d’une machinerie protéolytique très conservée dans l’évolution : le système ubiquitine-protéasome [
1]. L’attachement de molécules d’ubiquitine aux protéines cibles qui sont ensuite dégradées par le protéasome est catalysé par les enzymes ubiquitine ligases ou E3. Les complexes APC (anaphase-promoting complex) et SCF (Skp1/Cullin 1/F-box) sont les deux E3 essentielles aux transitions du cycle cellulaire [1]. L’activité de l’APC est importante pour la progression en mitose et le maintien de la cellule en phase G1 jusqu’à la phase S (Figure 1A). L’APC reconnaît ses divers substrats en se liant à deux sous-unités activatrices : Cdc20 (active en mitose) et Cdh1 (active en fin de mitose et en phase G11). Un des substrats importants de l’APCCdh1 est la protéine à boîte F Skp2. En effet, Skp2 forme avec le complexe SCF une ubiquitine ligase responsable de la dégradation de plusieurs régulateurs négatifs du cycle cellulaire, notamment le CKI p27Kip1 [
2,
3]. Skp2 est un proto-oncogène dont l’expression est inversement corrélée à celle du CKI p27Kip1
(Figure 1A). Ainsi, Skp2 agit comme un régulateur positif de la progression des cellules en phase S et M et sa dégradation par le complexe APCCdh1 prévient une entrée prématurée de la cellule en phase S [
4,
5].  | Figure 1.
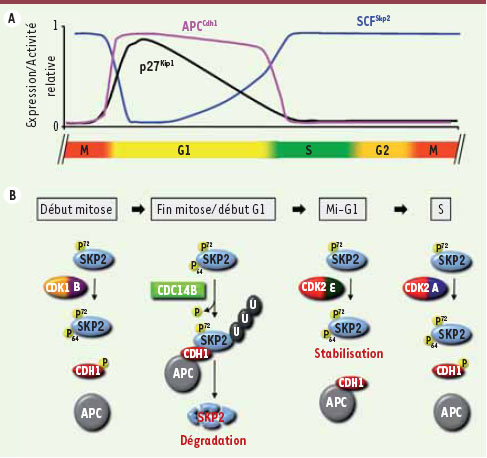
L’expression de Skp2 durant le cycle cellulaire dépend de sa phosphorylation sur les sérines 64 et 72. A. Régulation de l’activité des ubiquitine ligases APCCdh1 et SCFSkp2 durant le cycle cellulaire. Le profil d’expression du substrat majeur de Skp2, p27Kip1, est également représenté dans la figure. Les phases du cycle cellulaire sont indiquées en couleur dans la partie inférieure de la figure. B. Modèle de la régulation de l’expression de Skp2 par phosphorylation dans le cycle cellulaire. Lors de l’entrée en mitose, le niveau d’expression de Skp2 est maintenu élevé par la phosphorylation stabilisatrice de la Ser64 et la faible activité du complexe APCCdh1. À la sortie de la mitose, la déphosphorylation de la Ser64 par la phosphatase Cdc14B favorise l’interaction de Skp2 avec Cdh1, conduisant à son ubiquitinylation et à sa dégradation par le protéasome. Durant la phase G1, l’activation de la kinase Cdk2 entraîne la phosphorylation de la Ser64 de Skp2, ce qui diminue son affinité pour Cdh1 et cause son accumulation qui persiste jusqu’en mitose. La phosphorylation de la Ser72 joue aussi un rôle mineur dans la stabilisation de Skp2. |
|
Régulation de Skp2 par des phosphorylations réversibles Chez l’homme, l’expression de Skp2 est augmentée dans de nombreux cancers mais les mécanismes régulant l’expression et la dégradation de Skp2 dans ces cellules restent encore mal compris. Étant donné le rôle critique de la phosphorylation dans la régulation des activités de nombreux acteurs du cycle cellulaire, nous avons évalué la conséquence de cette modification sur l’activité de Skp2 chez l’homme [
6]. Nos résultats montrent que l’expression de Skp2 durant le cycle cellulaire est régulée par la phosphorylation de la sérine 64 et, dans une moindre mesure, de la sérine 72. La phosphorylation protège Skp2 contre sa dégradation par l’APCCdh1 en inhibant son association avec Cdh1. Les kinases du cycle cellulaire Cdk2 et Cdk1, en charge de la phosphorylation de la Ser64, favorisent la stabilisation et l’accumulation de Skp2. À l’opposé, nous avons montré que la phosphatase Cdc14B, que l’on trouve tant dans la levure que dans les cellules humaines, déphosphoryle activement la Ser64, entraînant une dégradation plus efficace de Skp2 par l’APCCdh1 lors de la transition mitose/G1. Ainsi, la déplétion de Cdc14B accélère la progression de la mitose jusqu’à la phase S de manière dépendante de Skp2, attestant l’existence d’une relation épistatique fonctionnelle entre Cdc14B et Skp2. Nos résultats obtenus dans des cellules en culture permettent d’établir le modèle suivant pour la régulation de l’expression de Skp2 à partir de la mitose jusqu’à la phase S (Figure 1B). Lorsque les cellules entrent en mitose, l’activité Cdk1 favorise des niveaux élevés de Skp2 par deux mécanismes : la phosphorylation stabilisatrice de la Ser64 de Skp2 et la phosphorylation inactivatrice de Cdh1 [
7]. À la sortie de la mitose, l’APCCdh1 est activée et la Ser64 de Skp2 est déphosphorylée par Cdc14B, favorisant l’interaction de Skp2 avec l’APCCdh1 et sa dégradation. Vers le milieu de la phase G1, l’entrée en jeu de la cycline E entraîne la phosphorylation de la Ser64 de Skp2, ce qui inhibe son interaction avec Cdh1. Ainsi, la stimulation de l’activité Cdk2 permet l’expression de Skp2 en phase G1, même en présence d’un complexe APCCdh1 actif. Au total, en phase S, la phosphorylation par Cdk2/cycline A et l’inactivation de l’APCCdh1 permettent la pleine expression de Skp2. Mentionnons enfin que la phosphorylation de la Ser72 joue également un rôle stabilisateur de Skp2, quoique mineur. |
La phosphatase Cdc14B : un nouveau gène suppresseur de tumeurs ? Il est également probable que Cdc14B influence le déroulement de la phase G1 à travers d’autres substrats que Skp2 (Figure 2A). Par exemple, Cdc14B pourrait participer à l’activation de l’APCCdh1 en fin de mitose et en G1, comme cela a été démontré chez la levure S. cerevisiae [7]. En accord avec cette idée, on a récemment observé que Cdc14B prend part à l’activation de Cdh1 en réponse au stress génotoxique [
8]. De plus, il est possible qu’en déphosphorylant activement p27, Cdc14B la stabilise et favorise l’établissement et/ou le maintien de la phase G1. De fait, nous avons observé de très faibles niveaux de p27 lors de la déplétion de Cdc14B [6]. Finalement, Cdc6 est une ATPase dont le rôle essentiel est de charger sur la chromatine l’hélicase MCM2/7 lors de la réplication de l’ADN [1,
9]. Comme Skp2, Cdc6 est un substrat de l’APCCdh1 stabilisé au milieu de la phase G1 après sa phosphorylation par Cdk2/cycline E [9]. En déphosphorylant et en déstabilisant Cdc6, Cdc14B freinerait l’entrée de la cellule en phase S.  | Figure 2.
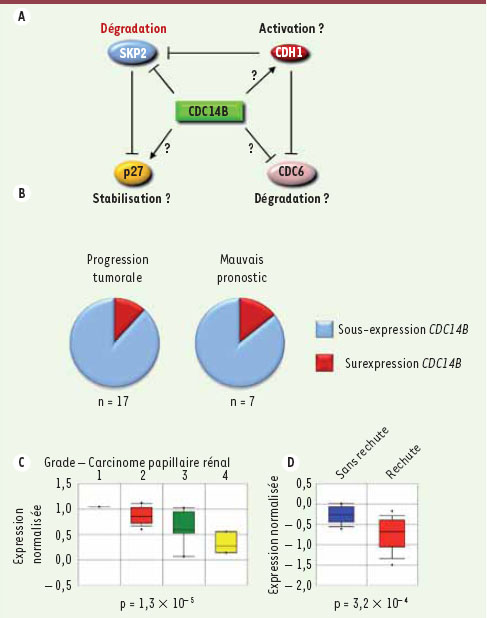
Cdc14B, un suppresseur de tumeur potentiel. A. En plus de Skp2, Cdc14B pourrait réguler la durée de la phase G1 et la progression du cycle cellulaire via d’autres effecteurs tels p27, Cdc6 ou Cdh1. B. L’expression du gène CDC14B dans les tumeurs humaines a été analysée à l’aide du site Oncomine (http://www.oncomine.org). Le nombre d’études montrant une sous ou une surexpression significative (p < 0,01) de CDC14B est indiqué sous les graphes. Le terme de progression tumorale correspond à un stade ou un grade plus avancé de la tumeur. C, D. Exemples d’études montrant une diminution de l’expression de CDC14B à des stades avancés de carcinomes papillaires rénaux (C) et chez les patients atteints de cancers de l’hypopharynx ayant fait une rechute 3 ans après ablation chirurgicale (D). La valeur de p est indiquée sous les graphes. |
Cdc14B pourrait avoir un effet significatif sur la prolifération cellulaire et la tumorigenèse en contrôlant de nombreux effecteurs du cycle cellulaire (Figure 2A). Pour tester cette idée, nous avons évalué l’expression du gène CDC14B dans les tumeurs humaines en interrogeant le site Web Oncomine2. Cette banque de données, riche de près de 400 études, permet d’évaluer l’expression différentielle d’un gène particulier en fonction de critères tels que la progression tumorale ou la valeur pronostique [
10]. Plus de 85 % des études où une différence d’expression génétique significative (p < 0,01) est mise en évidence révèlent une diminution d’expression du gène CDC14B (Figure 2B). Ainsi, X.J. Yang et al. [
11] ont montré que l’expression de CDC14B est inversement proportionnelle au grade des carcinomes papillaires rénaux (Figure 2C). A. Cromer et al. [
12] ont aussi observé une sous-expression de CDC14B chez les patients victimes d’une rechute trois années après l’ablation d’un cancer de l’hypopharynx (Figure 2D). Comme on peut le constater, les données des analyses transcriptomiques effectuées dans les tumeurs humaines suggèrent fortement que la protéine Cdc14B pourrait agir comme le produit d’un gène suppresseur de tumeurs. La sous-expression de Cdc14B dans les cellules tumorales entraînerait l’activation d’un axe du mal (activation de Skp2 et Cdc6/inactivation de p27 et Cdh1, Figure 2A) favorisant la progression tumorale. L’analyse du phénotype de souris porteuses d’une invalidation conditionnelle du gène Cdc14B fournira des informations précieuses à ce sujet. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Nakayama KI, Nakayama K. Ubiquitin ligases : cell-cycle control and cancer. Nat Rev Cancer 2006; 6 : 369–81. 2. Carrano AC, Eytan E, Hershko A, et al. SKP2 is required for ubiquitin-mediated degradation of the CDK inhibitor p27. Nat Cell Biol 1999; 1 : 193–9. 3. Bloom J, Pagano M. Deregulated degradation of the cdk inhibitor p27 and malignant transformation. Semin Cancer Biol 2003; 13 : 41–7. 4. Bashir T, Dorrello NV, Amador V, et al. Control of the SCF(Skp2-Cks1) ubiquitin ligase by the APC/C(Cdh1) ubiquitin ligase. Nature 2004; 428 : 190–3. 5. Wei W, Ayad NG, Wan Y, et al. Degradation of the SCF component Skp2 in cell-cycle phase G1 by the anaphase-promoting complex. Nature 2004;428 : 194–8. 6. Rodier G, Coulombe P, Tanguay PL, et al. Phosphorylation of Skp2 regulated by CDK2 and Cdc14B protects it from degradation by APC(Cdh1) in G1 phase. EMBO J 2008; 27 : 679–91. 7. Visintin R, Craig K, Hwang ES, et al. The phosphatase Cdc14 triggers mitotic exit by reversal of Cdk-dependent phosphorylation. Mol Cell 1998; 2 : 709–18. 8. Bassermann F, Frescas D, Guardavaccaro D, et al. The Cdc14B-Cdh1-Plk1 axis controls the G2 DNA-damage-response checkpoint. Cell 2008; 134 : 256–67. 9. Mailand N, Diffley JF. CDKs promote DNA replication origin licensing in human cells by protecting Cdc6 from APC/C-dependent proteolysis. Cell 2005;122 : 915–26. 10. Rhodes DR, Kalyana-Sundaram S, Mahavisno V, et al. Oncomine 3.0 : genes, pathways, and networks in a collection of 18,000 cancer gene expression profiles. Neoplasia 2007; 9 : 166–80. 11. Yang XJ, Tan MH, Kim HL, et al. A molecular classification of papillary renal cell carcinoma. Cancer Res 2005; 65 : 5628–37. 12. Cromer A, Carles A, Millon R, et al. Identification of genes associated with tumorigenesis and metastatic potential of hypopharyngeal cancer by microarray analysis. Oncogene 2004; 23 : 2484–98. |