| |
| Med Sci (Paris). 2009 August; 25(8-9): 719–726. Published online 2009 August 15. doi: 10.1051/medsci/2009258-9719.Vaccins pandémiques et prépandémiques dirigés contre le virus grippal H5N1 État des lieux en 2009 Pierre Loulergue* and Odile Launay* Université Paris Descartes, faculté de médecine INSERM CIC BT505 Assistance publique - Hôpitaux de Paris, CIC de vaccinologie Cochin Pasteur, pôle de médecine, groupe hospitalier Cochin-Saint Vincent de Paul, 27, rue du Faubourg Saint-Jacques, 75679 Paris Cedex 14, France |
Au cours du XXe siècle, trois grandes pandémies grippales ont causé la mort de plusieurs millions de personnes et entraîné des perturbations conséquentes du tissu social : celle de 1918-1919, dite « grippe espagnole », est responsable de plus de 20 millions de morts [
1] alors que celles de 1957 et 1968 ont entraîné chacune environ un million de décès [
2]. Ces pandémies sont secondaires à la diffusion, dans une population immunologiquement naïve, d’une souche virale modifiée par des cassures antigéniques secondaires à des réassortiments de segments viraux d’un virus de sous-type A humain avec ceux d’un virus animal le plus souvent d’origine aviaire ou porcine [
3–
6]. Le potentiel létal chez l’homme de ce virus recombiné est variable. Le virus de la grippe a été isolé en 1933 par inoculation au furet1, puis ensuite sur œuf embryonné en 1940, permettant la production de grandes quantités de virus puis des premiers vaccins. Parallèlement s’est mis en place un système de surveillance épidémiologique efficace potentialisé par une coopération internationale sous l’égide de l’OMS (WHO global influenza program surveillance network)
2. La prévention des épidémies grippales repose principalement sur la mise au point annuelle de vaccins efficaces suivant les recommandations périodiques de l’OMS qui se fondent sur la surveillance épidémiologique des souches circulantes. Néanmoins, l’apparition récente d’un virus grippal aviaire H5N1 [
7] ayant un réel potentiel pandémique a relancé le débat sur l’organisation des systèmes de santé pour faire face à une pandémie. Après l’émergence des premières infections chez l’homme en 1997 et 2003 [
8], le virus H5N1 réapparaît depuis 2004 d’abord au Vietnam [
9], puis en Indonésie [
10] et plus récemment en Égypte. Cette épidémie présente des caractéristiques originales : un taux de mortalité élevé, de l’ordre de 60 % (262 décès sur les 433 cas rapportés au 2 juin 20093) et le jeune âge de la population atteinte, 20 ans en moyenne [
11]. La mise au point de vaccins efficaces constitue l’élément fondamental de la stratégie mondiale de préparation à une pandémie grippale. Depuis fin avril 2009, un nouveau virus grippal de sous-type A/H1N1, recombinant de virus humain, aviaire et porcin, a émergé. Les premiers cas ont été observés au Mexique et aux États-Unis début avril 2009, et des infections ont ensuite été rapportées dans tous les continents en une dizaine de jours motivant le passage au niveau 5 (sur une échelle de 1 à 6) du plan pandémique de l’OMS. Á l’heure actuelle, le taux de mortalité est faible (25 288 cas et 139 décès au 8 juin 20094,) mais le potentiel pandémique de ce nouveau virus reste inconnu [6,
12]. |
Rappels : le virus grippal, la réponse immune et la vaccination La grippe Les virus de la grippe A, B et C sont des virus à ARN fragmentés dont l’enveloppe porte à sa surface deux glycoprotéines antigéniques, l’hémagglutinine (HA) et la neuraminidase (NA). HA, scindée en deux peptides (HA1 et HA2), fixe le virus sur ses récepteurs cellulaires et permet l’infection des cellules de l’épithélium respiratoire ; NA joue un rôle dans la libération des particules virales néo-synthétisées et leur dissémination dans l’épithélium respiratoire. Ces virus comportent de nombreux sous-types infectant l’homme et de nombreuses espèces animales. Seuls les virus de type A sont à l’origine de pandémies. La grippe A évolue sur un mode épidémique ; sa diffusion est rapide du fait d’une incubation courte (de 24 à 72 heures) [
13], d’une transmission par voie aérienne et d’une grande contagiosité. Ces épidémies sont responsables d’un excès de morbi-mortalité [
14] avec un pic hivernal annuel. Cette périodicité s’explique par la grande variabilité antigénique de l’hémagglutinine et de la neuraminidase qui évolue selon deux modalités : les glissements antigéniques (modifications mineures résultant de mutations ponctuelles) et les cassures antigéniques. Ce sont les cassures antigéniques qui sont responsables des pandémies car elles font émerger un virus antigéniquement différent des virus responsables des épidémies précédentes, souvent après réassortiment génétique de segments provenant de souches humaines et animales pour lequel la population est immunologiquement naïve. Certains de ces virus peuvent s’avérer hautement pathogènes pour l’homme, comme pour le virus aviaire H5N1. Pour le virus A/H1N1 émergeant actuellement, le niveau de virulence semble plus faible à ce jour mais l’épidémie ne fait que commencer. Les réponses immunitaires au virus grippal sont de deux types : humoral (au niveau systémique et muqueux) et cellulaire (réponse lymphocytaire T cytotoxique) ; elles ont un rôle majeur dans la protection et la guérison, respectivement [
15]. La vaccination antigrippale La vaccination constitue le principal outil de lutte contre la grippe. En 2009, les vaccins utilisent principalement des virus inactivés, tous préparés sur œufs de poule embryonnés. Le vaccin saisonnier est composé de trois souches : deux souches de sous-type A (H1N1 et H3N2, H pour hémagglutinine et N pour neuraminidase) et une souche de sous-type B ; la majorité des vaccins contiennent 15 µg d’hémagglutinine de chacune des 3 souches incluses dans la préparation vaccinale. Les souches utilisées sont adaptées chaque année en fonction de la veille épidémiologique et font l’objet de recommandations internationales pour chaque zone géographique. Il existe également un vaccin à virus atténué (LAIV pour live attenuated influenza vaccine), administré par voie nasale, commercialisé et recommandé aux États-Unis chez les sujets sains de 5 à 49 ans, à l’exception des sujets en contact avec des patients immunodéprimés et des femmes enceintes, avec une extension récente de l’utilisation chez l’enfant de 24 mois à 5 ans en l’absence d’antécédents d’asthme [
16]. Ce vaccin à virus atténué est en cours d’enregistrement en Europe. L’évaluation de l’immunogénicité des vaccins antigrippaux repose sur le dosage sérique des anticorps anti-hémagglutinine pour chacune des 3 souches incluses dans le vaccin. Pour être enregistrés, les vaccins doivent répondre aux critères d’immunogénicité émis par le Comité européen des médicaments à usage humain (CHMP) présentés dans le Tableau I.  | Tableau I.
Critères d’immunogénicité requis pour l’enregistrement d’un vaccin antigrippal. * Le taux de séroconversion correspond au pourcentage de personnes qui développent après vaccination un titre d’anticorps anti-hémagglutinine supérieur ou égal au 1/40e par rapport à un taux < 1/40e avant vaccination ou qui présentent une augmentation d’un facteur > 4 du titre d’anticorps anti-HA ; dans ce dernier cas, il se s’agit pas d’une séroconversion mais d’une augmentation significative du titre des anticorps. ** Pourcentage de sujets ayant développé des anticorps anti-HA à un titre > 1/40e. |
|
Vaccins H5N1 pré-pandémiques et pandémiques Dans le cadre de la menace pandémique aviaire, plusieurs vaccins contre le H5N1 ont été développés :
-
des vaccins pandémiques « prototypes » ; ils sont développés pour mettre au point la technologie et l’immunogénicité et permettront de préparer rapidement un vaccin pandémique en temps réel après l’identification de la souche pandémique ;
-
des vaccins pré-pandémiques ; ils permettent d’induire une immunogénicité croisée (c’est-à-dire qu’ils activent une réponse immunitaire efficace sur des virus grippaux antigéniquement peu différents) et peuvent être utilisés plus en amont dans le plan pandémique dans l’attente de la mise à disposition du vaccin pandémique.
Objectifs Un vaccin « idéal » contre le virus H5N1 devrait allier une tolérance acceptable avec une forte immunogénicité contre une souche homologue de la souche vaccinale (en sachant que la population humaine est immunologiquement naïve vis-à-vis de H5N1) et une immunogénicité croisée (humorale et cellulaire) contre des souches H5N1 hétérologues (antigéniquement différentes). Deux types de vaccins ont été à ce jour évalués chez l’homme : les vaccins sous-unités (subvirion) « classiques », avec ou sans adjuvant, et les vaccins à virus entier. Ces virus vaccinaux sont cultivés sur œufs de poule embryonnés, puis inactivés, purifiés et, s’il s’agit de vaccins sous-unités, fractionnés. Les vaccins à virus entier inactivés sont considérés comme plus immunogènes que les vaccins sous-unités [
17,
18]. Ces vaccins doivent satisfaire aux exigences émises par le CHMP pour le développement des vaccins prototypes et des vaccins pandémiques5. Caractérisation de la souche à inclure dans le vaccin pandémique Contrairement au vaccin contre la grippe saisonnière qui est composé de 3 souches (2 souches de sous-type A, une souche de sous-type B), un vaccin H5N1 pandémique ne comporte que la souche A/H5N1 mais pourrait être associé à d’autres sous-types. Il est indispensable de bien caractériser la souche qui sera utilisée dans la composition du vaccin. Jusqu’à présent les souches de virus H5N1 à l’origine de cas humains appartiennent à deux clades (ou groupes phylogénétiques) différents de virus H5N1 [
19] : (1) le clade 1 circule au Vietnam, en Thaïlande et au Cambodge et a été responsable dans ces pays des infections humaines à H5N1 survenues de 2004 à 2007 ; (2) le clade 2 (qui est composé de 3 sous-clades majeurs) est présent en Indonésie et en Chine mais également au Moyen-Orient (Turquie, Égypte, Azerbaïdjan et Irak) ; il a été responsable des cas humains identifiés depuis 2005 dans ces pays. Plus récemment, les virus du clade 2 ont été retrouvés chez des oiseaux en Afrique [
20]. De nouveaux sous-clades ne cessent d’émerger et même s’ils présentent une homologie de séquence relative avec les anciens, ils ne pourraient être que partiellement contrôlés par les vaccins actuellement enregistrés [
21]. Il est important que les vaccins en développement utilisent des souches issues des deux clades et que ces différents vaccins soient testés dans des essais cliniques afin d’optimiser les données d’immunogénicité ; il est en effet nécessaire de mesurer l’induction d’une protection croisée entre différents clades et sous-clades, et de pouvoir décider de nouvelles stratégies vaccinales, notamment de priming. Cette technique consiste à présenter successivement le même antigène avec des formulations différentes [
22]. Cela suppose aussi une coopération internationale pour l’identification et la surveillance des souches, qui ne va pas nécessairement de soi comme le montrent les problèmes diplomatiques entre le gouvernement indonésien et l’OMS [
23] ; mais cette coopération internationale semble être efficace depuis le début de l’épidémie du nouveau sous-type A H1/N1. Les souches utilisées pour les candidats vaccins sont choisies parmi les plus représentatives des souches de groupes génétiquement distincts et celles qui ont été identifiées comme étant à l’origine d’infections chez l’homme et l’animal. |
Problèmes techniques Les souches sauvages de virus H5N1 hautement pathogènes sont toxiques pour les embryons de poulet et nécessitent d’avoir recours à des techniques de génétique inverse ; la suppression d’un motif d’acides aminés de l’hémagglutinine permet d’atténuer la virulence des souches sans en réduire l’immunogénicité et permet de les cultiver [
24]. Ces souches doivent être manipulées à un niveau de confinement de laboratoire élevé (niveau P3). Par ailleurs, il n’existe actuellement aucune méthode standardisée pour l’analyse de l’immunogénicité de ces vaccins. La réponse immunitaire aux virus aviaires est mal connue chez l’homme. L’utilisation des critères validés pour le vaccin épidémique, pour lequel le corrélat de protection a pu être établi, est probablement imparfaite. En effet, le test de référence (inhibition de l’hémagglutination) utilise des hématies de poule ou de dinde mais les récepteurs de ces cellules aux virus aviaires sont différents des récepteurs humains ; les hématies de cheval semblent plus sensibles pour détecter la réponse aux virus H5N1 [18]. Le seuil du titre d’anticorps inhibant l’hémagglutinination n’est pas défini : le taux de 1/40e retenu pour les virus épidémiques peut-il être retenu ? La protection de 50 % des sujets est-elle suffisante ? D’autres marqueurs d’immunogénicité, en particulier les anticorps neutralisants, peuvent être intéressants, mais le titre nécessaire pour obtenir une protection n’est pas connu. Capacités de production et questions d’ordre socioéconomique Le second problème est lié aux limites de production industrielle des vaccins antigrippaux. La capacité actuelle de production mondiale de vaccin antigrippal est d’environ 350 millions de doses par an [
25], la disponibilité d’œufs de poule représentant la limite principale. Comme les virus de la grippe aviaire sont pathogènes pour les embryons, le risque de se trouver face à une capacité de production encore plus limitée existe en situation de pandémie grippale. Plusieurs alternatives sont envisageables pour améliorer le nombre de doses disponibles : (1) augmenter la production en modifiant les méthodes de préparation du vaccin (cultures cellulaires) ; (2) diminuer la quantité d’antigène nécessaire en augmentant l’immunogénicité des vaccins existants grâce à l’utilisation d’adjuvants ou de nouvelles voies d’administration, notamment la voie intradermique [
26,
27]. Dans le cadre de son plan d’action mondial, l’OMS a pour objectif d’accroître la production en transférant la technologie aux pays en développement (en particulier ceux qui sont touchés par le virus H5N1), ce qui leur permettrait de produire eux-mêmes leurs vaccins6. Les questions économiques qui se poseront, avec la notion de propriété intellectuelle et de licence, doivent être anticipées. |
Principaux résultats sur l’immunogénicité des vaccins H5N1 développés La recherche vaccinale concernant le virus H5N1 est très riche : 16 industriels du vaccin travaillent dans 10 pays à la fabrication d’un vaccin H5N1, plus de 40 essais cliniques ont été réalisés ou sont en cours, dont des essais chez les enfants et les personnes âgées. |
Technologies vaccinales utilisées Vaccins à virions fragmentés Ce sont des vaccins à virus purifiés et inactivés, constitués de particules obtenues après dissociation du virus par un détergent. Ils contiennent les antigènes de surface (neuraminidase et hémagglutinine) et les antigènes internes du virus grippal (nucléoprotéines, protéines de matrice). Ils ont une bonne immunogénicité et sont globalement bien tolérés. Vaccins à antigènes de surface Ils contiennent neuraminidase et hémagglutinine séparées des autres antigènes et purifiées. Ce sont des vaccins à virus inactivés et leur tolérance est bonne. Vaccins à virions entiers Le virus grippal est obtenu par culture sur œufs de poule embryonnés ou sur des cellules ; il est concentré par ultrafiltration puis purifié par centrifugation zonale ou chromatographie. Il est inactivé avant ou après purification. Ces vaccins induisent une bonne réponse immunitaire mais ils sont moins bien tolérés, en raison de la présence d’une enveloppe lipidique à leur surface [
28]. |
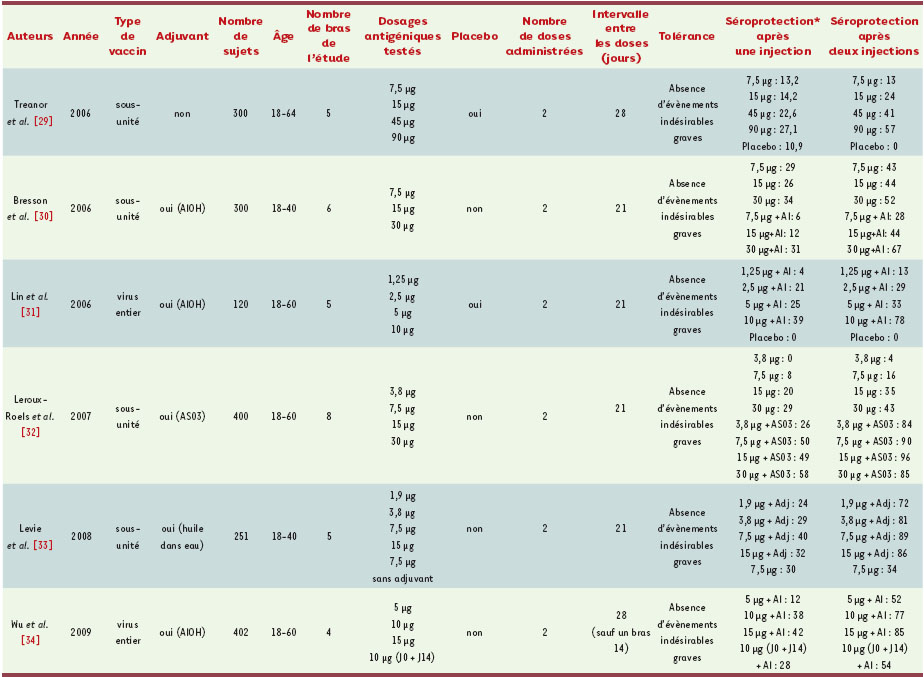
Dès l’apparition des premiers cas humains de grippe à H5N1, plusieurs essais cliniques ont été réalisés et ont conduit au développement de vaccins pandémiques prototypes ou pré-pandémiques. Le Tableau II reprend les résultats de ces principaux essais.  | Tableau II.
Principaux résultats des essais publiés. * % de patients ayant un titre d’Ac > 1/32, inhibition de l’hémagglutination ; AlOH : sels d’aluminium. |
Les deux premiers essais ont évalué la tolérance et l’immunogénicité d’un vaccin fragmenté développé par Sanofi-Pasteur, administré sans ou avec aluminium comme adjuvant de l’immunité [
29,
30]. Ces essais ont montré une immunogénicité faible de ce candidat vaccin nécessitant l’administration de doses élevées, et deux injections ; l’aluminium comme adjuvant n’a pas d’intérêt. Les vaccins développés par GlaxoSmithKline, virions fragmentés évalués avec et sans un adjuvant lipidique (AS03), ont une bonne immunogénicité lorsqu’ils sont administrés avec l’adjuvant permettant une épargne antigénique considérable. Deux administrations d’une quantité de 3,8 μg d’hémagglutinine sont suffisantes pour atteindre les critères d’immunogénicité exigés. L’adjuvant permet également d’élargir la réponse immunitaire à des souches hétérologues [
32]. La réponse croisée contre des souches du clade 2 a été évaluée : pour la souche A/Indonesia/5/05 (clade 2.1) [32], deux injections du vaccin associées à l’adjuvant induisent une séroprotection contre cette souche dans 20 à 32 % des cas. Il n’y a pas de réaction croisée dans les groupes vaccinés sans adjuvant. Les réponses croisées pour les souches A/Turkey/Turkey/1/2005 et A/Anhui/1/2005 représentatives respectivement des clades 2.2 et 2.3 ont été testées avec le même vaccin avec adjuvant à la dose de 3,8 μg. Les taux de séroconversion sont respectivement de 85 % et 75 % [
35]. L’utilisation d’un vaccin à virus entier associé à l’aluminium pourrait permettre de réduire considérablement les doses [
34]. |
Principaux vaccins H5N1 disponibles en 2009 Vaccins à virions fragmentés
-
Prepandrix® : cultivé sur œufs, avec l’adjuvant AS03, développé par GSK. A obtenu son AMM le 14 mai 2008 comme vaccin prépandémique.
-
Pandemrix® : cultivé sur œufs, avec l’adjuvant AS03, développé par GSK. A obtenu son AMM le 20 mai 2008 comme vaccin pandémique.
-
Emerflu® : cultivé sur œufs, avec ou sans adjuvant (sels d’aluminium) et développé par Sanofi-Pasteur. Le CHMP a rendu en mars 2009 un avis défavorable à la commercialisation de ce vaccin pandémique, en raison d’une immunogénicité trop faible chez les sujets de plus de 60 ans.
Vaccins à antigènes de surface
-
Focetria® : cultivé sur œufs, avec adjuvant (MF59), développé par Novartis. A obtenu son AMM le 2 mai 2007 comme vaccin pandémique.
-
Aflunov® : cultivé sur œufs, avec adjuvant (MF59), développé par Novartis. En cours de développement en vue d’un enregistrement comme vaccin pré-pandémique.
Vaccins à virions entiers
-
Daronrix® : cultivé sur œufs, avec adjuvant de sels d’aluminium, développé par GSK. A obtenu son AMM le 21 mars 2007 comme vaccin pandémique.
-
Celvapan® : cultivé sur cellules Vero, sans adjuvant, développé par Baxter. Ce vaccin a reçu début 2009 un avis favorable du CHMP en tant que vaccin pandémique.
|
Un vaccin vivant atténué dont l’avantage est d’induire une immunité systémique et muqueuse, comme cela a été montré avec le vaccin épidémique, est en cours de développement. Des résultats chez l’animal se sont révélés concluants [
36] et des essais chez l’homme devraient suivre. Mais il existe un risque potentiel de recombinaison avec un virus grippal humain, ce qui impose des mesures de confinement strict pour les essais ; ce vaccin ne sera utilisable qu’en cas de pandémie déclarée. D’autres technologies vaccinales sont évaluées pour le développement de vaccins antigrippaux. Un vaccin ADN codant pour l’hémagglutinine, la neuraminidase et des protéines conservées (nucléoprotéines et protéines de matrice) a montré des résultats préliminaires encourageants [
37]. Enfin, l’utilisation d’un autre virus aviaire non pathogène pour l’homme (comme H5N3) pourrait constituer une alternative intéressante par l’induction d’une immunogénicité croisée [
38]. Une des problématiques majeures pour le développement d’un vaccin grippal saisonnier ou pandémique est liée à la mutation du virus et à l’apparition constante de nouveaux sous-types. Le vaccin idéal serait un vaccin antigrippal « universel » dont l’efficacité s’exercerait contre différents sous-types de virus en période épidémique ou endémique. La mise au point de ce type de vaccin nécessite d’identifier une protéine virale conservée - ou la partie stable d’une protéine instable - nécessaire à la réplication virale. La protéine M2 (protéine d’enveloppe hautement conservée entre les différents sous-types A) semble être un bon candidat chez l’animal car elle induit une immunité croisée qui limite la sévérité de l’infection [
39]. Néanmoins, il n’existe pas de données chez l’homme et des mutations de cette protéine sont possibles [
40]. |
Utilisation des vaccins H5N1 pré-pandémiques et pandémiques Perspectives Dans son avis du 5 septembre 2008, le Haut Conseil de santé publique recommande dès maintenant « l’utilisation du vaccin prépandémique pour les personnels des laboratoires ayant l’autorisation de l’AFSSAPS de manipuler les virus A (H5N1), les professionnels de la filière avicole et les membres de leur famille résidant sur l’exploitation en cas de foyers non maîtrisés d’influenza aviaire, ainsi que les personnes se rendant dans des zones d’épizootie et à risque du fait de leur profession au contact des oiseaux et de leurs déjections, échantillons biologiques potentiellement contaminés ». Un stock de vaccin prépandémique est également constitué par les autorités de santé afin de vacciner les professionnels de santé et de secours en cas de passage à la phase 4 7. Il n’est pas recommandé de vacciner la population générale ou les voyageurs se rendant pour voyage d’agrément dans les pays touchés par l’épizootie. En cas de pandémie, on considère que les premiers vaccins seront disponibles entre 3 et 6 mois après le début, temps nécessaire pour identifier la souche, préparer le vaccin et assurer une production de masse. Les projections ont montré qu’après 3 mois, le taux d’attaque cumulé serait autour de 30 % de la population, c’est-à-dire proche de la situation où l’on n’aurait pas de vaccin [
41]. D’où la justification de production d’un vaccin prépandémique dès la phase 4 du plan pour commencer à induire une réponse immunitaire qui sera boostée par le vaccin ou la souche pandémique. Concernant le virus émergent H1N1, la nécessité de disposer rapidement d’un vaccin préventif est tout aussi fondamentale. La diffusion de cette épidémie a été très rapide et son évolution est à ce jour inconnue. Après l’isolement et la caractérisation de la souche en cause, la mise au point d’un vaccin adapté est en cours. Il a été décidé de produire un vaccin monovalent H1N1 avec le virus identifié et les premiers lots de vaccins devraient être disponibles en août. Les premiers éléments disponibles montrent que la souche H1N1 du vaccin saisonnier n’offre pas de protection croisée sur ce nouveau virus. |
Le risque d’une pandémie grippale avec un virus aviaire reste important en 2009. Les conséquences en termes de morbidité, mortalité et plus généralement désordre social, sont potentiellement majeures compte tenu de sa virulence. Il est probable que la souche pandémique aviaire émergente sera génétiquement proche du virus H5N1. Dans ce contexte, une coopération internationale s’est mise en place pour prévenir le danger pandémique. La recherche d’un vaccin efficace se heurte à plusieurs problématiques d’ordres différents (scientifiques, politiques, économiques), mais l’investissement des scientifiques, des industriels et des gouvernements est important avec pour résultat l’identification de candidats vaccins. Les contraintes temporelles de production et de distribution de vaccin en cas de pandémie obligent à encore plus de performance dans la recherche de nouveaux vaccins et de stratégies de vaccination. Une coopération internationale large et organisée reste indispensable pour réussir à faire face au risque pandémique. D’ores et déjà, de très grands progrès ont été réalisés avec la mise au point de nouveaux vaccins plus immunogènes et permettant même d’induire une immunogénicité croisée. Le vaccin tient plus que jamais un rôle central dans le plan pandémique. L’épidémie grippale « mexicaine » A/H1N1 actuelle a prouvé l’efficacité de la coopération étroite et rapide entre l’OMS et le CDC (Center for disease control), aboutissant à la caractérisation du nouveau virus en moins de 2 semaines ; il est nécessaire maintenant que les différents acteurs, institutionnels et industriels, collaborent étroitement au niveau mondial pour décider et mettre en place les actions nécessaires à la prise en charge de l’émergence de nouveaux virus grippaux. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Smith W. The structural and functional plasticity of influenza virus. Lancet 1951; 1 : 885–91. 2. Nguyen-Van-Tam JS, Hampson AW. The epidemiology and clinical impact of pandemic influenza. Vaccine 2003; 21 : 1762–8. 3. Bean WJ, Schell M, Katz J, et al. Evolution of the H3 influenza virus hemagglutinin from human and nonhuman hosts. J Virol 1992; 66 : 1129–38. 4. Treanor J, Kawaoka Y, Miller R, Webster RG, Murphy B. Nucleotide sequence of the avian influenza A/Mallard/NY/6750/78 virus polymerase genes. Virus Res 1989; 14 : 257–69. 5. Kawaoka Y, Krauss S, Webster RG. Avian-to-human transmission of the PB1 gene of influenza A viruses in the 1957 and 1968 pandemics. J Virol 1989; 63 : 4603–8. 6. Shinde V, Bridges CB, Uyeki TM, et al. Triple-reassortant swine influenza A (H1) in humans in the United States, 2005-2009. N Engl J Med 2009 (online). 7. Peiris JS, de Jong MD, Guan Y. Avian influenza virus (H5N1): a threat to human health. Clin Microbiol Rev 2007; 20 : 243–67. 8. Tam JS. Influenza A (H5N1) in Hong Kong: an overview. Vaccine 2002; 20 (suppl 2) : S77–81. 9. Tran TH, Nguyen TL, Nguyen TD, et al. Avian influenza A (H5N1) in 10 patients in Vietnam. N Engl J Med 2004; 350 : 1179–88. 10. Kandun IN, Wibisono H, Sedyaningsih ER, et al. Three Indonesian clusters of H5N1 virus infection in 2005. N Engl J Med 2006; 355 : 2186–94. 11. Smallman-Raynor M, Cliff AD. Avian influenza A (H5N1) age distribution in humans. Emerg Infect Dis 2007; 13 : 510–2. 12. Novel swine-origin influenza A (H1N1) virus investigation team. Emergence of a novel swine-origin influenza A (H1N1) Virus in Humans. N Engl J Med 2009 (online). 13. Treanor JJ. Influenza virus. In : Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas and Bennett’s. Principles and practice of infectious diseases, 6th ed. Philadelphia : Elsevier Churchill Livingstone,2005 : 2060–78. 14. Glezen WP. Serious morbidity and mortality associated with influenza epidemics. Epidemiol Rev 1982; 4 : 25–44. 15. Poland GA, Ovsyannikova IG, Jacobson RM. Immunogenetics of seasonal influenza vaccine response. Vaccine 2008 (suppl 4) : D35–40. 16. Fiore AE, Shay DK, Haber P, et al. Prevention and control of influenza. Recommendations of the advisory committee on immunization practices (ACIP), 2007. MMWR Recomm Rep 2007;56 (RR-6) : 1–54. 17. Hehme N, Engelmann H, Kuenzel W, et al. Immunogenicity of a monovalent, aluminum-adjuvanted influenza whole virus vaccine for pandemic use. Virus Res 2004; 103 : 163–71. 18. Stephenson I, Wood JM, Nicholson KG, et al. Detection of anti-H5 responses in human sera by HI using horse erythrocytes following MF59-adjuvanted influenza A/Duck/Singapore/97 vaccine. Virus Res 2004; 103 : 91–5. 19. Evolution of H5N1 avian influenza viruses in Asia. Emerg Infect Dis 2005; 11 : 1515–21. 20. Al-Azemi A, Bahl J, Al-Zenki S, et al. Avian influenza A virus (H5N1) outbreaks, Kuwait, 2007. Emerg Infect Dis 2008; 14 : 958–61. 21. Smith GJ, Fan XH, Wang J, et al. Emergence and predominance of an H5N1 influenza variant in China. Proc Natl Acad Sci USA 2006; 103 : 16936–41. 22. Woodland DL. Jump-starting the immune system: prime-boosting comes of age. Trends Immunol 2004; 25 : 98–104. 23. Fedson DS, Dunnill P. From scarcity to abundance: pandemic vaccines and other agents for have not countries. J Public Health Policy 2007; 28 : 322–40. 24. Leroux-Roels I, Leourx-Roels G. Current status and progress of prepandemic and pandemic influenza vaccine developement. Expert Rev Vaccines 2009; 8 : 401–23. 25. Kiey MP, Subbarao K. The pandemic influenza vaccine challenge. Vaccine 2008; 26S (suppl 4) : D3-D4. 26. Kenney RT, Frech SA, Muenz LR, et al. Dose sparing with intradermal injection of influenza vaccine. N Engl J Med 2004; 351 : 2295–301. 27. Belshe RB, Newman FK, Cannon J, et al. Serum antibody responses after intradermal vaccination against influenza. N Engl J Med 2004 25 ; 351 : 2286–94. 28. Jefferson TO, Rivetti D, Di Pietrantoni C, et al. Vaccines for preventing influenza in healthy adults. Cochrane Database Syst Rev 2007; 2 : CD001269. 29. Treanor JJ, Campbell JD, Zangwill KM, et al. Safety and immunogenicity of an inactivated subvirion influenza A (H5N1) vaccine. N Engl J Med 2006; 354 : 1343–51. 30. Bresson JL, Perronne C, Launay O, et al. Safety and immunogenicity of an inactivated split-virion influenza A/Vietnam/1194/2004 (H5N1) vaccine: phase I randomised trial. Lancet 2006; 367 : 1657–64. 31. Lin J, Zhang J, Dong X, et al. Safety and immunogenicity of an inactivated adjuvanted whole-virion influenza A (H5N1) vaccine: a phase I randomised controlled trial. Lancet 2006; 368 : 991–7. 32. Leroux-Roels I, Borkowski A, Vanwolleghem T, et al. Antigen sparing and cross-reactive immunity with an adjuvanted rH5N1 prototype pandemic influenza vaccine: a randomised controlled trial. Lancet 2007; 370 : 580–9. 33. Levie K, Leroux-Roels I, Hoppenbrouwers K, et al. An adjuvanted, low-dose, pandemic influenza A (H5N1) vaccine candidate is safe, immunogenic, and induces cross-reactive immune responses in healthy adults. J Infect Dis 2008 : 642–9. 34. Wu J, Fang HH, Chen JT, et al. Immunogenicity, safety, and cross-reactivity of an inactivated, adjuvanted, prototype pandemic influenza (H5N1) vaccine: a phase II, double-blind, randomized trial. Clin Infect Dis 2009; 8 : 1087–95. 35. Leroux-Roels I, Benrhard R, Gerard P, et al. Broad clade 2 cross-reactive immunity induced by an adjuvanted clade 1 rH5N1 pandemic influenza vaccine. PLoS One 2008; 3 : e1665. 36. Suguitan AL Jr, McAuliffe J, Mills KL, et al. Live, attenuated influenza A H5N1 candidate vaccines provide broad cross-protection in mice and ferrets. PLoS Med 2006; 3 : e360. 37. Laddy DJ, Yan J, Corbitt N, et al. Immunogenicity of novel consensus-based DNA vaccines against avian influenza. Vaccine 2007; 25 : 2984–9. 38. Stephenson I, Bugarini R, Nicholson KG, et al. Cross-reactivity to highly pathogenic avian influenza H5N1 viruses after vaccination with nonadjuvanted and MF59-adjuvanted influenza A/Duck/Singapore/97 (H5N3) vaccine: a potential priming strategy. J Infect Dis 2005; 191 : 1210–5. 39. Mozdzanowska K, Zharikova D, Cudic M, et al. Roles of adjuvant and route of vaccination in antibody response and protection engendered by a synthetic matrix protein 2-based influenza A virus vaccine in the mouse. Virol J 2007; 4 : 118. 40. Zharikova D, Mozdzanowska K, Feng J, et al. Influenza type A virus escape mutants emerge in vivo in the presence of antibodies to the ectodomain of matrix protein 2. J Virol 2005; 79 : 6644–54. 41. Ferguson NM, Cummings DA, Fraser C, et al. Strategies for mitigating an influenza pandemic. Nature 2006; 442 : 448–52. |