| |
| Med Sci (Paris). 2010 January; 26(1): 12–14. Published online 2010 January 15. doi: 10.1051/medsci/201026112.Existe-t-il dans la peau une nouvelle population lymphocytaire Th22 distincte des lymphocytes Th17 ? Hans Yssel1 and Armand Bensussan2* 1Inserm U844, CHU Saint-Éloi, 80, avenue Augustin Fliche, 34091 Montpellier, France 2Inserm U976, Hopital Saint-Louis, équerre Bazin, 1, avenue Claude Vellefaux, 75475 Paris, France MeSH keywords: Chimiokine CCL27, physiologie, Chimiokines CC, Chimiotaxie, Cellules épithéliales, immunologie, Humains, Inflammation, Interleukine-17, biosynthèse, sécrétion, Interleukines, Kératinocytes |
Les lymphocytes T constituent des populations distinctes de cellules mononucléées qui jouent un rôle important dans la réponse immunitaire conduisant à une protection efficace et adaptée contre différents pathogènes. Néanmoins, cette réactivité du système immunitaire n’est pas sans risque puisque, dans certains cas, elle peut aboutir à l’émergence de dysfonctionnements et de pathologies. La fonction effectrice lymphocytaire T s’exerce via la production de cytokines, des protéines de faible poids moléculaire dont l’activité est pléiotrope et souvent redondante, et qui ont pour cibles une grande variété de cellules et de tissus [
1]. Par ailleurs, les populations lymphocytaires T se définissent aussi par l’expression à la membrane de protéines transmembranaires, comme les sélectines, les intégrines ou les récepteurs de chimiokines qui leur conférent la possibilité de migrer vers les tissus. Actuellement, on décrit au moins trois populations lymphocytaires T CD4+ auxiliaires (helper) effectrices : les lymphocytes Th1, les Th2 et les Th17, que distinguent leur profil cytokinique, l’expression de facteurs de transcription caractéristiques de leur différenciation fonctionnelle et le type de récepteurs aux chimiokines exprimés à leur surface [
2]. En particulier, la population cellulaire Th17 a été définie comme une lignée indépendante sécrétant les interleukines (IL) IL-17A, IL-17F, IL-22, IL-26, ainsi que le TNF-α (tumor necrosis factor), exprimant le facteur de transcription ROR-γt (retinoic acid-related orphan receptor gamma t), un récepteur nucléaire orphelin, et ayant de façon spécifique à sa membrane le récepteur de chimiokine CCR6 [
3,
13]. De façon intéressante, des résultats issus de modèles murins ou obtenus à partir d’études cliniques humaines ont montré que l’expansion in situ de la population Th17 serait associée à la pathogénie des maladies inflammatoires et auto-immunes comme le psoriasis, la polyarthrite rhumatoïde, la sclérose en plaques et les maladies inflammatoires chroniques de l’intestin [
4]. |
Identification d’une sous-population nouvelle de lymphocytes T auxiliaires Alors que la production d’IL-22 était jusqu’à présent considérée comme étant la caractéristique des lymphocytes Th17, deux études récentes publiées dans la revue Nature Immunology [
5,
6] révèlent l’existence d’une population distincte qui se définit comme produisant principalement de l’IL-22 et pas ou très peu d’IL-17. L’IL-22 est un membre de la famille des cytokines de type IL-10 qui joue un rôle clef dans la régulation des réponses inflammatoires. L’IL-22 agit sur des cellules non hématopoïétiques comme les cellules épithéliales de l’appareil digestif ou pulmonaire ou bien les kératinocytes de l’épiderme où elle est impliquée dans l’induction d’une réponse immunitaire de type inné et dans l’homéostasie de l’épithélium [
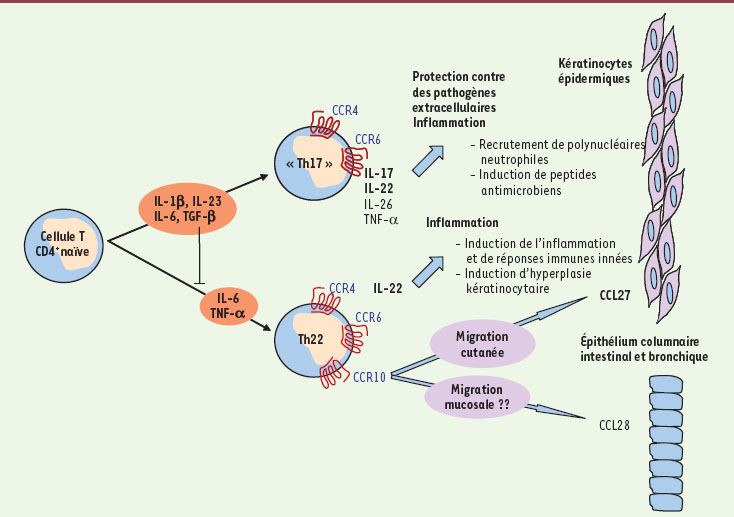
7]. Les résultats publiés par ces deux équipes indépendantes montrent que cette nouvelle population de lymphocytes T CD4+ auxiliaires coexprime les récepteurs de chimiokines CCR6, CCR4 et CCR10 et produit de fortes quantités d’IL-22, mais ni IL-17 ni IFN-γ (interféron γ). Sachant qu’il a été précédemment établi que la spécificité fonctionnelle et phénotypique des Th17 repose sur la sécrétion concomitante d’IL-17 et d’IL-22 et sur l’expression du récepteur CCR6 [3], ces nouveaux résultats indiquent que si nouvelle population il y a, elle est le fait d’une production d’IL-22 uniquement et d’une expression restreinte de CCR10 (Figure 1).
 | Figure 1.
Différenciation et fonction des cellules productrices d’IL-22. Les cellules productrices d’IL-22 (Th22) se distinguent des cellules Th17 classiques, productrices à la fois d’IL-17 et d’IL-22, par l’expression du récepteur de chimiokines CCR10. La production de la chimiokine CCL27, un des ligands de CCR10, par des kératinocytes, favorise la migration de cellules Th22 vers la peau. Toutefois, la présence du CCL28, l’autre ligand de CCR10, dans le tissu épithélial de l’intestin, du poumon et des glandes salivaires, favoriserait la domiciliation de ces cellules dans ces tissus. Le rôle inflammatoire de l’IL-22 n’est proposé pour l’instant que dans la peau, mais son action dans d’autres tissus ne doit pas être écartée. |
|
Un tropisme cutané… discutable Les deux études insistent sur le tropisme cutané de ces lymphocytes T qui expriment les récepteurs CCR6, CCR4 et CCR10. En effet, les veinules de la peau et les kératinocytes sécrètent la chimiokine CCL27 qui est aussi connue sous le nom de cutaneous T-cell-attracting chemokine (CTACK) et qui est le ligand de CCR10, ce qui entraînerait le recrutement préférentiel au niveau des lésions cutanées de ces cellules productrices d’IL-22 [
8]. Néanmoins, il est bon de préciser que CCR10 a un autre ligand qui est la chimiokine CCL28, aussi connue sous le nom de mucosae-associated epithelial chemokine (MEC), qui est exprimée par l’épithélium columnaire de l’intestin, du poumon, du sein et des glandes salivaires permettant ainsi d’attirer des lymphocytes T et B qui expriment le récepteur pour cette chimiokine [
9]. Il est donc possible, contrairement aux affirmations des auteurs de ces deux articles, que cette nouvelle population lymphocytaire productrice d’IL-22 puisse aussi être présente dans des tissus autres que cutanés. La question du tropisme tissulaire des lymphocytes T producteurs d’IL-22 est d’une grande importance si l’on tient compte des résultats contradictoires concernant les effets bénéfiques ou délétères de cette cytokine dans l’inflammation tissulaire. En particulier, il a été montré que l’inflammation cutanée induite par l’IL-23 dans un modèle murin du psoriasis était significativement diminuée chez les souris homozygotes pour la délétion du gène codant l’IL-22 [
10]. En accord avec ces observations, une augmentation significative des transcrits IL-22 a été mise en évidence dans les lésions cutanées psoriasiques, ainsi qu’une augmentation d’IL-22 sérique chez des patients atteints d’un psoriasis actif [
11], suggérant un rôle délétère de cette cytokine dans cette maladie. Néanmoins, des résultats contradictoires obtenus dans des modèles murins de colite ulcérative indiquent un effet bénéfique protecteur de l’IL-22 qui est produite par des T CD4+ et une sous-population de lymphocytes natural killer (NK) [
12]. Enfin, comme le suggèrent les publications de Trifari et al. [5] ainsi que celles de Duhen et al. [6], il est essentiel, dans un proche avenir, de déterminer de façon précise le rôle dans les pathologies inflammatoires des différentes populations de lymphocytes T qui expriment les récepteurs CCR4, CCR6 et/ou CCR10, surtout si nous souhaitons utiliser ces récepteurs comme cible thérapeutique pour empêcher la migration tissulaire et ainsi réduire l’inflammation. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol 1989; 7 : 145–73. 2. Sallusto F, Lenig D, Mackay CR, Lanzavecchia A. Flexible programs of chemokine receptor expression on human polarized T helper 1 and 2 lymphocytes. J Exp Med 1998; 187 ; 875–83. 3. Acosta-Rodriguez EV, Rivino L, Geginat J, et al. Surface phenotype and antigenic specificity of human interleukin 17-producing T helper memory cells. Nat Immunol 2007; 8 : 639–46. 4. Weaver CT, Hatton RD, Mangan PR, Harrington LE. IL-17 family cytokines and the expanding diversity of effector T cell lineages. Annu Rev Immunol 2007; 25 : 821–52. 5. Trifari S, Kaplan CD, Tran EH, et al. Identification of a human helper T cell population that has abundant production of interleukin 22 and is distinct from TH-17, TH1 and TH2 cells. Nat Immunol 2009; 10 : 864–71. 6. Duhen T, Geiger R, Jarrossay D, Lanzavecchia A, Sallusto F. Production of interleukin 22 but not interleukin 17 by a subset of human skin-homing memory T cells. Nat Immunol 2009; 10 : 857–63. 7. Wolk K, Sabat R. Interleukin-22: a novel T- and NK-cell derived cytokine that regulates the biology of tissue cells. Cytokine Growth Factor Rev 2006; 17 : 367–80. 8. Homey B, Alenius H, Müller A, et al. CCL27-CCR10 interactions regulate T cell-mediated skin inflammation. Nat Med 2002; 8 : 157–65. 9. Wilson E, Butcher EC. CCL28 controls immunoglobulin (Ig)A plasma cell accumulation in the lactating mammary gland and IgA antibody transfer to the neonate. J Exp Med 2004; 200 : 805–9. 10. Zheng Y, Danilenko DM, Valdez P, et al. Interleukin-22, a T(H)17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis. Nature 2007; 445 : 648–51. 11. Boniface K, Guignouard E, Pedretti N, et al. A role for T cell-derived interleukin 22 in psoriatic skin inflammation. Clin
Exp Immunol 2007; 150 : 407–15. 12. Sugimoto K, Ogawa A, Mizoguchi E, et al. IL-22 ameliorates intestinal inflammation in a mouse model of ulcerative colitis. J Clin Invest 2008; 118 : 534–44. 13. Leung-Theung-Long S, Guerder S. Th17 cells, a novel pro-inflammatory effector CD4 T cell population. Med Sci (Paris) 2008; 24 : 972–6. |