| |
| Med Sci (Paris). 2010 January; 26(1): 28–30. Published online 2010 January 15. doi: 10.1051/medsci/201026128.Les antibiotiques induisent la capture de gènes de résistance par les bactéries Emilie Guerin,1 Guillaume Cambray,2 Sandra Da Re,1 Didier Mazel,2 and Marie-Cecile Ploy3* 1Université de Limoges, EA3175, Inserm, Équipe Avenir Inserm, faculté de médecine, Limoges, France 2Institut Pasteur, unité Plasticité du génome bactérien, Paris, 28, rue du Docteur Roux, 75015 Paris, France 3Université de Limoges, EA3175, Équipe Avenir Inserm, Limoges, France MeSH keywords: Bactéries, effets des médicaments et des substances chimiques, génétique, Protéines bactériennes, physiologie, Multirésistance bactérienne aux médicaments, Régulation de l'expression des gènes bactériens, Integrases, Intégrons, Régions promotrices (génétique), Recombinaison génétique, Réponse SOS (génétique), Serine endopeptidases |
Les bactéries multirésistantes (BMR) aux antibiotiques ont été découvertes dans les années 1950 avec la mise en évidence des plasmides, vecteurs génétiques hébergeant plusieurs gènes de résistance aux antibiotiques et pouvant diffuser entre bactéries. Pendant de nombreuses années, la découverte régulière de nouvelles molécules antibiotiques a permis de contrôler ce phénomène. Nous connaissons aujourd’hui une période plus critique avec l’augmentation de la résistance des bactéries à de nombreux antibiotiques, avec parfois de véritables « monstres » résistants à toutes les molécules disponibles, conduisant les cliniciens dans de véritables impasses thérapeutiques [
1]. Ce phénomène de multirésistance est donc désormais un véritable enjeu de santé publique. Pour lutter contre ce fléau, les mesures d’hygiène et des règles de bon usage d’utilisation des antibiotiques sont nécessaires pour limiter la sélection de ces BMR et leur dissémination. Cependant, compte tenu du faible nombre de molécules antibiotiques innovantes pour les prochaines années, une autre voie de recherche s’est ouverte dont l’objectif est de mieux comprendre les mécanismes d’acquisition des résistances aux antibiotiques dans le but de les prévenir. La multirésistance bactérienne est majoritairement associée à l’acquisition d’ADN étranger via des supports génétiques mobiles : les plasmides, les transposons et les intégrons. |
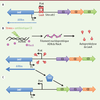
Les intégrons : support de résistance aux antibiotiques Les intégrons sont des systèmes génétiques de capture et d’expression de régions codantes exogènes généralement sans promoteur connues sous le nom de « cassettes ». Décrits pour la première fois vers la fin des années 1980, ils sont composés de trois éléments fonctionnels essentiels : un gène (intI) codant une intégrase responsable de l’acquisition des cassettes par recombinaison spécifique de site, un site de recombinaison (attI) et un promoteur Pc (Figure 1A). L’intégrase est capable de catalyser l’intégration ou l’excision d’une cassette. L’intégration se fait généralement au site attI, en aval du promoteur Pc, permettant ainsi l’expression du gène nouvellement inséré [
2].
 | Figure 1.
Schéma d’un intégron et de la régulation exercée par LexA. A. schéma de la plate-forme fonctionnelle d’un intégron, la protéine LexA chevauche le promoteur de l’intégrase (Pint). B. Lors d’un stress conduisant à la formation d’ADNsb, par exemple par un antibiotique dont la résistance est codée par la 3e cassette, le filament nucléoprotéique ADNsb/RecA conduit à l’autoprotéolyse de LexA et donc à l’activation de la réponse SOS. Le promoteur de l’intégrase est alors libéré. C. L’intégrase alors produite effectue un réarrangement des cassettes, ramenant la 3e cassette en première position, pour permettre à la bactérie de résister au stress antibiotique qu’elle subit. |
On distingue deux types d’intégrons : les intégrons de multirésistance (MRI) généralement portés par des plasmides ou des transposons, et les intégrons chromosomiques, appelés aussi super-intégrons (SI) car ils contiennent un grand nombre de cassettes (entre 20 et 200 cassettes aux fonctions pour la plupart inconnues) [
3]. Les MRI contiennent un nombre limité de cassettes (jusqu’à 8 cassettes) qui codent pour des résistances vis-à-vis de la plupart des antibiotiques connus (plus de 130 cassettes identifiées à ce jour) [
4]. Les MRI sont trouvés majoritairement chez des bactéries à Gram négatif. Cinq classes de MRI ont été identifiées selon la séquence de l’intégrase, la classe 1 étant la plus fréquente. |
Régulation de l’acquisition des cassettes de résistance De nombreuses études ont montré que les MRI jouaient un rôle prépondérant dans la dissémination et l’acquisition des résistances aux antibiotiques par les bactéries à Gram négatif chez l’homme comme chez l’animal, ou dans l’environnement. De plus, un lien entre multirésistance et intégrons a été établi, identifiant les intégrons comme un marqueur pertinent de multirésistance. Cependant, les mécanismes de régulation de recombinaison et d’acquisition des cassettes étaient encore inconnus jusqu’à très récemment. En effet, si le mécanisme de la recombinaison catalysée par l’intégrase IntI1 des MRI de classe 1 commence à être bien caractérisé [
5], la régulation de l’expression des intégrases d’intégrons est, en revanche, peu documentée. Malgré les formidables possibilités d’échanges de cassettes, certaines observations suggéraient que les rangées de cassettes étaient assez stables. En effet, des intégrons ayant un arrangement de cassettes identique ont été décrits dans des espèces bactériennes très différentes. De même, certaines cassettes codent des résistances à des antibiotiques qui ne sont, dans la pratique, plus utilisés en médecine humaine, tels que la streptomycine et la spectinomycine. Cette stabilité pourrait avoir plusieurs causes et, parmi celles-ci, il est probable que la faible activité de l’intégrase et/ou sa faible expression jouent un rôle majeur. Une des hypothèses est qu’il pourrait exister des stimulus capables d’induire l’expression de l’intégrase et donc l’acquisition de cassettes. Nous avons effectué une analyse détaillée des régions promotrices du gène intI de différents MRI et SI, ce qui nous a permis d’identifier une région conservée identifiée comme un site de fixation de la protéine LexA impliquée dans la réponse SOS des bactéries lors d’un stress [
6]. |
Induction de l’acquisition de résistance via la réponse SOS La protéine LexA est le répresseur transcriptionnel de la réponse SOS bactérienne qui est impliquée dans la réparation des dommages que l’ADN subit lors de différents stress. LexA réprime les gènes du régulon SOS en se fixant sur un site spécifique dans la région promotrice de ces gènes. Lors d’un stress, différentes voies vont conduire à la formation d’ADN simple brin qui sera reconnu par la protéine RecA (qui procure un filament protéique) pour former un filament nucléoprotéique qui sera recruté par LexA. La formation de ce complexe LexA/filament nucléoprotéique va activer la capacité autoprotéolytique de LexA (Figure 1B), entraînant son clivage et la libération de ses sites de fixation, permettant ainsi l’expression des gènes du régulon SOS [
7]. La réponse SOS est impliquée dans l’activation et la dissémination de facteurs de virulence et il a été établi que certains antibiotiques étaient capables de l’activer, directement ou indirectement [
8]. La présence d’un site de fixation potentiel de LexA chevauchant l’élément -10 du promoteur du gène intI (Figure 1A), conservé à la fois dans les SI et les MRI, suggère donc fortement une régulation de l’expression des intégrases d’intégrons par la réponse SOS via LexA. Nous avons vérifié la fonctionnalité des sites de fixation de LexA dans les MRI de classe 1 et dans le SI de Vibrio cholerae, dans un premier temps in vitro, puis dans un deuxième temps, nous avons analysé l’expression de l’intégrase des deux types d’intégrons in vivo chez la bactérie en culture planctonique [6]. Nous avons ainsi pu montrer que l’expression de l’intégrase était spécifiquement et aussi directement induite en réponse à des agents chimiques connus pour induire la réponse SOS comme la mitomycine C ou encore certains antibiotiques (ciprofloxacine, triméthoprime et ampicilline). Enfin, nous avons aussi vérifié que l’induction de la synthèse de l’intégrase corrélait bien avec une augmentation de l’activité recombinase de cette protéine in vivo. |
Mouvements de cassettes et prescription antibiotique Aujourd’hui nous savons donc que le système MRI est régulé. L’acquisition de nouvelles cassettes de résistance ou le réarrangement de ces cassettes au sein d’un intégron ne pourra se produire qu’en conditions d’activation de la réponse SOS et donc de production d’intégrase. La régulation négative de l’expression de l’intégrase d’intégrons offre plusieurs avantages à la bactérie. D’une part, une économie énergétique - l’intégrase n’étant produite que lorsqu’elle est nécessaire à la bactérie pour s’adapter au stress - et d’autre part, une stabilité du nombre de cassettes présentes dans l’intégron et de leur arrangement. Ce système permet ainsi à la bactérie de garder plusieurs gènes de résistance aux antibiotiques pour la plupart de façon silencieuse. En effet, plus une cassette est éloignée du promoteur Pc moins elle sera exprimée. Les modèles actuels sur la résistance aux antibiotiques considèrent que les mécanismes de résistance ont un coût énergétique pour la bactérie et que en l’absence d’exposition antibiotique, la résistance serait perdue. Or dans le système MRI, un gène de résistance peut être présent sans s’exprimer s’il est éloigné de Pc et la bactérie apparaîtra alors sensible. Dans des conditions de stress, l’activation de l’intégrase permettra le réarrangement interne des cassettes au sein de l’intégron pour rapprocher un gène silencieux du promoteur Pc permettant ainsi un niveau d’expression supérieur (Figure 1C). Nos résultats montrent que non seulement il existe une régulation de l’expression de l’intégrase par la réponse SOS et que celle-ci peut être induite par certains antibiotiques, mais aussi que le taux d’intégrase alors produit pourrait entraîner des mouvements de cassettes pouvant potentiellement conduire la bactérie à s’adapter au stress auquel elle fait face. Ainsi, lors de la prescription d’antibiotiques, l’antibiotique induit lui-même, en agissant sur l’expression de l’intégrase via la réponse SOS, l’acquisition ou l’expression de la résistance. |
Conclusion et perspectives La réponse SOS est un formidable outil d’adaptabilité pour la bactérie. Si son rôle dans l’activation et la dissémination de facteurs de virulence était déjà connu, nous savons maintenant que cette réponse SOS régule aussi l’expression de l’intégrase des intégrons et peut donc modifier la capacité de résistance des bactéries. Ce rôle ne se limite pas à ces exemples car des résultats récents ont aussi démontré l’implication de la réponse SOS dans la résistance aux quinolones via le gène qnrB2, avec induction de son expression par les quinolones elles-mêmes [
9]. Ces découvertes font de la protéine LexA un candidat de choix pour le développement de molécules permettant de lutter contre la résistance. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Zahar JR, Lanternier F, Lortholary O, et al. Les Entérobactéries sécrétrices de b-lactamase à spectre élargi (EBLSE) sont désormais aussi communautaires. Med Sci (Paris) 2009; 25 : 939–44. 2. Mazel D. Integrons: agents of bacterial evolution. Nat Rev Microbiol 2006; 4 : 608–20. 3. Rowe-Magnus DA, Guerout AM, Ploncard P, et al. The evolutionary history of chromosomal super-integrons provides an ancestry for multiresistant integrons. Proc Natl Acad Sci USA 2001; 98 : 652–7. 4. Partridge SR, Tsafnat G, Coiera E, Iredell JR. Gene cassettes and cassette arrays in mobile resistance integrons. FEMS Microbiol Rev 2009; 33 : 757–84. 5. Bouvier M, Demarre G, Mazel D. Integron cassette insertion: a recombination process involving a folded single strand substrate. EMBO J 2005; 24 : 4356–67. 6. Guerin E, Cambray G, Sanchez-Alberola N, et al. The SOS response controls integron recombination. Science 2009; 324 : 1034. 7. Erill I, Campoy S, Barbe J. Aeons of distress: an evolutionary perspective on the bacterial SOS response. FEMS Microbiol Rev 2007; 31 : 637–56. 8. Kelley WL. Lex marks the spot: the virulent side of SOS and a closer look at the LexA regulon. Mol Microbiol 2006; 62 : 1228–38. 9. Da Re S, Garnier F, Guerin E, et al. The SOS response promotes qnrB quinolone-resistance determinant expression. EMBO Rep 2009; 10 : 929–33. |