| |
| Med Sci (Paris). 2010 January; 26(1): 65–72. Published online 2010 January 15. doi: 10.1051/medsci/201026165.Fonctionnement des récepteurs-canaux du glutamate Des proteines responsables de la transmission synaptique excitatrice Marc Gielen* Laboratoire de neurobiologie, École normale supérieure, CNRS, 46, rue d’Ulm, 75005 Paris, France |
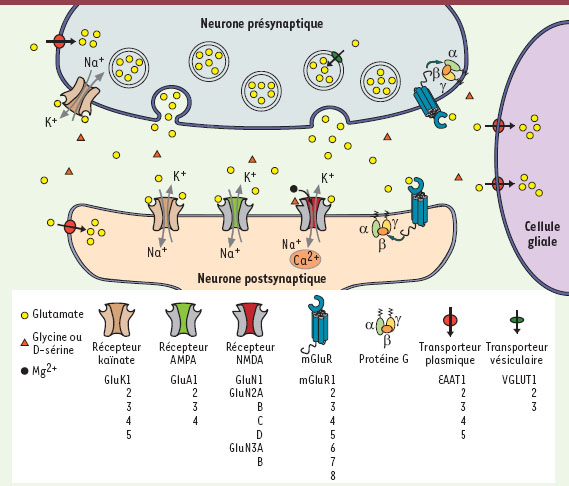
Dans le cerveau des vertébrés, le glutamate est le principal neurotransmetteur excitateur. Ainsi, à la majorité des synapses excitatrices, le glutamate diffuse dans la fente synaptique après sa libération vésiculaire par le neurone présynaptique (Figure 1). Deux grandes classes de récepteurs sont alors activées : les récepteurs métabotropiques du glutamate (mGluR), couplés à des protéines G, et les récepteurs-canaux du glutamate (ou encore récepteurs ionotropiques du glutamate, iGluR), contenant un canal ionique perméable aux cations (Na+ et K+, mais aussi, dans certains cas, Ca2+, un messager intracellulaire majeur ; voir ci-dessous) (Figure 1). L’activation des iGluR est donc à l’origine d’un flux ionique à travers la membrane plasmique du neurone post-synaptique qui provoque sa dépolarisation et peut ainsi permettre l’initiation de potentiels d’action.
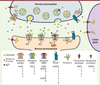 | Figure 1.
La synapse glutamatergique.
|
Les mGluR ne peuvent répondre qu’à des expositions prolongées au glutamate, par exemple lors de libérations répétées de glutamate dues à des trains de potentiels d’action [
1]. Dans ce cas, l’activation des mGluR est responsable de modulations lentes des réponses synaptiques, notamment via une régulation de canaux potassiques et calciques, mais aussi des iGluR [
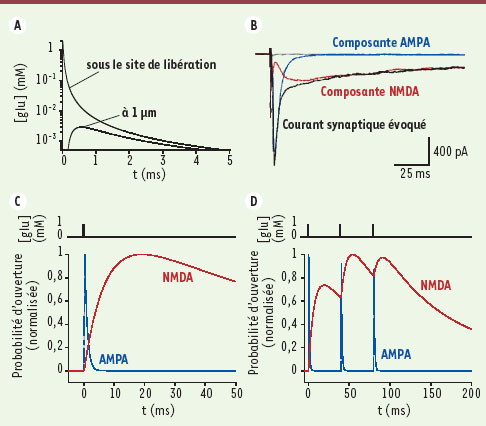
2]. Les iGluR sont, quant à eux, responsables de la transmission synaptique excitatrice rapide. En effet, leurs cinétiques d’activation sont assez élevées pour répondre à une libération brève de glutamate à la synapse, par exemple lors d’une fusion vésiculaire unique. Dans ce cas, les 5 000 molécules de glutamate contenues dans une vésicule donnent lieu, en à peine 1 µs, à un pic de concentration d’environ 1 mM sous le site de libération. Toutefois, cette concentration n’est atteinte que très transitoirement. En effet, le glutamate diffuse rapidement hors de la fente synaptique, avec un temps caractéristique d’environ 1 ms [1,
3] (Figure 2A).
 | Figure 2.
Propriétés cinétiques des récepteurs AMPA et NMDA. A. Modèle de diffusion du glutamate à la synapse. Réalisé selon le modèle de diffusion 3D développé dans [ 3]. Sous le site de libération, le glutamate atteint presque instantanément une concentration de l’ordre de ~ 1 mM, alors qu’à une distance de 1 µm (c’est-à-dire la taille caractéristique d’une synapse), un événement de libération ne produit qu’une concentration maximale de l’ordre de ~ 1 µM après 0,5 ms. B. Moyenne des courants post-synaptiques excitateurs (EPSC) enregistrés sur un neurone hippocampal de rat en condition contrôle (trace noire), en présence de 50 µM de D-AP5 (inhibiteur sélectif des récepteurs NMDA) pour révéler la composante AMPA (trace bleue), en présence de 5 µM de CNQX (qui inhibe les récepteurs AMPA) pour révéler la composante NMDA (trace rouge), et en présence de D-AP5 et CNQX pour bloquer totalement l’EPSC (trace grise). Courants mesurés à - 60 mV, en absence de Mg 2+ afin d’abolir le blocage dépendant du potentiel des récepteurs NMDA. Adapté, avec la permission de l’auteur, de [
41]. C, D. Modélisation des réponses portées par les récepteurs NMDA (trace rouge) et AMPA (trace bleue), réalisée selon les modèles développés dans [ 1]. C. Modélisation des réponses suite à un pulse unique de glutamate (concentration de 1 mM présente durant 0,3 ms). D. Modélisation des réponses suite à un train de pulses de glutamate (trois pulses séparés de 40 ms, c’est-à-dire une fréquence de stimulation de 25 Hz). |
Trois classes d’iGluR ont été définies en fonction de leurs propriétés pharmacologiques : les récepteurs AMPA, kaïnate et NMDA1. Les récepteurs AMPA et NMDA semblent être les principaux récepteurs post-synaptiques. Les récepteurs kaïnate seraient plus souvent localisés de manière pré- ou extra-synaptique, et joueraient un rôle de modulateurs de la transmission synaptique assez similaire à celui des mGluR [
4]. Enfin, le glutamate extracellulaire est maintenu à des concentrations nanomolaires par des transporteurs plasmiques (les transporteurs d’acides aminés excitateurs, EAAT, distincts des transporteurs accumulant le glutamate dans les vésicules d’exocytose, les transporteurs VGLUT) [
5,
6] (Figure 1). Ceci permet d’éviter une activation tonique des récepteurs NMDA qui provoquerait une neurotoxicité élevée due à une entrée continue de Ca2+ [
7,
8]. |
Propriétés biophysiques des différents iGluR Si tous les iGluR peuvent être activés par des applications brèves de glutamate, ils présentent néanmoins des propriétés cinétiques distinctes. Ainsi, à une synapse excitatrice typique, deux composantes principales peuvent être mises en évidence dans le courant post-synaptique excitateur : une composante rapide et une composante lente, portées respectivement par les récepteurs AMPA et NMDA (Figure 2B). On retrouve ces cinétiques pour des récepteurs recombinants produits en système d’expression hétérologue : les propriétés cinétiques de la transmission excitatrice rapide à la synapse glutamatergique sont donc le reflet des propriétés intrinsèques des iGluR. Les récepteurs AMPA s’activent et s’inactivent avec des temps caractéristiques inférieurs à la milliseconde (Figure 2C). Ces propriétés leur permettent d’effectuer un codage rapide de l’information (fréquence supérieure à 100 Hz), c’est-à-dire de suivre des trains de potentiels d’action [1] (Figure 2D) qui donnent lieu à des libérations de glutamate séparées par des temps de l’ordre de 10 ms. A contrario, les récepteurs NMDA présentent des cinétiques bien plus lentes (Figure 2C-D). Cette lenteur reflète un temps de résidence élevé du glutamate sur les récepteurs NMDA et leur permet de jouer le rôle de détecteur de coïncidence entre excitation des éléments pré- et post-synaptiques. En effet, après libération vésiculaire, le glutamate peut se lier au récepteur NMDA, mais le blocage de ce dernier par le Mg2+ empêche tout flux ionique au potentiel électrique de repos des neurones qui est négatif [
9] (Figure 1). Cette inhibition dépend du potentiel : lorsque le potentiel membranaire devient positif, le Mg2+ se dissocie du canal. De cette manière, si le neurone post-synaptique est excité via d’autres afférences glutamatergiques, la dépolarisation résultante peut lever transitoirement le blocage par le Mg2+. Dans le cas où ceci intervient alors que le glutamate est encore lié aux récepteurs NMDA, les ions perméants peuvent alors transiter au travers de leur canal ionique. La forte perméabilité calcique des récepteurs NMDA provoque alors un influx de Ca2+ permettant l’initiation de diverses formes de plasticité essentielles aux phénomènes d’apprentissage et de mémoire [
10]. Dans un tel schéma, une dissociation lente du glutamate est nécessaire. Traduction directe de cette lenteur, les récepteurs NMDA sont très affins pour le glutamate (EC50 ~ 1 µM), près de cent fois plus que les récepteurs AMPA (EC50 ~ 100 µM) [1]. |
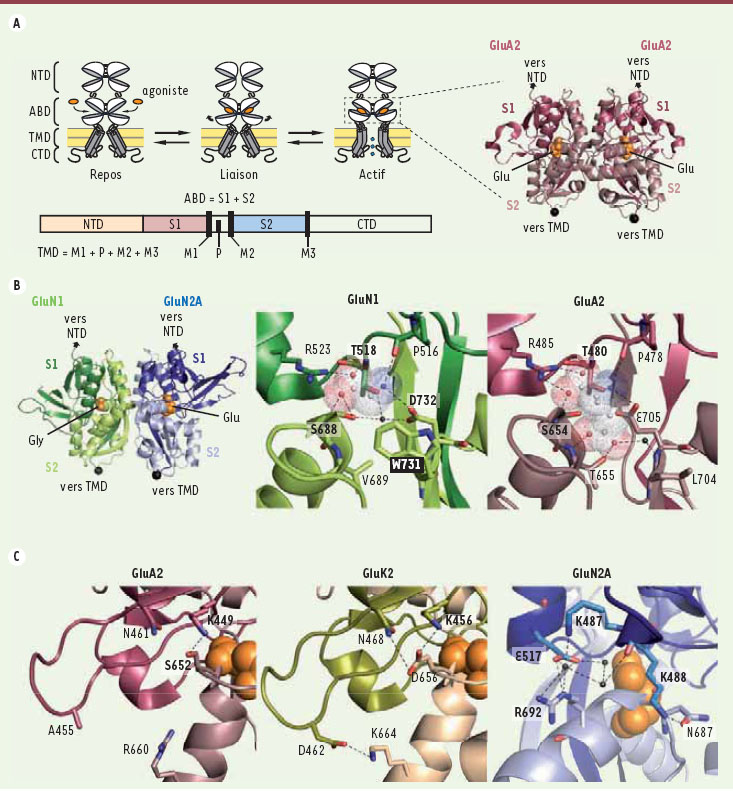
Composition moléculaire et architecture modulaire des iGluR L’hétérogénéité fonctionnelle au sein des iGluR est accompagnée d’une hétérogénéité moléculaire : les récepteurs AMPA sont codés par quatre gènes (GluA1-4 ; anciennement dénommés GluR1-4), les récepteurs kaïnate par cinq gènes (GluK1-5 ; anciennement GluR5-7 et KA1-2) et les récepteurs NMDA par sept gènes (GluN1, GluN2A-D, GluN3A et GluN3B ; anciennement NR1, NR2A-D, NR3A et NR3B) [
11]. Chaque iGluR est un tétramère, les quatre sous-unités qui le composent étant arrangées autour d’un unique pore central, le canal ionique. Alors que les récepteurs AMPA et kaïnate peuvent être des homo- ou des hétéromères dont chaque sous-unité lie une molécule de glutamate, les récepteurs NMDA sont des hétéromères composés obligatoirement de deux sous-unités GluN1 (liant la glycine ou la D-sérine) et de deux autres sous-unités, généralement GluN2 (liant le glutamate) [
12]. En effet, les récepteurs NMDA possèdent la propriété unique de devoir lier non seulement le glutamate mais aussi un coagoniste, la glycine (ou la D-sérine), pour être activés. Ainsi, des variations de la concentration locale de coagonistes peuvent moduler les réponses NMDA. Par exemple, l’activité des récepteurs NMDA peut être régulée par les astrocytes qui peuvent synthétiser et libérer de la D-sérine [
13]. Toutes les sous-unités iGluR adoptent une même architecture modulaire (Figure 3A). L’extrémité carboxy-terminale (CTD), intracellulaire, est impliquée dans le trafic et l’ancrage des récepteurs à la synapse [
14]. La partie transmembranaire (TMD), qui forme le canal ionique, présente une homologie de séquence avec certains canaux potassiques [
15,
16]. L’hypothèse d’une parenté structurale entre iGluR et canaux potassiques a d’ailleurs été grandement renforcée par la découverte de GluR0, canal potassique bactérien activé par le glutamate [
17]. Enfin, la région extracellulaire est formée par un tandem de deux larges domaines bilobés qui présentent des homologies avec une superfamille de protéines périplasmiques bactériennes. Le domaine de liaison des agonistes (ABD), homologue à la glutamine binding protein (GlnBP), est directement connecté à la partie transmembranaire. Le domaine amino-terminal (NTD), homologue à la leucine/isoleucine/valine binding protein (LIVBP), intervient notamment dans l’oligomérisation des iGluR [
18].
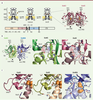 | Figure 3.
L’activation des récepteurs-canaux du glutamate. A. À gauche : organisation modulaire des sous-unités de iGluR et mécanisme d’activation. NTD : domaine amino-terminal ; ABD : domaine de liaison de l’agoniste ; TMD : domaine transmembranaire ; CTD : domaine carboxy-terminal. La partie transmembranaire sépare la séquence de l’ABD en deux segments (S1 et S2). À droite : structure cristallographique (code PDB 1FTJ) du dimère d’ABD de GluA2 en présence de glutamate (Glu). B. À gauche : structure cristallographique (code PDB 2A5T) de l’hétérodimère d’ABD GluN1/GluN2A en présence de glycine (Gly) et glutamate (Glu). Au milieu et à droite : comparaison du site glycine de GluN1 et du site glutamate de GluA2. L’importance du tryptophane 731 de GluN1, qui constitue une gêne stérique empêchant la liaison du glutamate, est ici soulignée. C. Interactions interlobes dans les ABD de diverses sous-unités de iGluR. De gauche à droite : GluA2 (récepteur AMPA ; code PDB 1FTJ [
19]), GluK2 (récepteur kaïnate ; code PDB 1S50 [
22]) et GluN2A (récepteur NMDA ; code PDB 2A5T [
24]). Les résidus impliqués dans les interactions entre lobes supérieurs et inférieurs sont situés dans les segments S1 (couleur foncée) et S2 (couleur claire), respectivement. |
|
Modèle d’activation des iGluR et dimérisation des sous-unités Bien que les iGluR soient des tétramères, des études cristallographiques récentes, réalisées sur des domaines ABD isolés, ont conduit à proposer un modèle selon lequel les iGluR fonctionnent en dimères de dimères [19]. Selon ce modèle, les ABD de deux sous-unités adjacentes dimérisent via une apposition dos-à-dos de leurs lobes supérieurs. La liaison des agonistes dans la crevasse interlobe de chaque ABD en provoque la fermeture, et ce mouvement écarte les lobes inférieurs des deux ABD adjacents. Cette séparation se traduit en tension au niveau des segments transmembranaires (directement reliés aux lobes inférieurs des ABD), ce qui conduit à l’ouverture du canal ionique (Figure 3A). En cohérence avec ce modèle, les antagonistes compétitifs des iGluR se lient au même site que le glutamate, mais ils empêchent la fermeture des ABD (et donc l’ouverture du canal ionique) au lieu de la favoriser [19]. Il est intéressant de souligner que l’activation des mGluR, dont les domaines de liaison des agonistes forment des dimères, implique des mécanismes semblables [
20]. Toutefois, de nombreuses questions restent en suspens : l’utilisation de la cristallographie sur ABD isolés ne permet pas de comprendre en détails comment s’effectue le couplage entre ces domaines et le canal ionique. De plus, ce modèle d’activation des iGluR élude les éventuelles interactions entre les deux dimères d’ABD incorporés au sein d’un récepteur entier (qui est un tétramère). |
Déterminants structuraux de la sélectivité et de l’affinité pour les agonistes La description moléculaire des poches de liaison des agonistes, situées dans la crevasse interlobes de chaque ABD, a permis de disséquer les éléments structuraux responsables de la liaison du glutamate. L’étude approfondie de la sous-unité AMPA GluA2 indique que de nombreuses liaisons hydrogènes et ioniques sont formées entre le glutamate et des résidus des lobes inférieurs et supérieurs [19] (Figure 3B). L’arginine 485, très conservée au sein des iGluR, sert notamment de point d’ancrage aux agonistes via une liaison ionique avec leur groupement α-carboxylate. L’impossibilité pour le glutamate de se fixer à la sous-unité GluN1 a été comprise grâce à la structure cristallographique de l’ABD de cette sous-unité (la glycine et la D-sérine sont les agonistes de la sous-unité GluN1) : la leucine 704 de GluA2 est remplacée par le tryptophane 731 dans GluN1. La chaîne latérale de ce résidu aromatique induit une gêne stérique importante et empêche la fixation du glutamate. A contrario, la liaison de la glycine, qui est le plus petit des acides aminés, n’est aucunement gênée [
21] (Figure 3B). Les récepteurs AMPA montrent une affinité pour le glutamate nettement plus faible que celle des récepteurs NMDA, les récepteurs kaïnate ayant une affinité intermédiaire [1]. Les poches de liaison du glutamate des sous-unités GluA2, GluK2 et GluN2A sont pourtant très similaires. Comment expliquer alors ces différences d’affinité ? Elles semblent résulter d’interactions directes entre lobes supérieur et inférieur, en « bord de mâchoire », des ABD. En effet, les régions qui bordent la crevasse interlobes des ABD sont peu conservées d’une famille de iGluR à l’autre. Dans le cas des récepteurs kaïnate de type GluK2, un réseau de liaisons ioniques et hydrogènes entre résidus des deux lobes stabilise la conformation fermée de l’ABD dans laquelle le glutamate se trouve retenu, et tend donc à empêcher sa dissociation [22] (Figure 3C). L’absence de ces interactions dans le cas des récepteurs AMPA GluA2 facilite la dissociation du glutamate, ce qui pourrait expliquer leur moins bonne affinité pour ce dernier (Figure 3C). En accord avec cette hypothèse, l’introduction dans GluA2 des résidus de GluK2 (afin de recréer ces interactions interlobes) permet d’obtenir des récepteurs AMPA mutants qui ont une haute affinité pour le glutamate (EC50 ~ 5 µM) [
23]. Inversement, perturber ces interactions interlobes dans GluK2, en mutant les résidus impliqués, diminue fortement l’affinité glutamate (EC50 > 200 µM) [23]. Des interactions interlobes pourraient également expliquer la haute affinité des récepteurs NMDA pour le glutamate [24] (Figure 3C). Néanmoins, l’importance de ces interactions doit encore être vérifiée. |
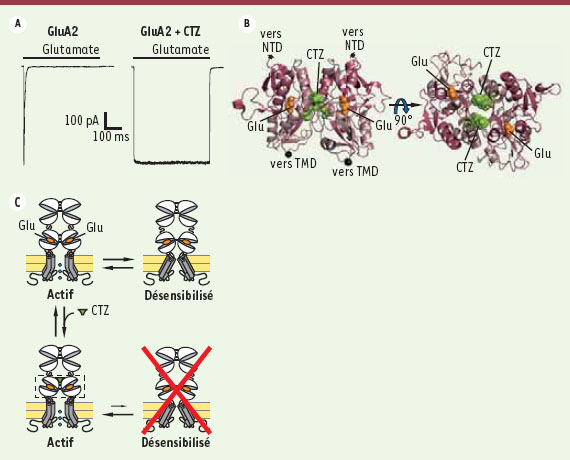
Désensibilisation des récepteurs AMPA et kaïnate Les données cristallographiques obtenues sur ABD isolés ont donc permis d’établir un modèle pour l’activation des iGluR. Cependant, une description figée de l’état actif des iGluR ne saurait rendre compte de toutes leurs propriétés en présence de glutamate, du fait de leur dynamique propre. Par exemple, en cas d’application prolongée de glutamate, les récepteurs AMPA et kaïnate subissent une désensibilisation profonde (c’est-à-dire qu’ils perdent leur activité malgré la liaison du glutamate) en une dizaine de millisecondes [
25,
26]. Cette désensibilisation peut être vue comme un moyen d’éviter une suractivation des récepteurs dans des conditions pathologiques, comme lors d’ischémies cérébrales, durant lesquelles la concentration de glutamate extracellulaire augmente fortement [
27,
28]. La désensibilisation des récepteurs AMPA peut être bloquée grâce à des outils pharmacologiques comme le cyclothiazide (CTZ) [25] (Figure 4A). Des données cristallographiques, établies sur ABD isolés, montrent que le CTZ se lie à l’interface de dimérisation entre deux ABD adjacents, et agit comme une « colle moléculaire » stabilisant cette interface (Figure 4B). Ces observations ont conduit à proposer que la désensibilisation implique la rupture de l’interface de dimérisation des ABD. Ce mécanisme permet un découplage entre la fermeture des ABD et l’ouverture du canal ionique. Ainsi, ce dernier peut se fermer alors que le glutamate reste lié à chaque ABD individuel (Figure 4C). Ce modèle a été confirmé à plusieurs reprises, à la fois pour les récepteurs AMPA et kaïnate [25, 26].
 | Figure 4.
La désensibilisation des récepteurs AMPA. A. Lors d’une application prolongée de glutamate (concentration de 3 mM), les récepteurs AMPA (ici, GluA2) désensibilisent profondément sur une échelle de temps de l’ordre de la dizaine de millisecondes (à gauche). Le cyclothiazide (CTZ) bloque la désensibilisation des récepteurs AMPA (à droite). Adapté, avec la permission de l’auteur, de [ 25]. B. Structure cristallographique (code PDB 1LBC) [ 25] du dimère d’ABD de GluA2 en présence de glutamate et de CTZ. C. Modèle de désensibilisation des récepteurs AMPA. L’entrée dans l’état désensibilisé est due à la rupture de l’interface de dimérisation des ABD. Dans ce modèle, le CTZ, qui stabilise le dimère d’ABD, empêche la désensibilisation. |
|
Modulation allostérique des récepteurs NMDA par des ligands du domaine N-terminal des sous-unités GluN2 Qu’en est-il des récepteurs NMDA ? S’ils peuvent s’inactiver lentement suite à l’entrée de calcium par leur canal [
29], ils ne présentent pas de désensibilisation rapide semblable à celle des récepteurs AMPA. Une des particularités des récepteurs NMDA réside dans la régulation de leur activité par de nombreux modulateurs extracellulaires allostériques (c’est-à-dire agissant sur un site autre que le site de liaison des agonistes). Par exemple, le zinc inhibe les récepteurs GluN1/GluN2A avec une haute affinité (IC50 ~ 10 nM). Cette modulation revêt probablement une importance physiologique car du zinc est coaccumulé avec le glutamate dans les vésicules d’exocytose de certaines terminaisons glutamatergiques, et pourrait donc être libéré à la synapse pour inhiber les réponses NMDA [
30]. Le site de liaison du zinc a été identifié : il s’agit du NTD de la sous-unité GluN2A, la poche de fixation étant localisée dans la crevasse interlobes de ce domaine [
31]. Ceci suggère que la liaison du zinc provoque la fermeture du NTD de la même manière que le glutamate provoque la fermeture de l’ABD. Cette fermeture du NTD entraînerait à son tour l’inhibition du récepteur, c’est-à-dire la fermeture du canal ionique. Paradoxalement, en parallèle de son effet inhibiteur, le zinc augmente l’affinité apparente des récepteurs GluN1/GluN2A pour le glutamate [
32]. Le zinc fait donc entrer ces récepteurs dans un état inactif présentant une affinité augmentée pour l’agoniste caractéristique des états désensibilisés. Aussi, il est intéressant de noter que l’interface de dimérisation des ABD, qui contrôle la désensibilisation des récepteurs AMPA et kaïnate, contrôle l’inhibition par le zinc des récepteurs GluN1/GluN2A. En effet, la stabilité de l’hétérodimère formé par les ABD de GluN1 et GluN2A est inversement corrélée à l’efficacité de l’inhibition par le zinc [24,
33]. En considérant une organisation dimérique des NTD via leurs lobes supérieurs, le modèle suivant a été proposé : la liaison du zinc au NTD de GluN2A en induit la fermeture qui conduit à écarter les lobes inférieurs des deux NTD adjacents. Comme les lobes inférieurs des NTD sont directement connectés aux ABD, leur écartement provoque la rupture de l’interface de dimérisation des ABD et la fermeture du canal ionique, faisant passer les récepteurs GluN1/GluN2A dans un état similaire à l’état désensibilisé des récepteurs AMPA [33] (Figure 5A).
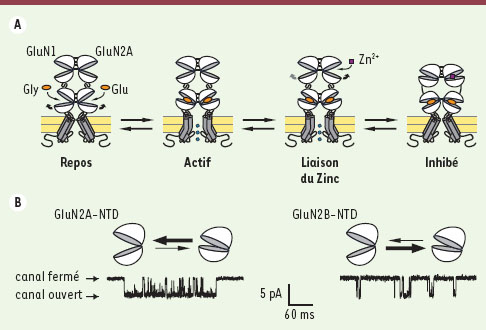
 | Figure 5.
Modulation de l’activité des récepteurs NMDA par le NTD de la sous-unité GluN2. A. Mécanisme d’inhibition par le zinc extracellulaire des récepteurs NMDA GluN1/GluN2A. Dans ce modèle, le zinc se lie au NTD de GluN2A et en provoque la fermeture, ce qui déstabilise l’interface de dimérisation des ABD [ 33]. Il faut souligner que l’organisation des NTD en hétérodimères GluN1/GluN2 est putative. On ignore également si le NTD de GluN1 peut adopter plusieurs conformations. B. En bas : courants unitaires portés par un récepteur GluN1/GluN2A (à gauche) et par un récepteur GluN1/GluN2B (à droite). En haut : modèle du contrôle de la probabilité d’ouverture (P o) des récepteurs NMDA par le NTD de la sous-unité GluN2. En l’absence de ligand, le NTD de la sous-unité GluN2 alterne spontanément entre conformations ouverte et fermée, la dernière favorisant la fermeture du canal ionique [
34]. Cet équilibre régule finement la P o des récepteurs NMDA : le canal des récepteurs GluN1/GluN2A aurait une forte P o car le NTD de la sous-unité GluN2A passerait la plupart du temps en conformation ouverte, alors que la plus faible P o des récepteurs GluN1/GluN2B reflèterait une propension plus importante du NTD de la sous-unité GluN2B à adopter une conformation fermée. |
|
Régulation dynamique de l’activité des récepteurs NMDA par le domaine amino-terminal des sous-unités GluN2 Il a été récemment montré que le NTD de la sous-unité GluN2, outre son rôle de domaine de liaison d’inhibiteurs allostériques, joue aussi un rôle majeur dans la diversité fonctionnelle au sein de la famille des récepteurs NMDA [34]. En effet, une différence fondamentale entre les sous-types de récepteurs NMDA réside dans leur probabilité d’ouverture maximale (Po : la proportion de temps que le canal passe à l’état ouvert en présence de concentrations saturantes d’agonistes). Elle va d’environ 50 % pour les récepteurs GluN1/GluN2A à environ 1 % pour les récepteurs GluN1/GluN2C et GluN1/GluN2D, en passant par une valeur intermédiaire d’environ 10 % pour les récepteurs GluN1/GluN2B [
35–
37]. Ces différences fondamentales de Po, qui confèrent à chaque sous-type de récepteurs NMDA des propriétés de transfert de charge et de signalisation uniques [35], sont contrôlées par l’identité de la partie amino-terminale de la sous-unité GluN2 [34]. Curieusement, l’hétérogénéité au sein des sous-types de récepteurs NMDA ne vient donc pas de différences au niveau de la zone « cœur » contrôlant l’activation des iGluR, c’est-à-dire l’ensemble ABD/canal, mais plutôt de la partie amino-terminale de la sous-unité GluN2. Cette région distale forme un module qui, sans être strictement indispensable au fonctionnement des récepteurs NMDA, régule finement leur activité. Quel mécanisme moléculaire rend compte de ce contrôle ? Le NTD de la sous-unité GluN2 oscillerait spontanément (en l’absence de tout ligand allostérique) entre une conformation ouverte, qui favoriserait l’ouverture du canal, et une conformation fermée, qui en favoriserait la fermeture [34]. L’équilibre dynamique entre ces deux conformations du NTD différerait selon le type de sous-unité GluN2 (Figure 5B). |
Perspectives pharmacologiques Notre compréhension des mécanismes régissant l’activation et la modulation des iGluR s’est donc affinée au niveau moléculaire au cours des dix dernières années. Il apparaît aujourd’hui possible d’envisager le développement de nouveaux outils pharmacologiques ciblant ces récepteurs. Ainsi, des molécules qui, comme le CTZ, moduleraient positivement les récepteurs AMPA en stabilisant l’interface de dimérisation d’ABD (Figure 4) pourraient être utiles pour lutter contre les troubles cognitifs associés aux maladies neurodégénératives telles que les maladies d’Alzheimer ou de Parkinson [
38]. L’interface de dimérisation des ABD pourrait aussi servir de cible à des composés potentialisant les récepteurs NMDA. Alternativement, un composé qui se lierait au NTD des sous-unités GluN2 et en empêcherait la fermeture devrait aussi permettre une potentialisation des récepteurs NMDA [34]. De tels modulateurs positifs pourraient être utiles dans le cadre de thérapies contre des psychoses telles que la schizophrénie étant donné l’implication probable d’un déficit d’activité des récepteurs NMDA dans ces pathologies [
39]. Au contraire, des inhibiteurs des récepteurs NMDA pourraient aider à lutter contre des pathologies impliquant une suractivité de ces récepteurs, par exemple lors d’ischémies cérébrales consécutives à un accident vasculaire cérébral [28], ou encore dans le cas de douleurs neuropathiques [7]. Cette stratégie pourrait être adoptée par des inhibiteurs allostériques provoquant la fermeture du NTD des sous-unités GluN2. C’est le cas de l’ifenprodil et de ses dérivés qui se lient sélectivement à la sous-unité GluN2B et présentent des caractéristiques neuroprotectrices prometteuses [
40]. Il n’en reste pas moins que la modulation pharmacologique des iGluR dans un but thérapeutique semble encore relever du numéro d’équilibriste. En effet, ces récepteurs, ubiquitaires dans le cerveau, sont indispensables au fonctionnement cérébral mais, dans le même temps, leur suractivation est délétère. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Je remercie Laetitia Mony, Pierre Paoletti, David Stroebel et Angela Vergnano pour la relecture du manuscrit, ainsi que le ministère de la Recherche, la Fondation pour la recherche médicale (FRM) et l’Université Pierre et Marie Curie pour leur soutien.
|
Footnotes |
1. Attwell D, Gibb A. Neuroenergetics and the kinetic design of excitatory synapses. Nat Rev Neurosci 2005; 6 : 841–9. 2. Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol 1997; 37 : 205–37. 3. Barbour B, Hausser M. Intersynaptic diffusion of neurotransmitter. Trends Neurosci 1997; 20 : 377–84. 4. Lerma J. Roles and rules of kaïnate receptors in synaptic transmission. Nat Rev Neurosci 2003; 4 : 481–95. 5. Herman MA, Jahr CE. Extracellular glutamate concentration in hippocampal slice. J Neurosci 2007; 27 : 9736–41. 6. Shigeri Y, Seal RP, Shimamoto K. Molecular pharmacology of glutamate transporters, EAAT and VGLUT. Brain Res Brain Res Rev 2004; 45 : 250–65. 7. Kemp JA, McKernan RM. NMDA receptor pathways as drug targets. Nat Neurosci 2002; 5 : 1039–42. 8. Benquet P, Gee CE, Gerber U. lschémie cérébrale : modulations des récepteurs NMDA et mort neuronale retardée. Med Sci (Paris) 2008; 24 : 185–90. 9. Dingledine R, Borges K, Bowie D, Traynelis SF. The glutamate receptor ion channels. Pharmacol Rev 1999; 51 : 7–61. 10. Bliss TV, Collingridge GL. A synaptic model of memory: long-term potentiation in the hippocampus. Nature 1993; 361 : 31–9. 11. Collingridge GL, Olsen RW, Peters J, Spedding M. A nomenclature for ligand-gated ion channels. Neuropharmacology 2009; 56 : 2–5. 12. Paoletti P, Neyton J. NMDA receptor subunits: function and pharmacology. Curr Opin Pharmacol 2007; 7 : 39–47. 13. Panatier A, Theodosis DT, Mothet JP, et al. Glia-derived D-serine controls NMDA receptor activity and synaptic memory. Cell 2006; 125 : 775–84. 14. Sheng M, Kim MJ. Postsynaptic signaling and plasticity mechanisms. Science 2002; 298 : 776–80. 15. Mayer ML. Glutamate receptors at atomic resolution. Nature 2006; 440 : 456–62. 16. Wollmuth LP, Sobolevsky AI. Structure and gating of the glutamate receptor ion channel. Trends Neurosci 2004; 27 : 321–8. 17. Chen GQ, Cui C, Mayer ML, Gouaux E. Functional characterization of a potassium-selective prokaryotic glutamate receptor. Nature 1999; 402 : 817–21. 18. Ayalon G, Stern-Bach Y. Functional assembly of AMPA and kainate receptors is mediated by several discrete protein-protein interactions. Neuron 2001; 31 : 103–13. 19. Armstrong N, Gouaux E. Mechanisms for activation and antagonism of an AMPA-sensitive glutamate receptor: crystal structures of the GluR2 ligand binding core. Neuron 2000; 28 : 165–81. 20. Galvez T, Pin JP. Comment fonctionne un récepteur couplé aux protéines G ? Le cas des récepteurs des neurotransmetteurs métabotropiques du glutamate et du GABA Med Sci (Paris) 2003; 19 : 559–65. 21. Furukawa H, Gouaux E. Mechanisms of activation, inhibition and specificity: crystal structures of the NMDA receptor NR1 ligand-binding core. EMBO J 2003; 22 : 2873–85. 22. Mayer ML. Crystal structures of the GluR5 and GluR6 ligand binding cores: molecular mechanisms underlying kainate receptor selectivity. Neuron 2005; 45 : 539–52. 23. Weston MC, Gertler C, Mayer ML, Rosenmund C. Interdomain interactions in AMPA and kainate receptors regulate affinity for glutamate. J Neurosci 2006; 26 : 7650–8. 24. Furukawa H, Singh SK, Mancusso R, Gouaux E. Subunit arrangement and function in NMDA receptors. Nature 2005; 438 : 185–92. 25. Sun Y, Olson R, Horning M, et al. Mechanism of glutamate receptor desensitization. Nature 2002; 417 : 245–53. 26. Weston MC, Schuck P, Ghosal A, et al. Conformational restriction blocks glutamate receptor desensitization. Nat Struct Mol Biol 2006; 13 : 1120–7. 27. Lipton P. Ischemic cell death in brain neurons. Physiol Rev 1999; 79 : 1431–568. 28. Bordet R, Ouk T, Onténiente B, et al. Ischémie cérébrale : les pistes thérapeutiques de demain. Med Sci (Paris) 2009; 25 : 847–54. 29. Legendre P, Rosenmund C, Westbrook GL. Inactivation of NMDA channels in cultured hippocampal neurons by intracellular calcium. J Neurosci 1993; 13 : 674–84. 30. Paoletti P, Vergnano AM, Barbour B, Casado M. Zinc at glutamatergic synapses. Neuroscience 2009; 158 : 126–36. 31. Paoletti P, Perin-Dureau F, Fayyazuddin A, et al. Molecular organization of a zinc binding n-terminal modulatory domain in a NMDA receptor subunit. Neuron 2000; 28 : 911–25. 32. Erreger K, Traynelis SF. Allosteric interaction between zinc and glutamate binding domains on NR2A causes desensitization of NMDA receptors. J Physiol 2005; 569 : 381–93. 33. Gielen M, Le Goff A, Stroebel D, et al. Structural rearrangements of NR1/NR2A NMDA receptors during allosteric inhibition. Neuron 2008; 57 : 80–93. 34. Gielen M, Siegler Retchless B, Mony L, et al. Mechanism of differential control of NMDA receptor activity by NR2 subunits. Nature 2009; 459 : 703–7. 35. Erreger K, Dravid SM, Banke TG, et al. Subunit-specific gating controls rat NR1/NR2A and NR1/NR2B NMDA channel kinetics and synaptic signalling profiles. J Physiol 2005; 563 : 345–58. 36. Wyllie DJ, Behe P, Colquhoun D. Single-channel activations and concentration jumps: comparison of recombinant NR1a/NR2A and NR1a/NR2D NMDA receptors. J Physiol 1998; 510 : 1–18. 37. Dravid SM, Prakash A, Traynelis SF. Activation of recombinant NR1/NR2C NMDA receptors. J Physiol 2008; 586 : 4425–39. 38. Lynch G. AMPA receptor modulators as cognitive enhancers. Curr Opin Pharmacol 2004; 4 : 4–11. 39. Lisman JE, Coyle JT, Green RW, et al. Circuit-based framework for understanding neurotransmitter and risk gene interactions in schizophrenia. Trends Neurosci 2008; 31 : 234–42. 40. Mony L, Kew JN, Gunthorpe MJ, Paoletti P. Allosteric modulators of NR2B-containing NMDA receptors: molecular mechanisms and therapeutic potential. Br J Pharmacol 2009; 157 : 1301–17. 41. Tong G, Jahr CE. Multivesicular release from excitatory synapses of cultured hippocampal neurons. Neuron 1994; 12 : 51–9. |