| |
| Med Sci (Paris). 2010 January; 26(1): 73–78. Published online 2010 January 15. doi: 10.1051/medsci/201026173.Actualités sur les norovirus Alexis de Rougemont, Katia Ambert-Balay, Gaël Belliot, and Pierre Pothier* Centre National de Référence des virus entériques, Laboratoire de virologie, Plateau technique de Biologie, Centre Hospitalier Universitaire de Dijon, 2, rue Angélique Ducoudray, BP 37013, F-21070 Dijon Cedex, France |
Les gastroentérites sont responsables d’une morbidité et d’une mortalité importantes dans le monde : chaque année on dénombre près de 1,4 milliard d’épisodes et 1,6 à 2,5 millions de décès, majoritairement dans les pays en voie de développement [
1,
2]. Les virus en sont les principales étiologies. Si les rotavirus sont plus fréquemment retrouvés chez l’enfant de moins de 5 ans [
3,
4], les norovirus sont aujourd’hui reconnus comme l’agent étiologique majeur des gastroentérites quelle que soit la tranche d’âge [
5]. Au niveau mondial, les taux de prévalence des infections à norovirus dans la population générale varient de 11 % (Pays-Bas) à 20 % (France, Japon, États-Unis) [
6]. Considérés d’abord comme l’agent majeur des gastroentérites alimentaires ou hydriques avec plus de 50 % de cas groupés, les progrès réalisés dans leur diagnostic par des techniques moléculaires montrent aujourd’hui leur importance dans d’autres contextes épidémiques et dans les cas de gastroentérites sporadiques chez l’adulte et l’enfant. Ainsi, on estime que plus de 80 % des épidémies de gastroentérites non bactériennes sont dues à des norovirus [
7,
8]. |
Historique et caractéristiques morphologiques Les norovirus ont été identifiés en 1972 par l’examen en immuno-microscopie électronique d’un échantillon de selle provenant d’un malade contaminé au cours d’une épidémie survenue dans une école à Norwalk (Ohio, États-Unis) en 1968 [
9]. D’abord dénommés « agents de Norwalk » en référence à la ville de leur première identification, ils sont aujourd’hui regroupés dans le genre Norovirus et classés dans la famille des Caliciviridae. Ces virus, non enveloppés et d’un diamètre de 27 nm, ont été les premiers virus responsables de gastroentérite identifiés chez l’homme. Leur génome, constitué d’un ARN simple brin positif polyadénylé d’environ 7 700 nucléotides, comprend trois cadres ouverts de lecture (ORF1-3, open reading frame) codant respectivement les protéines non structurales, la protéine majeure de capside (VP1) et une protéine structurale mineure basique (VP2). |
Diversité génétique et évolution Les norovirus présentent une grande diversité génétique. Les souches sont classées en génogroupes subdivisés en génotypes. Actuellement, on distingue 5 génogroupes (I à V) mais seuls les génogroupes I, II et IV infectent l’homme. Les génogroupes I et II sont les plus importants et sont divisés respectivement en 8 et 19 génotypes [
10]. Ainsi la dénomination utilisée mentionne le génogroupe puis le génotype du norovirus : GGI.1 à GGI.8 et GGII.1 à GGII.19 (Figure 1). Des norovirus responsables de zoonoses sont également classés dans le genre Norovirus, parmi lesquels des souches bovines (génogroupe III, virus Jena et Newbury-agent 2), trois souches porcines (génogroupe II) ainsi qu’une souche murine ou MNV (génogroupe V). Ce MNV est actuellement le seul norovirus qui peut être mis en culture et donc être utilisé dans des modèles animaux pour l’étude des norovirus humains. Il n’existe aujourd’hui aucune preuve de transmission de l’animal à l’homme même si certaines souches présentent des similitudes génétiques.
 | Figure 1.
Classification des norovirus. Les norovirus humains appartiennent aux génogroupes I, II et IV. |
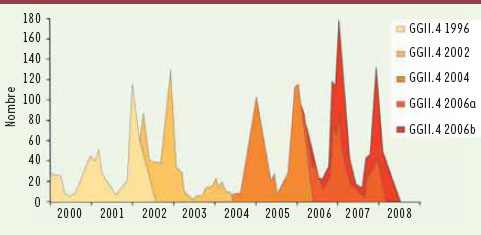
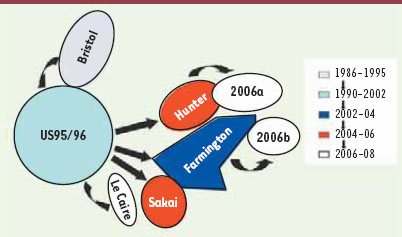
Les norovirus sont l’objet d’une variabilité génétique résultant de mutations ou de recombinaisons. La variabilité génétique par mutation concerne particulièrement le génotype GGII.4, principal responsable des épidémies à travers le monde. L’analyse génétique des souches successives durant la dernière décennie montre la grande capacité évolutive de ce génotype et l’émergence de variants à l’origine de nouvelles épidémies à diffusion mondiale. Ce fut le cas en 2002 avec la souche Farmington Hills entraînant une augmentation importante des épidémies dans toute l’Europe [
11], en 2004 avec la souche Hunter qui lui a succédé [
12] et en 2006 avec la circulation simultanée de 2 nouveaux variants, les souches 2006a et 2006b [
13] (Figures 2 et 3). Ces nouvelles souches sont porteuses de mutations dans la protéine de capside VP1 qui peuvent être à l’origine d’un échappement à la réponse immunitaire ou d’une modification des propriétés de liaison de ces virus à leurs récepteurs cellulaires [
14,
15].
 | Figure 2.
Évolution épidermique. Nombre d’épidémies mensuelles de gastroentérite dues aux variants GGII.4 rapportées entre 2000 et 2008 par un réseau de laboratoires de 11 pays européens. |
 | Figure 3.
Schéma de la filiation des différentes souches de norovirus. Schématisation de l’analyse par « arbre minimum couvrant » de plusieurs souches de différents variants GGII.4 permettant de mettre en évidence une filiation entre divers variants GGII.4 au cours de leur évolution. Cet arbre est basé sur l’alignement de 193 séquences complètes d’acides aminés codant pour l’ORF2 de norovirus GGII.4 enregistrées dans GenBank et de souches épidémiques isolées au sein du CNR des virus entériques. Les groupes de variants GGII.4 ont été arbitrairement définis par six changements ou moins d’acides aminés. |
Par ailleurs, une recombinaison entre des souches exprimant une ARN polymérase et une capside dérivées de souches parentales différentes a été décrite [
16]. L’un de ces virus recombinants, le variant GGIIb, a été isolé pour la première fois au cours d’une épidémie d’origine hydrique dans le sud de la France en août 2000 [
17]. Il a représenté jusqu’à 26 % des souches caractérisées en Europe et reste une de celles qui sont le plus fréquemment retrouvées lors d’épidémies et de cas sporadiques de gastroentérite. D’autres virus recombinants ont été identifiés suggérant que ce phénomène n’est pas rare [
18]. |
Caractéristiques cliniques des infections à norovirus Les norovirus infectent les personnes de tous les âges. L’incubation est courte, 24 à 48 heures, et la symptomatologie est dominée par l’apparition rapide de nausées, de vomissements, de diarrhée et de douleurs abdominales ; une fièvre et des frissons peuvent également être présents. Des manifestations cliniques atypiques et des complications peuvent intervenir chez des personnes immunodéprimées ou affaiblies [
19]. Une hyperleucocytose sanguine et la présence de leucocytes dans les selles sont fréquentes [
20]. La symptomatologie n’excède en général pas trois jours. Cependant, des infections prolongées, parfois pendant plusieurs semaines, sont observées dans certaines circonstances, chez les personnes âgées souffrant de pathologie chronique et chez les immunodéprimés [
21]. L’excrétion virale dans les fèces est abondante, de 107 à 1010 particules virales par gramme de selles pendant 7 à 10 jours [
22] ; elle se prolonge fréquemment au-delà de la période symptomatique [5] et constitue une source de dissémination de l’infection. Les gastroentérites à norovirus sont fréquentes et généralement bénignes, sauf aux âges extrêmes de la vie et chez l’immunodéprimé. Chez l’enfant hospitalisé, la sévérité des gastroentérites à norovirus semble moindre que celle des gastroentérites à rotavirus si l’on se réfère aux scores de gravité ou à la nécessité d’une réhydratation par voie intraveineuse. Dans les pays moins avancés sur le plan médico-social, la sévérité des gastroentérites à norovirus est comparable à celle des rotavirus et pourrait témoigner d’un retard de prise en charge [
23]. Ces virus sont aussi responsables des gastroentérites chez les personnes âgées chez lesquelles elles sont plus graves et plus fréquentes, et peuvent s’accompagner d’une déshydratation déstabilisant un état précaire et nécessitant une hospitalisation ; elles peuvent parfois entraîner le décès. La mortalité liée à ces gastroentérites se situerait entre 0,8 et 2,8‰ [
24]. Enfin, des diarrhées chroniques à norovirus ont été observées chez des patients transplantés prenant un traitement immunosuppresseur [
25]. |
Le mode féco-oral est la principale voie de transmission du virus, soit de façon directe, soit par la contamination des surfaces de l’environnement (poignées de porte, mobilier et objets divers) qui jouent un rôle de relais dans la transmission du virus lors d’une épidémie. Par ailleurs, les aérosols qui se créent lors des vomissements peuvent représenter un mode de transmission opportuniste qui accélère encore la propagation du virus dans les collectivités confinées comme les maisons de retraite, les services hospitaliers, les hôtels, les bateaux de croisière et les crèches. Plusieurs facteurs contribuent à l’impact considérable des infections à norovirus, en particulier lors d’épidémies : (1) la résistance du virus aux pH acides ou basiques, à la chaleur, aux concentrations habituelles de chlore favorise leur persistance dans l’environnement ; (2) une dose infectieuse faible peut entraîner la maladie (10 unités PCR seraient suffisantes dans le cas du virus Norwalk, l’unité PCR représentant une estimation du nombre de copies d’ARN amplifiables dans le cas de virus non multipliables en culture de cellules) [
26] ; (3) la présence de porteurs asymptomatiques et l’excrétion du virus durant la phase post-symptomatique qui peut durer plus de 3 semaines [21]. La transmission par les aliments ou l’eau des infections à norovirus est bien connue et les coquillages ont été souvent incriminés, en particulier les huîtres. Mais de nombreux aliments contaminés ont également été mis en cause : salades, sandwichs, fruits et légumes frais ou congelés, pâtisseries. Ces aliments sont souillés soit par l’intermédiaire du milieu hydrique contaminé (lavage de denrées, irrigation de végétaux consommés crus ou élevage de coquillages), soit lors de leur manipulation par des personnes infectées. Ce mode de transmission qui fait intervenir une personne infectée, qu’elle soit symptomatique ou non, ayant manipulé un aliment serait responsable d’environ la moitié des épidémies d’origine alimentaire. Toutefois, la transmission de personne à personne est le plus souvent incriminée dans les épidémies. Elle peut être secondaire à une origine alimentaire ou hydrique, mais le plus souvent celle-ci ne peut être retrouvée, l’introduction du virus dans la collectivité se faisant par l’intermédiaire d’une personne infectée (personnel, visiteur…), symptomatique ou non mais excrétrice du virus. |
Caractéristiques épidémiologiques On distingue deux contextes épidémiologiques : les gastroentérites sporadiques et les gastroentérites épidémiques d’origine alimentaire ou hydrique, qu’il convient de distinguer de celles qui surviennent au sein d’institutions ou d’établissements de soins. Les gastroentérites sporadiques L’importance des norovirus dans la survenue des gastroentérites sporadiques hivernales observées en médecine générale est encore peu documentée. Néanmoins, les techniques moléculaires de diagnostic montrent que les norovirus sont la principale cause des gastroentérites ambulatoires chez l’adolescent et l’adulte [
27] et la deuxième cause d’hospitalisation pour gastroentérites chez les enfants de moins de 5 ans après les rotavirus (12-15 % pour les norovirus contre 50 % pour les rotavirus) [
28]. Les gastroentérites épidémiques ou cas groupés de gastroentérites Les gastroentérites d’origine alimentaire ou hydrique sont fréquemment dues aux norovirus. Ces épidémies sont explosives avec un taux d’attaque élevé (50 % des individus) et une transmission également élevée (27 % de taux d’attaque secondaire). L’enquête épidémiologique retrouve une source de contamination commune que l’analyse virologique des aliments incriminés n’arrive pas toujours à confirmer. En revanche, l’analyse virologique des selles est le plus souvent positive et montre une très grande diversité des génogroupes et génotypes de norovirus impliqués. Ces épidémies surviennent tout au long de l’année sans caractère saisonnier. Au contraire, les épidémies de gastroentérites touchant les établissements de soins et d’hébergement sont principalement hivernales et ont une prévalence d’environ 10 % [
29,
30]. Elles sont la deuxième cause de mortalité après les maladies cardiovasculaires chez les personnes âgées [
31] et l’une des principales pathologies infectieuses avec les infections respiratoires. Tout aussi brutales que celles qui surviennent dans la population générale, ces épidémies ont les caractéristiques épidémiologiques d’une transmission de personne à personne. Sur un plan virologique, elles se distinguent des précédentes par le génotype du norovirus en cause, qui est presque exclusivement le génogroupe II et principalement le génotype GGII.4 responsable de la majorité des épidémies hivernales observées en Europe et dans le reste du monde [
32–
35]. |
Pathogenèse et susceptibilité de l’hôte Les premières expérimentations chez les volontaires sains montraient que malgré une bonne réponse immunologique après infection, la protection induite était de courte durée [
36,
37]. Mais curieusement, ces études montraient aussi que 13 à 40 % des volontaires n’étaient jamais infectés et seulement 50 % d’entre eux devenaient symptomatiques. À l’origine inexpliquée, cette différence de susceptibilité est due à des facteurs génétiques de l’hôte et plus particulièrement à la présence ou non de récepteurs glycaniques au niveau des cellules intestinales [
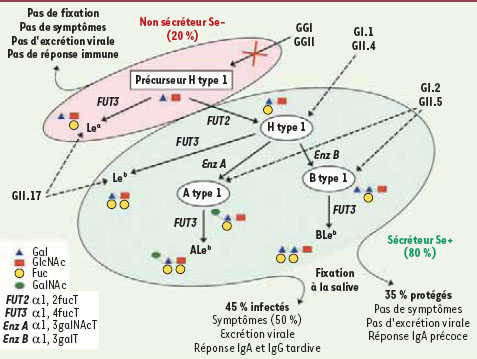
38]. Ces récepteurs sont des glycanes appartenant à la famille des groupes sanguins tissulaires ABO dont l’expression dépend du polymorphisme combiné aux locus ABO, FUT2 (Fucosyltransferase 2) et FUT3 (Fucosyltransferase 3, groupe sanguin Lewis). Les différentes souches de norovirus ne reconnaissant pas le même motif glycanique [
39], cela explique les variations individuelles observées lors des expérimentations ou lors des épidémies (Figure 4).
 | Figure 4.
Interactions des norovirus humains avec leurs ligands de type glycanique et conséquences pour l’expression symptomatique de la maladie. Les interactions des norovirus humains avec leurs ligands sont indiquées par des flèches pointillées. Les motifs glucidiques constituant chaque ligand sont représentés symboliquement. Les enzymes permettant la synthèse des glycanes sont indiqués sur des flèches pleines. La population se divise en deux groupes, les non sécréteurs (20 % de la population) et les sécréteurs, ces derniers affichant les glycanes nécessaires à la fixation des norovirus sur la muqueuse intestinale. Sauf exceptions (GGII.17), les individus non sécréteurs ne pouvant fixer les norovirus ne contractent pas de gastroentérites et la réponse immunitaire est absente. Le groupe des sécréteurs se divise en deux sous-groupes. Pour 45 % de la population totale, les patients développent la maladie, excrètent le virus et présentent une élévation tardive des IgA (immunoglobulines A) et IgG spécifiques. Pour l’autre groupe, soit 35 % de la population, les personnes sont asymptomatiques, n’excrètent pas de virus et ont, en revanche, une réponse IgA précoce. |
|
En l’absence de système de culture in vitro de ces souches virales, la microscopie électronique a longtemps été la seule méthode de diagnostic. Aujourd’hui, les méthodes de virologie moléculaire (RT-PCR) sont devenues les outils standard de détection et de suivi épidémiologique des norovirus. Pour détecter la totalité des génotypes connus, ces techniques utilisent plusieurs couples d’amorces ciblant une région conservée de l’ORF1 codant la polymérase. D’autres amorces ont été développées pour amplifier les régions de l’ORF2 codant la protéine de capside VP1 [
40–
42]. L’hybridation ou le séquençage du produit amplifié caractérisera le génotype du norovirus. Plus récentes, les techniques de PCR en temps réel s’affirment comme une alternative de détection sensible et surtout plus rapide. Le manque de sensibilité des techniques immunologiques (ELISA, immunochromatographie) ne permettait pas leur utilisation en diagnostic de routine. L’amélioration constatée des dernières trousses commercialisées leur permet d’entrer dans une stratégie de diagnostic des épidémies [
43]. Nul doute que les améliorations futures apportées à ces tests leur permettront de devenir le diagnostic de routine des gastroentérites à norovirus. |
Les actions de prévention des infections à norovirus doivent cibler les différents niveaux de la contamination. La protection des zones de production alimentaire ou des zones hydriques - parcs à huîtres, eaux d’irrigation ou de distribution - repose sur les contrôles en amont, la surveillance des stations de traitement des eaux usées ou l’interdiction de rejets sauvages. Le contrôle des zones sensibles par les techniques moléculaires facilite la surveillance et accélère les alertes sanitaires. En aval, le respect des règles d’hygiène est indispensable pour éviter la contamination des aliments lors de leur préparation et pour limiter la diffusion du virus de personne à personne. Les surfaces de travail doivent être désinfectées à l’eau de javel. Tout employé malade doit être exclu de son travail jusqu’à 48 à 72 heures après la fin des symptômes. Dans les établissements de soins ou d’hébergement, la prévention repose sur un respect permanent des règles d’hygiène et des précautions dites « contact » [
44] : lavage soigneux des mains avec de l’eau et un savon antiseptique ou avec des solutions hydroalcooliques choisies pour leur efficacité [
45]. Dès les premiers cas de gastroentérites, ces mesures doivent être renforcées (strict lavage des mains, port d’un sarrau, de masque en cas de vomissements) et associées à une décontamination des surfaces et de l’environnement à l’aide d’un désinfectant reconnu virucide pour les norovirus tel que l’hypochlorite de sodium à 0,5 % (eau de Javel) [45,
46]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Bryce J, Boschi-Pinto C, Shibuya K, Black RE. WHO estimates of the causes of death in children. Lancet 2005; 365 : 1147–52. 2. Kosek M, Bern C, Guerrant RL. The global burden of diarrhoeal disease, as estimated from studies published between 1992 and 2000. Bull World Health Organ 2003; 81 : 197–204. 3. Parashar UD, Gibson CJ, Bresse JS, Glass RI. Rotavirus and severe childhood diarrhea. Emerg Infect Dis 2006; 12 : 304–6. 4. Parashar UD, Hummelman EG, Bresee JS, et al. Global illness and deaths caused by rotavirus disease in children. Emerg Infect Dis 2003; 9 : 565–72. 5. Rockx B, De Wit M, Vennema H, et al. Natural history of human calicivirus infection: a prospective cohort study. Clin Infect Dis 2002; 35 : 246–53. 6. Koopmans M, von Bonsdorff CH, Vinje J, et al. Foodborne viruses. FEMS Microbiol Rev 2002; 26 : 187–205. 7. Lopman BA, Reacher MH, Van Duijnhoven Y, et al. Viral gastroenteritis outbreaks in Europe, 1995-2000. Emerg Infect Dis 2003; 9 : 90–6. 8. Svraka S, Duizer E, Vennema H, et al. Etiological role of viruses in outbreaks of acute gastroenteritis in The Netherlands from 1994 through 2005. J Clin Microbiol 2007; 45 : 1389–94. 9. Kapikian AZ. The discovery of the 27-nm Norwalk virus: an historic perspective. J Infect Dis 2000; 181 (suppl 2) : S295–302. 10. Zheng DP, Ando T, Fankhauser RL, et al. Norovirus classification and proposed strain nomenclature. Virology 2006; 346 : 312–23. 11. Lopman B, Vennema H, Kohli E, et al. Increase in viral gastroenteritis outbreaks in Europe and epidemic spread of new norovirus variant. Lancet 2004; 363 : 682–8. 12. Bull RA, Tu ET, McIver CJ, et al. Emergence of a new norovirus genotype II.4 variant associated with global outbreaks of gastroenteritis. J Clin Microbiol 2006; 44 : 327–33. 13. Kamel AH, Ali MA, El-Nady HG, et al. Predominance and circulation of enteric viruses in the region of Greater Cairo, Egypt. J Clin Microbiol 2009; 47 : 1037–45. 14. Lindesmith LC, Donaldson EF, Lobue AD, et al. Mechanisms of GII.4 norovirus persistence in human populations. PLoS Med 2008; 5 : e31. 15. Siebenga JJ, Vennema H, Renckens B, et al. Epochal evolution of GGII.4 norovirus capsid proteins from 1995 to 2006. J Virol 2007; 81 : 9932–41. 16. Jiang X, Espul C, Zhong WM, et al. Characterization of a novel human calicivirus that may be a naturally occurring recombinant. Arch Virol 1999; 144 : 2377–87. 17. Ambert-Balay K, Bon F, Le Guyader F, et al. Characterization of new recombinant noroviruses. J Clin Microbiol 2005; 43 : 5179–86. 18. Bull RA, Tanaka MM, White PA. Norovirus recombination. J Gen Virol 2007; 88 : 3347–59. 19. Hutson AM, Atmar RL, Estes MK. Norovirus disease: changing epidemiology and host susceptibility factors. Trends Microbiol 2004; 12 : 279–87. 20. Yu C, Baker S, Morse LJ, et al. Clinical and laboratory findings in individuals with acute norovirus disease. Arch Intern Med 2007; 167 : 1903–5. 21. Tu ET, Bull RA, Kim MJ, et al. Norovirus excretion in an aged-care setting. J Clin Microbiol 2008; 46 : 2119–21. 22. Kageyama T, Kojima S, Shinohara M, et al. Broadly reactive and highly sensitive assay for Norwalk-like viruses based on real-time quantitative reverse transcription-PCR. J Clin Microbiol 2003; 41 : 1548–57. 23. Sdiri-Loulizi K, Gharbi-Khelifi H, de Rougemont A, et al. Acute infantile gastroenteritis associated with human enteric viruses in Tunisia. J Clin Microbiol 2008; 46 : 1349–55. 24. Lopman BA, Adak GK, Reacher MH, Brown DW. Two epidemiologic patterns of norovirus outbreaks: surveillance in England and wales, 1992-2000. Emerg Infect Dis 2003; 9 : 71–7. 25. Kaufman SS, Chatterjee NK, Fuschino ME, et al. Calicivirus enteritis in an intestinal transplant recipient. Am J Transplant 2003; 3 : 764–8. 26. Teunis PF, Moe CL, Liu P, et al. Norwalk virus: how infectious is it ? J Med Virol 2008; 80 : 1468–76. 27. Chikhi-Brachet R, Bon F, Toubiana L, et al. Virus diversity in a winter epidemic of acute diarrhea in France. J Clin Microbiol 2002; 40 : 4266–72. 28. Lorrot M, Bon F, El Hajje M, et al. Enteric viruses in hospitalized children with acute gastroenteritis during a two year period (Paris, France). 2009 (soumis pour publication). 29. Nicolle LE, Strausbaugh LJ, Garibaldi RA. Infections and antibiotic resistance in nursing homes. Clin Microbiol Rev 1996; 9 : 1–17. 30. Tsan L, Davis C, Langberg R, et al. Prevalence of nursing home-associated infections in the Department of Veterans Affairs nursing home care units. Am J Infect Control 2008; 36 : 173–9. 31. Aronow WS. Clinical causes of death of 2372 older persons in a nursing home during 15-year follow-up. J Am Med Dir Assoc 2000; 1 : 95–6. 32. Green KY, Belliot G, Taylor JL, et al. A predominant role for Norwalk-like viruses as agents of epidemic gastroenteritis in Maryland nursing homes for the elderly. J Infect Dis 2002; 185 : 133–46. 33. Bon F, Ambert-Balay K, Giraudon H, et al. Molecular epidemiology of caliciviruses detected in sporadic and outbreak cases of gastroenteritis in France from December 1998 to February 2004. J Clin Microbiol 2005; 43 : 4659–64. 34. Kroneman A, Verhoef L, Harris J, et al. Analysis of integrated virological and epidemiological reports of norovirus outbreaks collected within the foodborne viruses in Europe Network from 1 July 2001 to 30 June 2006. J Clin Microbiol 2008; 46 : 2959–65. 35. Gallimore CI, Green J, Lewis D, et al. Diversity of noroviruses cocirculating in the north of England from 1998 to 2001. J Clin Microbiol 2004; 42 : 1396–401. 36. Johnson PC, Mathewson JJ, DuPont HL, Greenberg HB. Multiple-challenge study of host susceptibility to Norwalk gastroenteritis in US adults. J Infect Dis 1990; 161 : 18–21. 37. Parrino TA, Schreiber DS, Trier JS, Kapikian AZ, Blacklow NR. Clinical immunity in acute gastroenteritis caused by Norwalk agent. N Engl J Med 1977; 297 : 86–9. 38. Lindesmith L, Moe C, Marionneau S, et al. Human susceptibility and resistance to Norwalk virus infection. Nat Med 2003; 9 : 548–53. 39. Harrington PR, Lindesmith L, Yount B, et al. Binding of Norwalk virus-like particles to ABH histo-blood group antigens is blocked by antisera from infected human volunteers or experimentally vaccinated mice. J Virol 2002; 76 : 12335–43. 40. Kojima S, Kageyama T, Fukushi S, et al. Genogroup-specific PCR primers for detection of Norwalk-like viruses. J Virol Methods 2002; 100 : 107–14. 41. Le Guyader F, Estes MK, Hardy ME, et al. Evaluation of a degenerate primer for the PCR detection of human caliciviruses. Arch Virol 1996; 141 : 2225–35. 42. Vennema H, de Bruin E, Koopmans M. Rational optimization of generic primers used for Norwalk-like virus detection by reverse transcriptase polymerase chain reaction. J Clin Virol 2002; 25 : 233–5. 43. Gray JJ, Kohli E, Ruggeri FM, et al. European multicenter evaluation of commercial enzyme immunoassays for detecting norovirus antigen in fecal samples. Clin Vaccine Immunol 2007; 14 : 1349–55. 44. Siegel JD, Rhinehart E, Jackson M, Chiarello L. 2007 Guideline for isolation precautions: preventing transmission of infectious agents in health care settings. Am J Infect Control 2007; 35 : S65–164. 45. Belliot G, Lavaux A, Souihel D, et al. Use of murine norovirus as a surrogate to evaluate resistance of human norovirus to disinfectants. Appl Environ Microbiol 2008; 74 : 3315–8. 46. Barker J, Vipond IB, Bloomfield SF. Effects of cleaning and disinfection in reducing the spread of Norovirus contamination via environmental surfaces. J Hosp Infect 2004; 58 : 42–9. |