| |
| Med Sci (Paris). 2010 February; 26(2): 135–137. Published online 2010 February 15. doi: 10.1051/medsci/2010262135.Elongator orchestre la neurogenèse du cortex cérébral Catherine Creppe,2 Lina Malinouskaya,1 Marie-Laure Volvert,1 Pierre Close,2 Sophie Laguesse,1 Magali Gillard,2 Alain Chariot,2* and Laurent Nguyen1* 1Interdisciplinary Cluster for Applied Genoproteomics (GIGA-R), Developmental Neurobiology Unit, University of Liege, CHU Sart Tilman, Liège 4000, Belgique 2Interdisciplinary Cluster for Applied Genoproteomics (GIGA-R), GIGA Signal Transduction, Liège 4000, Belgique MeSH keywords: Acétylation, Animaux, Protéines de transport, génétique, physiologie, Mouvement cellulaire, Cortex cérébral, cytologie, Dysautonomie familiale, physiopathologie, Histone acetyltransferases, Histone, métabolisme, Humains, Souris |
Elongator, un rôle initial dans l’élongation des ARNm La dysautonomie familiale, ou syndrome de Riley-Day, est une maladie neurodégénérative héréditaire particulièrement représentée dans la population juive ashkénaze (une personne sur vingt-sept est porteuse de la mutation). Elle est caractérisée par sa transmission autosomique récessive et affecte notamment le développement et la survie de certains neurones des systèmes nerveux autonome et sensoriel. Les patients atteints de cette maladie présentent des troubles gastro-intestinaux, des problèmes de déglutition, des crises de vomissements, de l’hypotonie et de l’instabilité thermique [
1]. Ces patients sont également sujets à des crises dysautonomiques durant lesquelles certaines régions de leur cortex cérébral présentent une activité neuronale anormale [
2]. La cause moléculaire de cette maladie est une mutation ponctuelle du gène IKBKAP (inhibitor of kappa light polypeptide gene enhancer in B-cells, kinase complex-associated protein) qui code pour la protéine Elp1, laquelle est requise pour l’assemblage du complexe Elongator. Ce dernier est composé de six sous-unités nommées Elp1 à Elp6. Il a été initialement décrit chez la levure comme interagissant avec la forme hyperphosphorylée de l’ARN polymérase II [
3]. Les recherches qui ont suivi ont révélé qu’Elongator contribue à l’élongation de certains ARN messagers. En effet, le complexe Elongator, et plus particulièrement sa sous-unité Elp3, possède une activité histone acétyl-transférase envers l’histone H3, rendant ainsi possible la progression de l’ARN polymérase II au niveau de la région transcrite de certains gènes [
4,
5]. Des études récentes ont démontré qu’Elongator remplit aussi des fonctions dans le cytoplasme, comme la régulation de l’exocytose et la modification de certains ARN de transfert [
6,
7]. |
Elongator, la première enzyme responsable de l’acétylation de la tubuline alpha Dans ce contexte, les travaux menés dans notre laboratoire ont révélé une nouvelle fonction du complexe Elongator durant la mise en place du cortex cérébral de la souris. En effet, nos résultats montrent qu’Elongator coordonne la migration et la différenciation terminale des neurones de projection du cortex cérébral via la promotion de l’acétylation de la tubuline alpha dans le cytoplasme [
8]. Plus précisément, afin de caractériser les rôles d’Elongator au cours du développement cortical, nous avons utilisé la technique d’électroporation in utero et démontré que la réduction d’expression de Elp1 ou de Elp3 par ARN interférence dans le cortex cérébral d’embryon de souris entraîne un retard de migration des neurones de projection du cortex cérébral. De plus, ces neurones présentent des défauts permanents de formation de neurites caractérisés par une réduction de la longueur totale et une diminution de la complexité de l’arbre dendritique et des axones. L’intégrité du complexe semble par ailleurs requise pour ces fonctions puisque la coexpression d’une forme tronquée de Elp1, qui n’interagit pas avec Elp3, ne corrige pas ce phénotype résultant de l’inhibition d’expression endogène d’Elp1 par ARN interférence. Nous avons ensuite caractérisé la voie de signalisation moléculaire qui agit en aval d’Elongator afin de réguler la migration et la différenciation des neurones de projection corticaux. Nos expériences ont non seulement révélé un enrichissement d’Elp1 dans les fractions microtubulaires de neurones corticaux, mais également une interaction entre la tubuline alpha, ou sa forme acétylée, et les sous-unités Elp1 et Elp3 d’Elongator. De plus, des cellules déficientes pour Elp1 ou Elp3 ont un taux réduit de tubuline alpha acétylée, suggérant que l’activité enzymatique du complexe Elongator est requise pour l’acétylation de la tubuline alpha. Nous avons finalement démontré qu’Elp3 possède une activité enzymatique acétyl-transférase intrinsèque envers la tubuline et, de ce fait, découvert la première enzyme responsable de l’acétylation de cette protéine. |
Elongator, un partenaire essentiel du transport protéique dans les neurones ? La réduction de l’acétylation des microtubules pourrait expliquer, en partie du moins, les défauts observés dans les neurones déficients pour Elongator. En effet, l’acétylation de la tubuline alpha favorise la liaison et la motilité de moteurs moléculaires comme les kinésines et le complexe dynéine/dynactine sur le réseau microtubulaire de la cellule [
9,
10]. Ces protéines transportent des molécules dites « cargo » le long des microtubules afin de les distribuer dans différents compartiments subcellulaires. Ce système de transport s’avère extrêmement important dans les cellules comme les neurones qui, par leur grande taille, posent un véritable défi à l’organisme pour l’organisation du transport intracellulaire [
11]. Dès lors, nous suggérons que grâce à sa capacité d’acétyler la tubuline alpha, Elongator régulerait indirectement le transport de protéines requises pour la motilité cellulaire et la différenciation des neurones corticaux. L’ensemble de nos travaux suggère que certains aspects de la dysautonomie familiale pourraient être expliqués par un défaut de migration des cellules déficientes pour le complexe Elongator [4]. En effet, nous avons initialement montré une altération de la motilité cellulaire en raison d’un défaut d’acétylation des histones H3 au niveau de la région à transcrire de certains gènes codant pour des protéines impliquées dans la migration. Notre étude suggère maintenant que l’activité acétyl-transférase d’Elongator s’exerce également sur la tubuline alpha. L’acétylation de ce nouveau substrat d’Elongator est une modification post-traductionnelle importante pour la migration des neurones de projection du cortex cérébral. Nos résultats n’excluent cependant pas l’existence de cibles cytoplasmiques supplémentaires d’Elongator, dont l’absence ou la réduction d’acétylation pourrait contribuer à la pathogenèse des patients atteints de dysautonomie familiale.
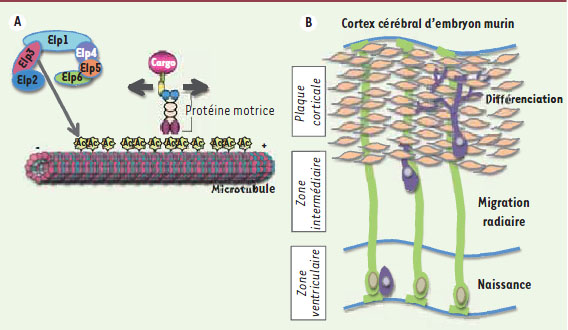
 | Figure 1.
Fonctions de la protéine Elongator. A.
Elongator promeut l’acétylation de la tubuline alpha dans les microtubules (Ac). Cette modification post-traductionnelle est importante pour la reconnaissance et l’ancrage de protéines motrices qui transportent divers cargos le long des microtubules. B. Schéma représentant une portion du cortex cérébral d’un embryon de souris au 14e jour de gestation. Les neurones de projection (mauves) naissent dans la zone ventriculaire à partir de cellules de la glie radiaire (vert) puis migrent le long des fibres radiaires afin d’atteindre la plaque corticale où ils se différencient et développent des dendrites et des axones. |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Axelrod FB. Familial dysautonomia. Muscle Nerve 2004; 29 : 352–63. 2. Slaugenhaupt SA, Blumenfeld A, Gill SP, et al. Tissue-specific expression of a splicing mutation in the IKBKAP gene causes familial dysautonomia. Am J Hum Genet 2001; 68 : 598–605. 3. Otero G, Fellows J, Li Y, et al. Elongator, a multisubunit component of a novel RNA polymerase II holoenzyme for transcriptional elongation. Mol Cell 1999; 3 : 109–18. 4. Close P, Hawkes N, Cornez I, et al. Transcription impairment and cell migration defects in elongator-depleted cells: implication for familial dysautonomia. Mol Cell 2006; 22 : 521–31. 5. Gilbert C, Kristjuhan A, Winkler GS, Svejstrup JQ. Elongator interactions with nascent mRNA revealed by RNA immunoprecipitation. Mol Cell 2004; 14 : 457–64. 6. Huang B, Johansson MJ, Bystrom AS. An early step in wobble uridine tRNA modification requires the Elongator complex. RNA 2005; 11 : 424–36. 7. Rahl PB, Chen CZ, Collins RN. Elp1p, the yeast homolog of the FD disease syndrome protein, negatively regulates exocytosis independently of transcriptional elongation. Mol Cell 2005; 17 : 841–53. 8. Creppe C, Malinouskaya L, Volvert ML, et al. Elongator controls the migration and differentiation of cortical neurons through acetylation of alpha-tubulin. Cell 2009; 136 : 551–64. 9. Dompierre JP, Godin JD, Charrin BC, et al. Histone deacetylase 6 inhibition compensates for the transport deficit in Huntington’s disease by increasing tubulin acetylation. J Neurosci 2007; 27 : 3571–83. 10. Reed NA, Cai D, Blasius TL, et al. Microtubule acetylation promotes kinesin-1 binding and transport. Curr Biol 2006; 16 : 2166–72. 11. Millecamps S, Julien JP. Dysfunction of axonal transport in neuropathies and motor neuron diseases. Med Sci (Paris) 2008; 24 : 65–71. |