| |
| Med Sci (Paris). 2010 February; 26(2): 177–184. Published online 2010 February 15. doi: 10.1051/medsci/2010262177.Les protéines à domaine patatine Une nouvelle famille de régulateurs du métabolisme lipidique Sylvain Baulande1* and Clotilde Langlois2 1PartnerChip - CEA, Bâtiment G2, 2, rue Gaston Crémieux, 91000 Évry, France 2Recherche et Développement, Laboratoire PiLeJe, 37, quai de Grenelle, 75015 Paris, France |
Identification des enzymes à domaine patatine Les lipides ont des rôles essentiels et multiples dans les cellules, que ce soit dans le maintien des structures intracellulaires et le transport vésiculaire, la régulation de l’équilibre énergétique et la génération de seconds messagers participant à des mécanismes de signalisation cellulaire. Ces dernières années, la découverte de l’ATGL (adipose triglyceride lipase) et de l’adiponutrine, deux protéines adipocytaires, a permis d’identifier une nouvelle famille d’enzymes intervenant dans le métabolisme lipidique et ayant un domaine enzymatique commun appelé patatine ou PNPLA. La mise en évidence de ces nouvelles enzymes dotées d’activités lipase/transacylase met en lumière de nouveaux mécanismes de la régulation du métabolisme lipidique d’importance fondamentale chez les organismes supérieurs. Les patatines sont les premiers membres de cette famille dont on a exploré les activités enzymatiques. Ces glycoprotéines vacuolaires, considérées comme des protéines de stockage, représentent à elles seules près de 40 % de l’ensemble des protéines solubles des tubercules de pomme de terre. Des activités acylhydrolases et acyltransférases leur ont été attribuées, leur conférant un rôle dans le métabolisme lipidique [
1,
2,
45] (→). Ces activités s’exercent sur une large gamme de substrats lipidiques tels que les phospholipides, les glycolipides, les sulfolipides ou encore les mono-acylglycérols [1,
3]. Plus récemment, l’activité hydrolase, et plus particulièrement galactolipasique des patatines, a été impliquée dans des mécanismes de défense des plantes contre les agressions de pathogènes [
4].
(→) voir l’article de T. Heitz, p. 128 de ce numéro
|
Structure du domaine patatine, conservation et phylogénétique L’analyse phylogénétique révèle des homologies de séquence avec les patatines dans une grande majorité d’organismes vivants. Ces homologies sont concentrées dans une région d’environ 180 acides aminés baptisée domaine patatine ou PNPLA. Toutes les protéines comportant ce domaine partagent des motifs protéiques hautement conservés dont celui des sérines actives des lipases (motifs Gly-X-Ser-X-Gly ou GXSXG, voir Figure 1)1. À la différence de la majorité des lipases qui se caractérisent par un site catalytique en triade, les protéines à domaine PNPLA se rapprochent des phospholipases A2 cytosoliques (cPLA2), seules lipases disposant d’une simple dyade pour exercer leur activité enzymatique. Un résidu aspartate strictement conservé (motif Asp-X-Gly/Ala ou DXG/A, voir Figure 1) constitue avec la sérine cette dyade catalytique. L’implication directe de cette dyade dans l’activité enzymatique de la patatine a été mise en évidence par mutagenèse dirigée [
5,
6]. De plus, des études cristallographiques ont permis d’élucider la structure tridimensionnelle de la patatine confirmant la présence de ces résidus au cœur du site actif (Figure 2) [6]. La protéine présente un repliement de type α/β hydrolase de topologie inédite composée de six feuillets β entourés d’hélices α (repliement α/β/α) qui n’est en rien comparable avec ceux classiquement retrouvés dans les lipases [6], ce qui atteste ainsi de la singularité de cette nouvelle famille enzymatique.
 | Figure 1.
Alignement multiple de domaines patatines (PNPLA). Ces domaines sont retrouvés universellement dans l’ensemble du vivant, des bactéries et des virus jusqu’aux plantes et aux mammifères supérieurs (http://pfam.sanger.ac.uk/family ?acc=PF01734). Les acides aminés les plus conservés sont indiqués en gris. Les motifs GXSXG et DXG/A sont encadrés en rouge et les résidus de la dyade catalytique surlignés en bleu. Le motif correspondant au trou de l’oxyanion (GXGXXG) est lui aussi encadré en rouge. L’alignement multiple a été réalisé à l’aide de l’outil ClustalW (http://www.ebi.ac.uk/Tools/clustalw2/index.html). Hs : Homo sapiens, Mm : Mus musculus, Dm : Drosophila melanogaster, Ce : Caenorhabditis elegans, At : Arabidopsis thaliana, Sc : Solanum cardiophylum, Ec : Escherichia coli. |
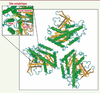 | Figure 2.
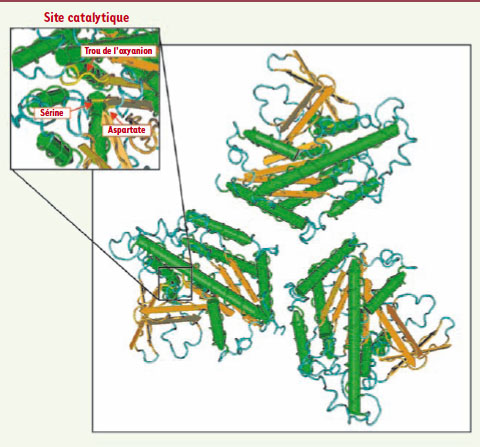
Structure tridimensionnelle de la patatine de pomme de terre Pat17. ( http://www.ncbi.nlm.nih.gov/Structure/mmdb/mmdbsrv.cgi ?uid=23126). Le repliement est de type α/β/α où l’on observe au centre une série de six feuillets β parallèles en brun, encadrés par des hélices α (en vert). Le site catalytique est représenté dans l’encart en haut à gauche permettant la visualisation des résidus de la dyade catalytique ainsi que les résidus composant le trou de l’oxyanion (en jaune indiqués par les flèches rouges) (d’après [ 6]). |
|
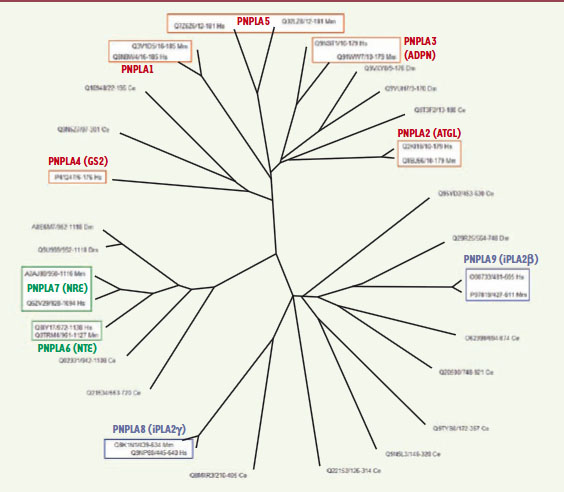
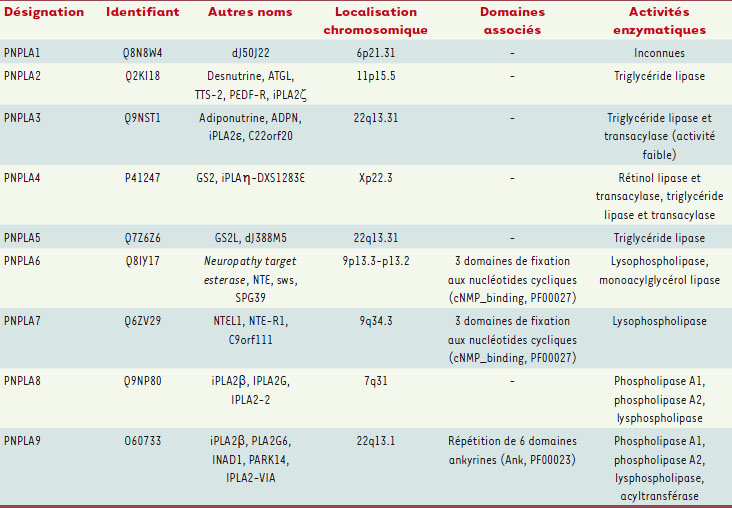
Les protéines à domaine PNPLA chez les mammifères L’analyse phylogénétique des protéines à domaine PNPLA permet de répertorier six sous-familles chez les êtres vivants [
7] dont seulement trois sont représentées chez les animaux (Figure 3). On distingue le groupe des phospholipases A2 calcium-indépendantes iPLA2β et γ (PNPLA 8 et 9), celui des neuropathy target esterase (PNPLA 6 et 7) et enfin un groupe majoritaire contenant cinq membres (PNPLA 1 à 5) dont font partie l’adiponutrine et la desnutrine/ATGL (Tableau 1). L’appartenance des iPLA2 β et γ à la superfamille des phospholipases A2 (PLA2) définie par E.A. Dennis a conduit à l’assimilation abusive de l’ensemble des PNPLA dans cette classification [
8]. Cependant, alors que les iPLA2 présentent une activité PLA2 indiscutable, il n’en est pas de même pour tous les membres de la famille patatine [
9]. Ainsi, il apparaît plus adéquat de les considérer comme une famille indépendante.
 | Figure 3.
Arbre phylogénétique des domaines patatines. Toutes les protéines codées par quatre génomes animaux distincts sont représentées : l’homme (Hs), la souris (Mm), la drosophile (Dm) et le nématode Caenorhabditis elegans (Ce). Le génome humain code pour neuf protéines PNPLA alors que le génome de la souris n’en contient que huit. On observe trois sous-familles : celle de l’adiponutrine (PNPLA1-5, en rouge), celle des neuropathy target esterases (PNPLA6-7, en vert) et celle des iPLA2 (PNPLA8-9, en bleu). |
 | Tableau I.
Description des neuf PNPLA humaines et activités enzymatiques associées.
|
La suite de cette synthèse fait le point sur nos connaissances de ces différentes sous-familles dotées de spécificités fonctionnelles bien distinctes [
10]. La sous-famille des phospholipases A2 calcium-indépendantes (iPLA2 β et γ) Les iPLA 2 sont capables d’hydrolyser les acides gras en position sn-2 des phospholipides. La spécificité de ces enzymes réside dans le fait que leur activité n’est pas dépendante de la présence de calcium, à la différence des autres PLA 2. Outre leur activité phospholipase A 2, elles présentent des activités de type phospholipases A 1, lysophospholipases et phospholipide/transacylases [
11,
12]. L’iPLA2β (PNPLA9) est la première des iPLA2 à avoir été identifiée chez les mammifères. Elle est exprimée de manière quasi-ubiquitaire chez l’homme et la souris avec une expression très marquée dans les testicules et le cerveau [
13]. La protéine présente une localisation cytoplasmique et elle peut, une fois activée, être relocalisée vers des structures membranaires périnucléaires [
14]. Son implication dans les fonctions cellulaires est très large et inclut, outre le remodelage des phospholipides membranaires, la transduction de signaux, la prolifération cellulaire et l’apoptose [14]. L’invalidation du gène codant cette enzyme chez la souris conduit à une diminution de la fertilité chez les mâles [
15], mais surtout à une diminution de la tolérance au glucose due à un défaut de sécrétion de l’insuline par les îlots β du pancréas [
16]. À l’inverse, la surexpression de l’iPLA2β chez la souris induit une augmentation de la sécrétion d’insuline, mais elle a aussi d’autres conséquences : une diminution de la masse osseuse due à une adipogenèse accrue dans la moelle osseuse au détriment de l’ostéogenèse [
17] et des dysfonctionnements neurologiques, conséquence d’une perturbation de l’homéostasie des membranes lipidiques axonales [
18]. Très récemment, des mutations dans le gène codant l’iPLA2β ont été identifiées dans deux pathologies neurodégénératives infantiles illustrant son rôle fondamental dans le développement neuronal chez l’homme2 [
19]. L’iPLA2γ, quant à elle, présente une expression majoritairement cardiaque chez l’homme [
20], tissu au sein duquel la protéine est associée aux mitochondries et aux peroxysomes. Elle s’avère capable d’hydrolyser les phospholipides saturés ou mono-insaturés, qu’ils soient en position sn-1 ou bien sn-2 [13]. L’importance de cette enzyme dans l’homéostasie phospholipidique des cellules cardiaques ainsi que dans la fonction mitochondriale a été mise en évidence par des études de perte et de gain de fonction chez la souris [
21,
22]. Notamment, le contenu en cardiolipines (phospholipides spécifiques des membranes mitochondriales des cellules du myocarde) s’avère très perturbé chez les souris knock-out pour l’iPLA2γ entraînant des défauts de fonctionnement de la chaîne respiratoire, ce qui indique son implication dans le remodelage des membranes phospholipidiques mitochondriales [21]. La sous-famille des lysophospholipases de type neuropathy target esterase
Les deux membres de cette famille ont eux aussi pour substrats des phospholipides mais ils ciblent préférentiellement les lysophospholipides et ne présentent qu’une très faible activité PLA 2. La neuropathy target esterase (NTE ou PNPLA6) est majoritairement exprimée dans le système nerveux central chez la souris [
23] où elle est localisée dans le réticulum endoplasmique et l’appareil de Golgi des cellules [
24]. La NTE a initialement été identifiée comme l’enzyme cible inhibée par les pesticides de la famille des organophosphorés, fonction mise en évidence lors d’un empoisonnement par ces composés [23]. Ces composés entraînent des troubles neurologiques sévères chez les vertébrés, connus sous le nom de neuropathie retardée induite par les organophosphorés (organophosphate-induced delayed neurotoxicity, OPIDN). Ils sont la conséquence d’une dégénérescence des axones longs de la moelle épinière et des nerfs périphériques. Chez la souris, si la délétion du gène est létale dès le stade embryonnaire [23], une invalidation ciblée du gène NTE dans les tissus neuronaux adultes entraîne des désordres neurologiques sévères associés à une déstructuration du réticulum endoplasmique, une vacuolisation des corps neuronaux et la présence d’agrégats réticulaires [
25]. Chez l’homme, des mutations du gène dans les séquences codant le site catalytique entraînent une paraplégie spastique progressive et une fonte musculaire distale [
26]. L’activité lysophospholipase de la NTE envers ses substrats, dont les lysophosphatidylcholines membranaires, a donc un rôle majeur dans le maintien de l’intégrité des axones. La NRE (NTE-related esterase), très similaire à la NTE, est exprimée dans de nombreux tissus et notamment des tissus sensibles à l’insuline, comme les muscles squelettiques, le cœur et le tissu adipeux [
27]. Induite au cours de la différenciation adipocytaire ainsi que lors du jeûne, l’expression du gène est sous le contrôle de l’état nutritionnel, et notamment de l’insuline qui l’inhibe. Au niveau subcellulaire, la protéine est associée au réticulum endoplasmique et aux gouttelettes lipidiques [27]. La NRE présente elle aussi une activité de type lysophospholipase sans qu’aucune autre activité lipase n’ait pu être mise en évidence sur les phospholipides ou les mono- et triglycérides. Cette nouvelle enzyme est donc considérée comme une lysophospholipase insulinosensible. La sous-famille des acylglycérols lipases/transacylases Ce groupe constitué de cinq membres chez les mammifères (PNPLA1 à 5) est encore mal connu. Les découvertes récentes portant notamment sur l’adiponutrine (PNPLA3) et l’ATGL (PNPLA2) tendent à démontrer une implication de ces protéines dans le métabolisme des glycérolipides et non des phospholipides, contrairement aux fonctions des deux groupes précédents. PNPLA1, 4 et 5 Aucune information sur la relevance fonctionnelle physiologique de PNPLA1 n’a pu être apportée jusqu’à présent, l’expression du gène étant extrêmement faible dans tous les tissus testés [
28,
29]. Cette observation est renforcée par le très faible nombre d’EST ( expressed sequence tag) trouvé dans les banques de séquences. Le gène codant pour GS2 (PNPLA4) est absent chez la souris mais présent chez l’homme et le rat. Il est fortement exprimé dans nombre de tissus actifs sur le plan métabolique comme le tissu adipeux, le muscle cardiaque, le foie et la peau [28, 29]. Des travaux menés sur les kératinocytes humains ont permis la mise en évidence des activités rétinol lipase et transacylase susceptibles de participer à la morphogenèse de l’épiderme [
30]. Des activités triglycérides lipase/transacylase ont aussi été attribuées à GS2 [10, 30]. Le gène GS2-like (codant PNPLA5) est localisé à proximité du gène de l’adiponutrine suggérant une duplication ancestrale. Bien que faible, son expression est néanmoins détectée dans de nombreux tissus comme les poumons, les tissus adipeux et le cerveau [28, 29]. Induite au cours de la différenciation adipocytaire chez la souris, cette expression est très sensible à l’état nutritionnel : dans le tissu adipeux, la prise alimentaire la stimule et le jeûne la réprime. Au niveau fonctionnel, son activité triglycéride lipase a pu être identifiée, et la surexpression du gène in vitro induit une baisse du contenu cellulaire en triglycérides [29]. Adiponutrine L’adiponutrine (PNPLA3) est le premier gène de ce groupe à avoir été caractérisé [
31]. Chez la souris, l’expression du gène est presque exclusivement restreinte à l’adipocyte alors que chez l’homme, on la détecte aussi dans le foie et les muscles squelettiques [ 28]. Les conditions nutritionnelles dans le tissu adipeux contrôlent l’expression de l’adiponutrine qui est induite au cours de la différenciation adipocytaire. Indétectable à jeun, elle est très fortement augmentée après une prise alimentaire [ 31]. L’insuline et le glucose induisent l’expression de l’adiponutrine [
32] qui est surexprimée dans des modèles murins d’obésité [ 31] ainsi que chez des patients obèses ou insulinorésistants [ 32]. La protéine est localisée au niveau des structures membranaires du cytoplasme comme l’appareil de Golgi ou le réticulum endoplasmique, site principal de synthèse des lipides dans les cellules de mammifères [ 31]. La caractérisation de son activité enzymatique est encore imprécise. Dans des systèmes in vitro, la protéine purifiée présente des activités modérées de type triglycéride lipase et transacylase [ 10, 29]. Cependant, dans un contexte cellulaire, ces activités apparaissent mineures [ 29, 30]. Des expériences de surexpression et de perturbation de l’expression du gène par ARN interférence n’indiquent qu’un très modeste effet sur la lipolyse ou le contenu en triglycérides [ 29,
33]. Très récemment, une étude d’association génétique a mis en évidence un lien entre la quantité de triglycérides hépatiques et des variants génétiques de l’adiponutrine, faisant de ce gène un facteur génétique majeur associé à la stéatosique hépatique non alcoolique et à ses complications inflammatoires [
34–
37]. Il est intéressant de remarquer qu’une surexpression de l’adiponutrine est observée dans le foie stéatosique de souris ob/ob [ 29] et que son expression hépatique chez l’homme est positivement corrélée au contenu en triglycérides hépatiques [ 37]. L’adiponutrine est donc encore loin d’avoir livré sa véritable identité fonctionnelle, néanmoins son implication dans le métabolisme des triglycérides se précise. L’adipose triglyceride lipase (ATGL, PNPLA2) C’est une enzyme majeure du métabolisme lipidique impliquée dans la lipolyse cellulaire et qui, depuis sa découverte en 2004 par trois équipes indépendantes [ 10,
38,
39], fait l’objet de très nombreuses investigations. Elle est localisée au niveau des gouttelettes lipidiques où elle peut hydrolyser les triglycérides. L’expression de l’ARN du messager de l’ATGL est induite précocement durant la différenciation adipocytaire et est majoritairement retrouvée dans le tissu adipeux, mais aussi à un niveau plus faible dans d’autres tissus comme le cœur et les testicules [ 38, 39]. À l’inverse de l’adiponutrine, le niveau de l’ARN du messager de l’ATGL est augmenté par le jeûne et diminué par la réalimentation. L’expression de l’ATGL est inhibée par l’insuline dans des modèles murins d’obésité et est augmentée dans le tissu adipeux de souris présentant un défaut d’action de l’insuline [ 33,
40]. L’ATGL intervient dans la première étape d’hydrolyse des triglycérides stockés dans les gouttelettes lipidiques pour produire les diglycérides, substrat de l’ hormone sensitive lipase (HSL) [ 38]. Un double déficit en HSL et en ATGL provoque la perte de 90 % de l’activité acylhydrolase, démontrant ainsi que ces deux enzymes sont les principales lipases en charge de la lipolyse. Ainsi, une accumulation de lipides dans le tissu adipeux blanc et brun ainsi que dans d’autres tissus non adipeux est retrouvée chez la souris invalidée pour l’ATGL, avec une accumulation plus importante au niveau du cœur, provoquant de sérieuses complications de type cardiomyopathies chez ces animaux [
41]. Chez l’homme, des mutations du gène sont responsables d’une myopathie liée à un excès de lipides neutres dans les muscles squelettiques et le cœur [
42,
43]. Une association génétique entre des polymorphismes de l’ATGL et une augmentation de la glycémie à jeun a été mise en évidence, constituant un facteur de risque potentiel dans la survenue du diabète de type 2 [
44]. L’ATGL s’impose donc comme une enzyme incontournable de la régulation de l’équilibre énergétique de l’organisme par son rôle clé dans l’hydrolyse des triglycérides cellulaires. |
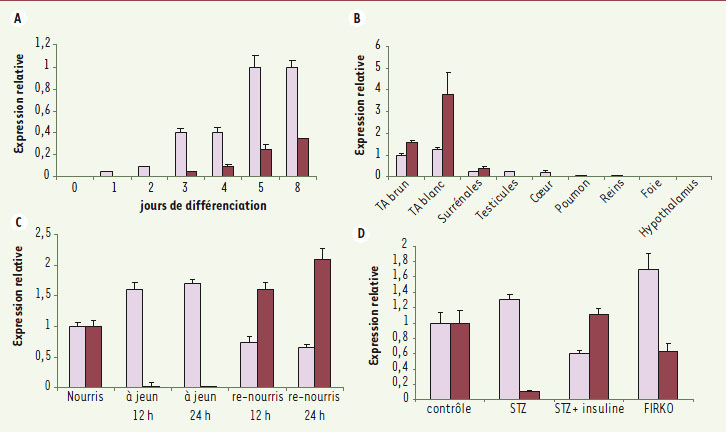
L’adiponutrine et l’ATGL : une dualité fonctionnelle dans le tissu adipeux Bien qu’étant deux membres très homologues de la famille des PNPLA, l’ATGL et l’adiponutrine ont des caractéristiques très souvent opposables (Figure 4). Toutes deux sont exprimées majoritairement dans le tissu adipeux et assez précocement au cours de la différenciation adipocytaire. Mais alors que l’adiponutrine est fortement exprimée en période d’abondance énergétique, l’ATGL l’est en période de jeûne. L’obésité est associée à une surexpression de l’adiponutrine mais à une diminution de l’ATGL. Leur localisation subcellulaire diffère elle aussi car l’adiponutrine est une protéine membranaire, localisée vraisemblablement au niveau du réticulum endoplasmique, du Golgi et de compartiments vésiculaires, alors que l’ATGL est plutôt cytosolique et localisée au niveau des gouttelettes lipidiques. La fonction lipolytique de l’ATGL est en parfaite adéquation avec la régulation de son expression, ce qui suggère une implication catabolique. À l’inverse, la régulation de l’adiponutrine indique un rôle plutôt de type anabolique et donc en faveur de la lipogenèse. Même si les informations relatives à la fonction biologique de l’adiponutrine restent encore imprécises, il apparaît raisonnable de proposer qu’elle puisse participer à la synthèse des triglycérides par des mécanismes comme par exemple le transfert d’acides gras (transacylation). La dualité fonctionnelle vis-à-vis du métabolisme des triglycérides entre adiponutrine et ATGL, pourtant si proches par leurs séquences, illustre bien la diversification fonctionnelle des protéines qui s’opère au cours de l’évolution.
 | Figure 4.
Expression relative de l’ATGL ( ) et de l’adiponutrine ( ) et de l’adiponutrine ( ). ). Les expressions des transcrits sont mesurées : A. au cours de la différenciation adipocytaire de cellules 3T3-L1. B. Dans un panel des principaux tissus de souris C57BL/6. C. Dans le tissu adipeux blanc périgonadal de souris C57BL/6 en fonction de l’état nutritionnel. D. Dans le tissu adipeux blanc périgonadal de modèles métaboliques murins. L’expression a été déterminée par PCR quantitative et normalisée par l’ARN 18S. TA : tissu adipeux ; STZ : streptozotocine ; FIRKO : fat specific insulin receptor knock-out (d’après [ 32]). |
|
La découverte puis l’identification des fonctions de certaines protéines arborant un domaine patatine (PNPLA) révèlent le rôle fondamental de cette nouvelle famille de lipases/transacylases dans le contrôle de l’homéostasie lipidique et énergétique des organismes supérieurs. Si certains membres sont particulièrement bien caractérisés et se révèlent d’une importance majeure sur le plan physiopathologique et clinique, d’autres au contraire demeurent très peu connus. Nul doute que dans les années à venir, de nouveaux travaux de génomique fonctionnelle enrichiront nos connaissances du rôle de ces enzymes et de leurs différentes implications dans la physiologie cellulaire, la régulation de l’équilibre lipidique de l’organisme mais aussi bien sûr en clinique humaine. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Andrews DL, Beames B, Summers MD, Park W. Characterization of the lipid acyl hydrolase activity of the major potato (Solanum tuberosum) tuber protein, patatin, by cloning and abundant expression in a baculovirus vector. Biochem J 1988; 252 : 199–206. 2. Racusen D. Lipid acyl hydrolase of patatin. Can J Bot 1984; 62 : 1640–4. 3. Senda K, Yoshioka H, Doke N, Kawakita K. A cytosolic phospholipase A2 from potato tissues appears to be patatin. Plant Cell Physiol 1996; 37 : 347–53. 4. Dhondt S, Geoffroy P, Stelmach BA, et al. Soluble phospholipase A2 activity is induced before oxylipin accumulation in tobacco mosaic virus-infected tobacco leaves and is contributed by patatin-like enzymes. Plant J 2000; 23 : 431–40. 5. Hirschberg HJ, Simons JW, Dekker N, Egmond MR. Cloning, expression, purification and characterization of patatin, a novel phospholipase A. Eur J Biochem 2001; 268 : 5037–44. 6. Rydel TJ, Williams JM, Krieger E, et al. The crystal structure, mutagenesis, and activity studies reveal that patatin is a lipid acyl hydrolase with a Ser-Asp catalytic dyad. Biochemistry 2003; 42 : 6696–708. 7. Smirnova E, Goldberg EB, Makarova KS, et al. ATGL has a key role in lipid droplet/adiposome degradation in mammalian cells. EMBO Rep 2006; 7: 106–13. 8. Schaloske RH, Dennis EA. The phospholipase A2 superfamily and its group numbering system. Biochim Biophys Acta 2006; 1761 : 1246–59. 9. Jenkins CM, Mancuso DJ, Yan W, et al. Identification, cloning, expression, and purification of three novel human calcium-independent phospholipase A2 family members possessing triacylglycerol lipase and acylglycerol transacylase activities. J Biol Chem 2004; 279 : 48968–75. 10. Kienesberger PC, Oberer M, Lass A, Zechner R. Mammalian patatin domain containing proteins: a family with diverse lipolytic activities involved in multiple biological functions. J Lipid Res 2009; 50 : S63–8. 11. Lio YC, Dennis EA. Interfacial activation, lysophospholipase and transacylase activity of group VI Ca2+-independent phospholipase A2. Biochim Biophys Acta 1998; 1392 : 320–32. 12. Yan W, Jenkins CM, Han X, et al. The highly selective production of 2-arachidonoyl lysophosphatidylcholine catalyzed by purified calcium-independent phospholipase A2gamma: identification of a novel enzymatic mediator for the generation of a key branch point intermediate in eicosanoid signaling. J Biol Chem 2005; 280 : 26669–79. 13. Ma Z, Turk J. The molecular biology of the group VIA Ca2+-independent phospholipase A2. Prog Nucleic Acid Res Mol Biol 2001; 67 : 1–33. 14. Turk J, Ramanadham S. The expression and function of a group VIA calcium-independent phospholipase A2 (iPLA2beta) in beta-cells. Can J Physiol Pharmacol 2004; 82 : 824–32. 15. Bao S, Miller DJ, Ma Z, et al. Male mice that do not express group VIA phospholipase A2 produce spermatozoa with impaired motility and have greatly reduced fertility. J Biol Chem 2004; 279 : 38194–200. 16. Bao S, Jacobson DA, Wohltmann M, et al. Glucose homeostasis, insulin secretion, and islet phospholipids in mice that overexpress iPLA2beta in pancreatic beta-cells and in iPLA2beta-null mice. Am J Physiol Endocrinol Metab 2008; 294 : E217–29. 17. Ramanadham S, Yarasheski KE, Silva MJ, et al. Age-related changes in bone morphology are accelerated in group VIA phospholipase A2 (iPLA2beta)-null mice. Am J Pathol 2008; 172 : 868–81. 18. Malik I, Turk J, Mancuso DJ, et al. Disrupted membrane homeostasis and accumulation of ubiquitinated proteins in a mouse model of infantile neuroaxonal dystrophy caused by PLA2G6 mutations. Am J Pathol 2008; 172 : 406–16. 19. Gregory A, Westaway SK, Holm IE, et al. Neurodegeneration associated with genetic defects in phospholipase A(2). Neurology 2008; 71 : 1402–9. 20. Mancuso DJ, Jenkins CM, Gross RW. The genomic organization, complete mRNA sequence, cloning, and expression of a novel human intracellular membrane-associated calcium-independent phospholipase A(2). J Biol Chem 2000; 275 : 9937–45. 21. Mancuso DJ, Sims HF, Han X, et al. Genetic ablation of calcium-independent phospholipase A2gamma leads to alterations in mitochondrial lipid metabolism and function resulting in a deficient mitochondrial bioenergetic phenotype. J Biol Chem 2007; 282 : 34611–22. 22. Mancuso DJ, Han X, Jenkins CM,et al. Dramatic accumulation of triglycerides and precipitation of cardiac hemodynamic dysfunction during brief caloric restriction in transgenic myocardium expressing human calcium-independent phospholipase A2gamma. J Biol Chem 2007; 282 : 9216–27. 23. Winrow CJ, Hemming ML, Allen DM, et al. Loss of neuropathy target esterase in mice links organophosphate exposure to hyperactivity. Nat Genet 2003; 33 : 477–85. 24. Van Tienhoven M, Atkins J, Li Y, Glynn P. Human neuropathy target esterase catalyzes hydrolysis of membrane lipids. J Biol Chem 2002; 277 : 20942–8. 25. Akassoglou K, Malester B, Xu J, et al. Brain-specific deletion of neuropathy target esterase/swisscheese results in neurodegeneration. Proc Natl Acad Sci USA 2004; 101 : 5075–80. 26. Rainier S, Bui M, Mark E, et al. Neuropathy target esterase gene mutations cause motor neuron disease. Am J Hum Genet 2008; 82 : 780–5. 27. Kienesberger PC, Lass A, Preiss-Landl K, et al. Identification of an insulin-regulated lysophospholipase with homology to neuropathy target esterase. J Biol Chem 2008; 283 : 5908–17. 28. Wilson PA, Gardner SD, Lambie NM, et al. Characterization of the human patatin-like phospholipase family. J Lipid Res 2006; 47 : 1940–9. 29. Lake AC, Sun Y, Li JL, et al. Expression, regulation, and triglyceride hydrolase activity of Adiponutrin family members. J Lipid Res 2005; 46 : 2477–87. 30. Gao JG, Simon M. A comparative study of human GS2, its paralogues, and its rat orthologue. Biochem Biophys Res Commun 2007; 360 : 501–6. 31. Baulande S, Lasnier F, Lucas M, Pairault J. Adiponutrin, a transmembrane protein corresponding to a novel dietary- and obesity-linked mRNA specifically expressed in the adipose lineage. J Biol Chem 2001; 276 : 33336–44. 32. Moldes M, Beauregard G, Faraj M, et al. Adiponutrin gene is regulated by insulin and glucose in human adipose tissue. Eur J Endocrinol 2006; 155 : 461–8. 33. Kershaw EE, Hamm JK, Verhagen LA, et al. Adipose triglyceride lipase: function, regulation by insulin, and comparison with adiponutrin. Diabetes 2006; 55 : 148–57. 34. Romeo S, Kozlitina J, Xing C, et al. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nat Genet 2008; 40 : 1461–5. 35. Yuan X, Waterworth D, Perry JR, et al. Population-based genome-wide association studies reveal six loci influencing plasma levels of liver enzymes. Am J Hum Genet 2008; 83 : 520–8. 36. Baulande S. Polymorphisms in adiponutrin gene and association to hepatic steatosis. Med Sci (Paris) 2009; 25 : 130–2. 37. Kotronen A, Johansson LE, Johansson LM, et al. A common variant in PNPLA3, which encodes adiponutrin, is associated with liver fat content in humans. Diabetologia 2009; 52 : 1056–60. 38. Zimmermann R, Strauss JG, Haemmerle G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science 2004; 306 : 1383–6. 39. Villena JA, Roy S, Sarkadi-Nagy E, et al. Desnutrin, an adipocyte gene encoding a novel patatin domain-containing protein, is induced by fasting and glucocorticoids: ectopic expression of desnutrin increases triglyceride hydrolysis. J Biol Chem 2004; 279 : 47066–75. 40. Kim JY, Tillison K, Lee JH, et al. The adipose tissue triglyceride lipase ATGL/PNPLA2 is downregulated by insulin and TNF-alpha in 3T3-L1 adipocytes and is a target for transactivation by PPARgamma. Am J Physiol Endocrinol Metab 2006; 291 : E115–27. 41. Haemmerle G, Lass A, Zimmermann R, et al. Defective lipolysis and altered energy metabolism in mice lacking adipose triglyceride lipase. Science 2006; 312 : 734–7. 42. Fischer J, Lefèvre C, Morava E, et al. The gene encoding adipose triglyceride lipase (PNPLA2) is mutated in neutral lipid storage disease with myopathy. Nat Genet 2007; 39 : 28–30. 43. Fischer J, Negre-Salvayre A, Salvayre R. Neutral lipid storage diseases and ATGL (adipose triglyceride lipase) and CGI-58/ABHD5 (alpha-beta hydrolase domain-containing 5) deficiency: myopathy, ichthyosis, but no obesity. Med Sci (Paris) 2007; 23 : 575–8. 44. Schoenborn V, Heid IM, Vollmert C, et al. The ATGL gene is associated with free fatty acids, triglycerides, and type 2 diabetes. Diabetes 2006; 55 : 1270–5. 45. Heitz T. Les multiples fonctions des protéines lipolytiques à domaine patatine. Med Sci (Paris) 2010; 26 : 128–9. |



 ) et de l’adiponutrine (
) et de l’adiponutrine ( ). Les expressions des transcrits sont mesurées : A. au cours de la différenciation adipocytaire de cellules 3T3-L1. B. Dans un panel des principaux tissus de souris C57BL/6. C. Dans le tissu adipeux blanc périgonadal de souris C57BL/6 en fonction de l’état nutritionnel. D. Dans le tissu adipeux blanc périgonadal de modèles métaboliques murins. L’expression a été déterminée par PCR quantitative et normalisée par l’ARN 18S. TA : tissu adipeux ; STZ : streptozotocine ; FIRKO : fat specific insulin receptor knock-out (d’après [
). Les expressions des transcrits sont mesurées : A. au cours de la différenciation adipocytaire de cellules 3T3-L1. B. Dans un panel des principaux tissus de souris C57BL/6. C. Dans le tissu adipeux blanc périgonadal de souris C57BL/6 en fonction de l’état nutritionnel. D. Dans le tissu adipeux blanc périgonadal de modèles métaboliques murins. L’expression a été déterminée par PCR quantitative et normalisée par l’ARN 18S. TA : tissu adipeux ; STZ : streptozotocine ; FIRKO : fat specific insulin receptor knock-out (d’après [