| |
| Med Sci (Paris). 2010 March; 26(3): 291–296. Published online 2010 March 15. doi: 10.1051/medsci/2010263291.Un virus tapi dans l’ombre : les bases moléculaires de la latence du VIH-1 Partie II : la réactivation de la latence du VIH-1 et ses implications thérapeutiques Thomas Cherrier,1 Valentin Le Douce,1 Lætitia Redel,1 Céline Marban,1 Dominique Aunis,1 Olivier Rohr,1,2 and Christian Schwartz1,2* 1Inserm Unité 575 Physiopathologie du système nerveux central, Institut de virologie, 3, rue Koeberlé, 67000 Strasbourg, France 2IUT Louis Pasteur de Schiltigheim, 1, allée d’Athènes, 67300 Schiltigheim, France |
L’introduction de la multithérapie active (HAART, highly active antiretroviral treatment) avait auguré des lendemains meilleurs pour les personnes infectées par le VIH-1 (virus de l’immunodéficience humaine) dans la mesure où l’éradication du virus était sérieusement envisagée. Malheureusement, il est vite apparu que le VIH-1 subsistait à l’état latent dans des cellules réservoirs, le rendant inaccessible au système immunitaire et aux nombreuses associations de drogues antivirales. Les phénomènes de virémie résiduelle, ainsi que les rebonds de la virémie lors de l’interruption de la multithérapie active, sont à mettre en relation avec la possible réactivation du virus intégré sous forme latente. Une compréhension fine de ces mécanismes permettra la mise au point de stratégies originales de purge de réservoirs qui, associées à un renforcement de la HAART, entretiennent à nouveau l’espoir d’éradiquer le VIH-1 et ainsi de juguler cette pandémie. L’existence de réservoirs viraux a donc de profondes implications en termes de stratégies thérapeutiques, mais d’autres éléments sont à prendre en compte pour se débarrasser du virus. Ainsi, la présence de cellules infectées dans des lieux inaccessibles (dénommés sanctuaires) aux drogues actuellement utilisées et l’existence de cellules infectées de manière chronique seront à prendre en considération en vue de développer des stratégies thérapeutiques efficaces. |
La réactivation du provirus intégré à l’état latent est induite par de nombreux facteurs, incluant des cytokines (interleukine (IL)-1β, IL-6 et TNF-α, tumor necrosis factor), des anticorps (anti-CD3) et des agents mitogènes (PMA, phorbol 12-myristate 13-acetate et prostratine) [
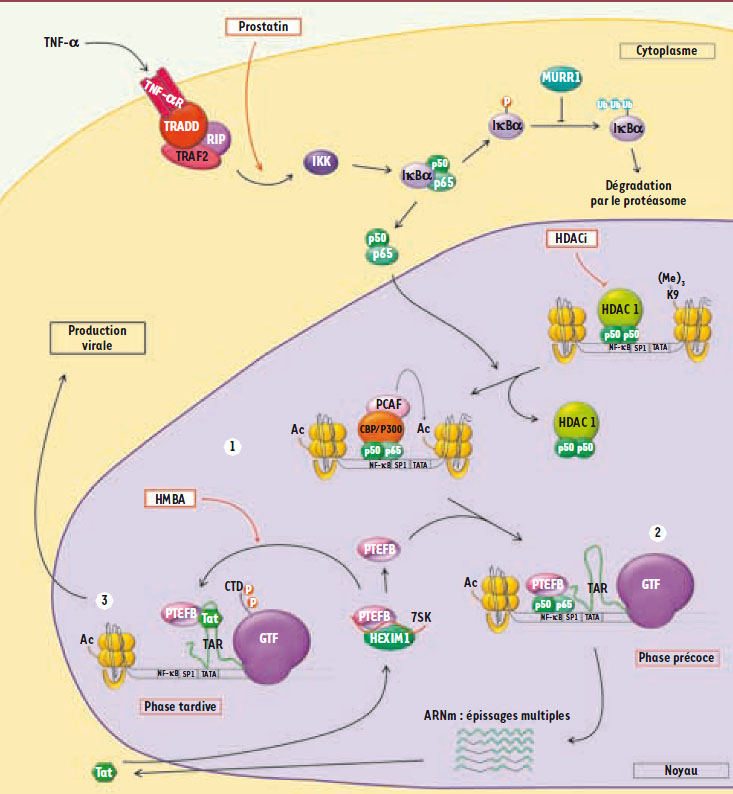
1]. Dans les lymphocytes T, et très probablement dans les cellules microgliales, ces stimulus externes induisent des voies de signalisation cellulaire qui activent des facteurs de transcription comme NF-κB, AP1 et NF-AT (Figure 1). Ces facteurs peuvent alors se fixer sur des régions spécifiques, localisées dans le LTR (long terminal repeat) et recruter les différents acteurs intervenant dans l’ouverture de la chromatine, donnant ainsi l’accès à la machinerie transcriptionnelle de base et aux facteurs généraux de la transcription. Parmi les acteurs recrutés, il y a des protéines à activité acétyltransférase qui modifient post-traductionnellement les histones H3 et H4 du nucléosome nuc1 et ainsi réorganisent la structure chromatinienne au niveau du site d’initiation de la transcription. Le facteur NF-κB intervient aussi au niveau de l’élongation assurée par l’ARN polymérase II en recrutant notamment le complexe P-TEFb (positive transcription elongation factor b). Cette phase précoce de la transcription aboutit à l’élaboration de nombreux ARN multi-épissés qui, une fois traduits, donnent naissance aux protéines régulatrices Nef, Rev et Tat. Une fois Tat présente, la transcription du virus est activée avec une élongation très efficace par recrutement du complexe P-TEFb, mais aussi par une intervention au niveau de l’initiation de la transcription. La meilleure activité de l’ARN polymérase II s’explique en partie par le recrutement de facteurs qui remodèlent la chromatine, comme le complexe SWI/SNF qui est ATP-dépendant. Ces facteurs agissent ainsi en altérant les relations entre ADN et histones, favorisant le glissement de ces dernières le long de l’ADN et donc facilitant l’élongation assurée par l’ARN polymérase II [
2,
3]. Le résultat de cette phase tardive de la transcription Tat-dépendante est la genèse d’ARN mono ou non épissés dont la traduction engendre les protéines de structure et les enzymes nécessaires pour reconstituer de nouvelles particules infectieuses.
 | Figure 1.
La réactivation de l’expression du VIH-1 intégré de manière latente. 1. Remodelage de la chromatine : suite à une stimulation cellulaire (via TNFα par exemple) initiant la voie de signalisation qui met en jeu le complexe transactivateur hétérodimérique p50-p65 (activité NF-κB), le dimère est transloqué dans le noyau où il se fixe sur le promoteur viral. Ce faisant, il permet le recrutement des complexes protéiques qui vont permettre l’ouverture de la chromatine (recrutement des histones, acétyl-transférases CBP/P300 et PCAF par exemple). 2. Phase précoce de la transcription, Tat indépendante : cette phase est sous la dépendance des facteurs de transcription cellulaires et aboutit à la formation d’ARN multi-épissés codant pour les protéines virales de régulation incluant Tat. 3. Phase tardive de la transcription, Tat dépendante : cette phase résulte de l’action du facteur transactivateur Tat qui recrute le complexe P-TEFb à partir d’un pool inactif (associé à la protéine HEXIM 1, hexamethylene bis-acetamide inducible 1, et à l’ARN 7SK), au niveau de la région TAR. Cette phase permet la synthèse des ARN mono et non épissés codant pour les protéines virales nécessaires à sa production. Quelques exemples de molécules, à même de réactiver l’expression du virus et donc utilisables en vue d’une stratégie de purge des réservoirs, sont représentés en rouge : activateurs de la voie de la signalisation cellulaire menant à NF-κB (prostatin), inhibiteurs des histones déacétylases (HDACi) et activateurs du complexe P-TEFb (HMBA, hexaméthylène bisacétamide). |
La séquestration et/ou la dégradation des facteurs activateurs évoqués plus haut et impliqués dans la réactivation de l’expression du VIH-1 contribuent donc au maintien de la latence virale. C’est ainsi que le gène MURR1 (mouse U2af1-rs1 region) code pour une protéine impliquée dans la séquestration cytoplasmique de NF-κB. Son mécanisme d’action passe par un effet sur le facteur IºB dont l’interaction physique avec NF-κB conduit à une séquestration de ce dernier dans le cytoplasme. La protéine MURR1 agit en inhibant la dégradation de IκB via la voie du protéasome et, par conséquent, contribue à empêcher la réactivation de l’expression du VIH-1 et favorise donc le maintien de la latence virale [
4]. Depuis quelques années, des mécanismes post-transcriptionnels sont mis à jour et contribuent au maintien de la latence virale en empêchant la réactivation du virus. Leur importance découle de la découverte d’une nouvelle modalité de l’expression des gènes : l’interférence ARN. L’importance des microARN (miARN, petits ARN de 19-25 nucléotides) dans la régulation de l’expression génique du virus a déjà été montrée [
5]. Certains miARN ont ainsi été incriminés dans la régulation de l’expression du VIH-1 via la régulation de l’expression du gène codant pour PCAF (p300/CREB-binding protein associated factor). Cette protéine, qui possède une activité acétyl-transférase, a été impliquée dans l’activation de la transcription du VIH-1 par suite d’une levée de la répression chromatinienne s’exerçant au niveau de la région promotrice du VIH-1 [
6,
7]. Par ailleurs, il a été récemment montré, par toute une série d’élégantes expériences, qu’une combinaison de plusieurs miARN cellulaires était impliquée dans le maintien de la latence du VIH-1 dans des cellules T CD4+ au repos. Ce mécanisme s’avère très important dans la mesure où, malgré tous les blocages s’exerçant au niveau transcriptionnel, des ARNm viraux ont quand même pu être mis en évidence [
8]. Des ARN multi-épissés capables de générer les protéines de régulation du VIH-1 Tat et Rev ont notamment été découverts. La première de ces protéines (Tat) est un puissant transactivateur impliqué dans l’initiation et surtout l’élongation assurée par l’ARN polymérase II, et la deuxième (Rev) intervient dans l’exportation des ARN viraux dans le cytoplasme. Les auteurs, en mettant en évidence des miARN capables de cibler les rares ARN messagers viraux synthétisés, ont découvert un nouveau mécanisme assurant le maintien de la latence virale, rajoutant ainsi un niveau à la complexité des mécanismes mis en jeu. Un ciblage par siARN des ARN messagers codant pour les enzymes impliqués dans la voie des miARN ouvre ainsi de nouvelles perspectives thérapeutiques en vue de réactiver le VIH-1 dans le cadre d’une stratégie de purge des réservoirs [
9]. |
Le problème posé par la découverte d’une virémie résiduelle Malgré une observance stricte du traitement pendant de nombreuses années, le virus est à nouveau détectable à l’arrêt du traitement, mettant ainsi à mal les prédictions des premiers modèles, basés sur la demi-vie des différents types cellulaires infectés, qui annonçaient une éradication complète du virus au bout de trois années de traitement [
10]. Deux théories sont proposées pour expliquer cette persistance virale à long terme, malgré une thérapie bien conduite et bien suivie. La première stipule que l’affection liée au VIH-1 est une infection chronique avec une réplication, certes résiduelle, et donc difficilement détectable, mais continue chez les patients bénéficiant par ailleurs de la thérapie antirétrovirale (théorie de l’infection chronique). La deuxième fait appel à la notion de latence virale qui est définie par la persistance du virus dans une cellule hôte qui n’est pas productive et, de ce fait, non accessible aux mécanismes de défense de l’organisme ainsi qu’aux drogues ayant une action antivirale (théorie de la latence). L’hypothèse de la latence virale s’est rapidement imposée mais les investigations nécessaires pour confirmer celle-ci tardaient à venir. Certains virologistes ont signalé cet état de fait, et ce à juste titre, étant donné l’importance des orientations en termes de recherche et de mise en place de stratégies thérapeutiques qui en découlent. Ils pointaient notamment du doigt les insuffisances techniques qui ne permettaient pas de mettre en évidence une réplication résiduelle chronique du virus (la limite de détection étant alors de 50 copies/ml). De fait, la mise au point de nouvelles techniques de RT-PCR ultrasensibles (capables de détecter de 1 à 5 copies/ml) combinées à des techniques d’ultracentrifugation du plasma sanguin, a permis de détecter une virémie résiduelle [
11–
13]. Le problème de l’origine de cette virémie résiduelle était à nouveau au centre des débats, et les tenants d’une réplication résiduelle chronique à nouveau sur le devant de la scène. Toutefois, des données récentes obtenues dans le laboratoire de R. F. Siliciano plaident en faveur de l’existence des réservoirs viraux latents [
14]. Ces résultats se fondent sur une analyse phylogénétique des ARN viraux détectés dans le plasma et dans les cellules infectées qui a permis de discriminer l’hypothèse la plus plausible (latence versus réplication chronique) [
15]. Il faut cependant ajouter que les études précédentes concernaient surtout les lymphocytes TCD4+ qui, bien que constituant l’une des cibles privilégiées du VIH-1, ne sont pas les seules. L’une des autres cibles majeures de ce virus est constituée par la lignée des monocytes-macrophages, pour laquelle les choses sont moins évidentes. Tout d’abord, il convient de noter qu’un deuxième réservoir latent pour le VIH-1, qui pourrait être les cellules monocytes-macrophages, a été mis en évidence chez certains patients sous traitement. En effet, la virémie résiduelle chez ces derniers serait due en partie à des virions dont les séquences diffèrent notablement de celles des virions trouvés dans les lymphocytes TCD4+, suggérant fortement l’existence d’un réservoir différent [15]. Par ailleurs, des analyses phylogénétiques réalisées sur des virus isolés à partir de monocytes et de lymphocytes infectés chez des patients sous traitement ont montré une diversité génétique plus grande dans les monocytes, suggérant fortement qu’au moins une fraction de la population de monocytes serait le siège d’une infection persistante de type chronique [
16]. Le débat sur l’origine de la virémie résiduelle n’est bien sûr pas clos et il n’est pas exclu que les deux théories soient valables en fonction du type cellulaire ciblé par le virus et que les différents cas de figure puissent exister, avec notamment la coexistence de cellules infectées de manière latente et chronique. |
Perspectives thérapeutiques Il apparaît aujourd’hui que le maintien d’une virémie résiduelle et les phénomènes de rebond à l’arrêt du traitement antiviral sont, en partie, dus à l’existence de réservoirs (Encadré) dans lesquels le virus peut s’intégrer de manière latente. Il s’avère également que des cellules infectées ayant une réplication chronique, dite cryptique, persistent dans l’organisme. Par ailleurs, l’existence de sanctuaires (ou réservoirs tissulaires) (Encadré), peu ou pas accessibles aux drogues actuellement utilisées, constitue une autre barrière thérapeutique qui nécessite la mise au point de nouvelles drogues antivirales [
17]. De plus, de nombreux inhibiteurs de la transcriptase inverse sont inefficaces dans les macrophages infectés et de nombreux inhibiteurs des protéases ont une efficacité bien moindre dans ces mêmes cellules que dans les lymphocytes T [
18]. Finalement, on décrit de plus en plus souvent l’émergence de virus multirésistants chez des patients bénéficiant d’une multithérapie active. Toutes ces constatations ont de profondes implications sur un plan thérapeutique dans l’optique d’éradiquer le virus des patients. Les efforts visant à renforcer la multithérapie active doivent se poursuivre et l’accent être mis sur l’élaboration de molécules ayant une action sur d’autres étapes du cycle, les étapes actuellement ciblées étant l’entrée, l’intégration et la maturation du virus. Ainsi, la transcription du VIH-1 constitue une cible privilégiée [
19] et la protéine Tat joue un rôle central. Par ailleurs, des molécules ciblant les facteurs cellulaires impliqués dans l’activation cellulaire [
20] sont potentiellement très intéressantes, car elles permettront de s’affranchir des problèmes liés à l’émergence de virus résistant à ces drogues. Des protéines isolées chez le millepertuis [
21], qui appartiennent à la famille des protéines Ding [
22], répriment fortement la transcription du VIH-1 et constituent ainsi de bons candidats. Un autre axe de recherche, impliquant les techniques de chimie, devra être développé : il permettra de modifier les molécules existantes ou d’en élaborer de nouvelles qui puissent accéder aux sanctuaires (comme traverser la barrière hémato-encéphalique), mais aussi d’améliorer leur efficacité pour l’ensemble des types cellulaires infectés (les macrophages notamment). Une purge des réservoirs devra être associée à un renforcement de la multithérapie si l’objectif à atteindre est l’éradication du virus des patients infectés. L’idée est d’utiliser des drogues capables de réactiver le VIH-1 intégré de manière latente et d’y associer une HAART très active détruisant les virions alors produits [
23]. De nombreuses drogues ont ainsi été caractérisées pour leurs propriétés réactivatrices qui incluent des stimulus physiologiques (IL6, IL7, TNFα, etc.), des dérivés d’ester du phorbol, des inhibiteurs des histones déacétylases et des activateurs du complexe P-TEFb [
24–
26]. Les essais cliniques réalisés à ce jour, en vue de purger les réservoirs, n’ont pas donné satisfaction, ou ont même échoué. Ainsi, un premier essai clinique prometteur avec l’acide valproïque [
27], un inhibiteur des histones déacétylases, a été invalidé ultérieurement [
28]. Un activateur du complexe P-TEFb est actuellement en cours d’essai clinique. Cette molécule est très intéressante car, outre le fait qu’elle réactive le virus latent, son effet inhibiteur sur l’expression du récepteur CD4 préviendrait la réinfection des cellules [
29]. |
Même si nous n’avons pas encore un tableau complet des processus mis en jeu dans la latence virale, les implications thérapeutiques de notre compréhension actuelle de la formation des réservoirs latents sont importantes en vue de traiter les patients infectés par le VIH-1. Une purge des cellules réservoirs, combinée à une thérapie antivirale très active (HAART), pourrait permettre d’éradiquer les virus des patients infectés ou, à défaut, de diminuer considérablement leur quantité, de telle sorte que la réplication virale ne soit plus suffisante pour entraîner une virémie résiduelle détectable ou les rebonds de celle-ci en cas d’arrêt du traitement antiviral. À défaut d’un traitement préventif efficace, des traitements curatifs, combinant une purge des réservoirs et un renforcement des multithérapies qui cibleraient toutes les cellules infectées (chronique et/ou sanctuaire), entretiennent l’espoir d’aboutir à une guérison complète des patients infectés, et cela même si la possibilité d’éradiquer totalement le virus semble difficile à l’heure actuelle. L’existence de patients infectés mais dont la maladie ne progresse pas (HIV controllers) témoigne en ce sens. Ces patients vivent en effet avec le virus dont l’expression est suffisamment restreinte pour ne pas progresser vers la maladie du Sida [
30].

|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Williams SA, Greene WC. Regulation of HIV-1 latency by T-cell activation. Cytokine 2007; 39 : 63–74. 2. Narlikar GJ, Fan HY, Kingston RE. Cooperation between complexes that regulate chromatin structure and transcription. Cell 2002; 108 : 475–87. 3. Treand C, Du Chêne I, Bres V, et al. Requirement for SWI/SNF chromatin-remodeling complex in Tatmediated activation of the HIV-1 promoter. EMBO J 2006; 25 : 1690–9. 4. Ganesh L, Burstein E, Guha-Niyogi A, et al. The gene product Murr1 restricts HIV-1 replication in resting CD4+ lymphocytes. Nature 2003; 426 : 853–7. 5. Yeung ML, Benkirane M, Jeang KT. Small non-coding RNAs, mammalian cells, and viruses: regulatory interactions ? Retrovirology 2007; 4 : 74. 6. Triboulet R, Benkirane M. Implication de la voie des microARN dans la réplication du VIH. Med Sci (Paris) 2007; 23 : 590–2. 7. Triboulet R, Mari B, Lin YL, et al. Suppression of microRNA-silencing pathway by HIV-1 during virus replication. Science 2007; 315 : 1579–82. 8. Chun TW, Justement JS, Lempicki RA, et al. Gene expression and viral prodution in latently infected, resting CD4+ T cells in viremic versus aviremic HIV-infected individuals. Proc Natl Acad Sci USA 2003; 100 : 1908–13. 9. Corbeau P. Interfering RNA and HIV: reciprocal interferences. PLoS Pathog 2008; 4 : e1000162. 10. Perelson AS, Essunger P, Cao Y, et al. Decay characteristics of HIV-1-infected compartments during combination therapy. Nature 1997; 387 : 188–91. 11. Dornadula G, Zhang H, VanUitert B, et al. Residual HIV-1 RNA in blood plasma of patients taking suppressive highly active antiretroviral therapy. Jama 1999; 282 : 1627–32. 12. Maldarelli F, Palmer S, King MS, et al. ART suppresses plasma HIV-1 RNA to a stable set point predicted by pretherapy viremia. PLoS Pathog 2007; 3 : e46. 13. Palmer S, Wiegand AP, Maldarelli F, et al. New real-time reverse transcriptase-initiated PCR assay with single-copy sensitivity for human immunodeficiency virus type 1 RNA in plasma. J Clin Microbiol 2003; 41 : 4531–6. 14. Shen L, Siliciano RF. Viral reservoirs, residual viremia, and the potential of highly active antiretroviral therapy to eradicate HIV infection. J Allergy Clin Immunol 2008; 122 : 22–8. 15. Bailey JR, Sedaghat AR, Kieffer T, et al. Residual human immunodeficiency virus type 1 viremia in some patients on antiretroviral therapy is dominated by a small number of invariant clones rarely found in circulating CD4+ T cells. J Virol 2006; 80 : 6441–57. 16. Llewellyn N, Zioni R, Zhu H, et al. Continued evolution of HIV-1 circulating in blood monocytes with antiretroviral therapy: genetic analysis of HIV-1 in monocytes and CD4+ T cells of patients with discontinued therapy. J Leukoc Biol 2006; 80 : 1118–26. 17. Cumont MC, Monceaux V, Viollet L, et al. TGF-beta in intestinal lymphoid organs contributes to the death of armed effector CD8 T cells and is associated with the absence of virus containment in rhesus macaques infected with the simian immunodeficiency virus. Cell Death Differ 2007; 14 : 1747–58. 18. Aquaro S, Calio R, Balzarini J, et al. Macrophages and HIV infection: therapeutical approaches toward this strategic virus reservoir. Antiviral Res 2002; 55 : 209–25. 19. Stevens M, De Clercq E, Balzarini J. The regulation of HIV-1 transcription: molecular targets for chemotherapeutic intervention. Med Res Rev 2006; 26 : 595–625. 20. Rohr O, Marban C, Aunis D, Schaeffer E. Regulation of HIV-1 gene transcription: from lymphocytes to microglial cells. J Leukoc Biol 2003; 74 : 736–49. 21. Darbinian-Sarkissian N, Darbinyan A, Otte J, et al. p27(SJ), a novel protein in St John’s Wort, that suppresses expression of HIV-1 genome. Gene Ther 2006; 13 : 288–95. 22. Berna A, Bernier F, Chabriere E, Perera T, Scott K. DING proteins; novel members of a prokaryotic phosphate-binding protein superfamily which extends into the eukaryotic kingdom. Int J Biochem Cell Biol 2008; 40 : 170–5. 23. Mok HP, Lever A. Waking Up the Sleepers: HIV Latency and Reactivation. J Formos Med Assoc 2008; 107 : 909–14. 24. Geeraert L, Kraus G, Pomerantz RJ. Hide-and-seek: the challenge of viral persistence in HIV-1 infection. Annu Rev Med 2008; 59 : 487–501. 25. Wang FX, Xu Y, Sullivan J, et al. IL-7 is a potent and proviral strain-specific inducer of latent HIV-1 cellular reservoirs of infected individuals on virally suppressive HAART. J Clin Invest 2005; 115 : 128–37. 26. Chun TW, Engel D, Mizell SB, Ehler LA, Fauci AS. Induction of HIV-1 replication in latently infected CD4+ T cells using a combination of cytokines. J Exp Med 1998; 188 : 83–91. 27. Mai A. The therapeutic uses of chromatin-modifying agents. Expert Opin Ther Targets 2007; 11 : 835–51. 28. Siliciano JD, Lai J, Callender M, et al. Stability of the latent reservoir for HIV-1 in patients receiving valproic acid. J Infect Dis 2007; 195 : 833–6. 29. Contreras X, Barboric M, Lenasi T, Peterlin BM. HMBA releases P-TEFb from HEXIM1 and 7SK snRNA via PI3K/Akt and activates HIV transcription. PLoS Pathog 2007; 3 : 1459–69. 30. Martinez V, Autran B. Les HIV controllers : une nouvelle entité évolutive de l’infection par le VIH ? Med Sci (Paris) 2008; 24 : 7–9. 31. Schwartz C, Le Douce V, Cherrier T, et al. Un virus tapi dans l’ombre : les bases moléculaires de la latence du VIH-1. Partie I : la physiologie de la latence du VIH-1. Med Sci (Paris) 2010; 26 : 159–63. |