| |
| Med Sci (Paris). 2010 April; 26(4): 405–410. Published online 2010 April 15. doi: 10.1051/medsci/2010264405.Immunopathogenèse des maladies inflammatoires chroniques de l’intestin Julien Matricon* Inserm U766, Clermont Université, Université d’Auvergne, Pharmacologie fondamentale et clinique de la douleur, Laboratoire de pharmacologie médicale, BP 10448, 63000 Clermont-Ferrand, France |
Définition et épidémiologie Les maladies inflammatoires chroniques de l’intestin (MICI) se caractérisent par une inflammation sévère de l’intestin grêle et du côlon qui conduit à des diarrhées et des douleurs abdominales. Les deux principales formes de MICI sont la maladie de Crohn (MC) et la recto-colite hémorragique (RCH). Les MICI sont des maladies inflammatoires chroniques et intermittentes de l’intestin. La MC et la RCH diffèrent par la localisation de l’inflammation dans le tractus gastro-intestinal et par la nature des atteintes immunologiques et histologiques. Anatomiquement, la MC peut toucher l’ensemble du tractus gastro-intestinal de la bouche à l’anus, même si la majorité des cas touchent le tube digestif en-deça de l’iléon terminal. La RCH se restreint au niveau recto-colique. Microscopiquement, la MC est transmurale tandis que la RCH ne touche que la muqueuse intestinale [
1]. Les MICI sont des maladies très invalidantes en raison de la fatigue associée aux symptômes inflammatoires et à l’état de douleur chronique dans lequel se trouvent les patients. Les MICI affectent la qualité de vie mais pas sa durée : le taux de mortalité des patients n’est pas différent de celui de la population normale. Elles touchent aussi bien les femmes que les hommes et affectent de façon préférentielle le jeune adulte. Les incidences les plus élevées sont rapportées en Europe du Nord et en Amérique du Nord où elles sont respectivement de 12 à 19/100 000 par an et de 5 à 29/100 000 par an. Près de 1,4 million d’Américains et de 2,2 millions d’Européens en sont atteints [
2]. La prévalence des MICI varie en fonction de l’ethnie ou de la race considérée. Les Caucasiens et les Afro-Américains sont les plus touchés alors que les MICI sont rares chez les Hispaniques et les Asiatiques. Les Juifs ashkénazes ont un risque beaucoup plus élevé de développer une MICI avec une incidence 2 à 4 fois supérieure à celle que l’on rencontre chez les Caucasiens non-juifs. |
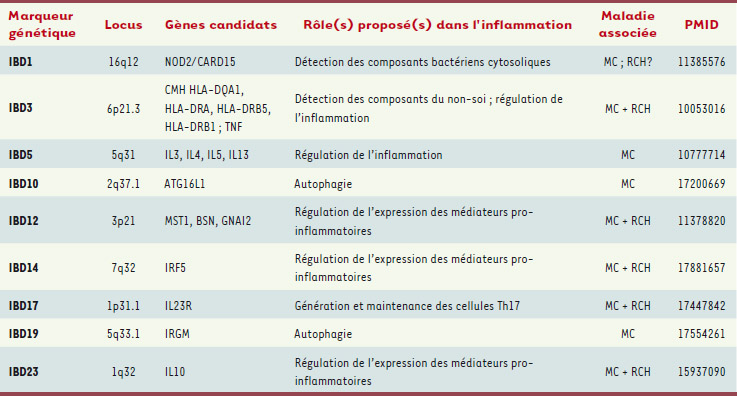
Données génétiques et gènes de susceptibilité L’incidence variable des MICI en fonction de la race suggère que les MICI sont des maladies à forte composante génétique. Des données épidémiologiques supportent cette hypothèse : (1) l’hétérogénéité de la répartition géographique des MICI ; (2) l’existence de foyers et de formes familiales de MICI ; (3) le taux de concordance élevé chez les jumeaux monozygotes. Ces dernières années, de nombreuses études génomiques ont permis d’associer des loci chromosomiques spécifiques aux MICI et ainsi d’identifier des gènes candidats impliqués dans le développement des processus inflammatoires. Parmi une myriade de gènes pointés par les études de liaison génétique, les gènes causaux les plus prometteurs codent des protéines permettant la reconnaissance et la présentation des antigènes bactériens (autophagie, complexe majeur d’histocompatibilité CMH) et la coordination des réponses innée et adaptative du système immunitaire [
3]. Ces découvertes (Tableau I) suggèrent que la réponse immunitaire aux agents pathogènes, notamment bactériens, serait perturbée dans les MICI même si de nombreux facteurs de risque environnementaux (tabagisme, appendicite, etc.) peuvent également participer à ce dysfonctionnement immunitaire [
28].
 | Tableau I.
Principaux loci chromosomiques de susceptibilité pour les MICI (études répliquées). IRGM : immunity-related GTPase family, M ; IRF5 : Interferon regulatory factor 5 ; MST1 : macrophage stimulating 1 ; GNAI2 : guanine nucleotide binding protein (G protein), alpha inhibiting activity polypeptide 2 ; ATG16L1 : autophagy-related protein 16-1 [
29]. |
|
La défense immunitaire contre les microbes intestinaux est défaillante à deux niveaux dans les MICI : (1) la barrière muqueuse épithéliale est affaiblie et (2) les réponses des immunités innée et acquise de l’hôte sont altérées. Dans la muqueuse intestinale des patients atteints de MICI, les proportions des différentes populations bactériennes sont modifiées (dysbiose). Les bactéries potentiellement pathogènes telles que Escherichia coli, Listeria monocytogenes, Yersinia enterocolitica et Mycobacterium paratuberculosis sont présentes en excès [
4] tandis que la concentration de bactéries bénéfiques du phylum Firmicutes est diminuée [
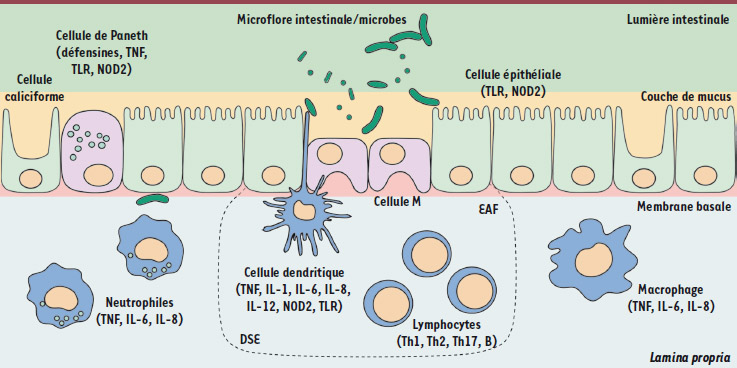
5]. La dysbiose pourrait être un élément déterminant dans l’immunopathogenèse des MICI en provoquant un déséquilibre dans la régulation des microbes de la flore commensale par les défenses immunitaires de l’hôte au niveau de la frontière muqueuse. La dysbiose favorise la prolifération de bactéries pathogènes invasives et la translocation bactérienne à travers la barrière de la muqueuse intestinale vers les ganglions mésentériques. Ces deux phénomènes participent au processus de perméabilisation de la barrière épithéliale qui est le prérequis à l’activation de la réponse immunitaire muqueuse. La barrière intestinale protège l’organisme des menaces bactériennes potentielles (Figure 1). Elle est constituée d’un biofilm bactérien, d’une couche de mucus et de l’épithélium intestinal au sein duquel se trouvent les cellules assurant les défenses immunitaires innées - cellules dendritiques, cellules de Paneth, macrophages et neutrophiles. Dans les MICI, chacune de ces défenses est altérée.
 | Figure 1.
Mécanismes de défense de la barrière épithéliale intestinale. L’invasion de la muqueuse est prévenue par des défenses physiques (couche de mucus sécrété par les cellules caliciformes, barrière cellulaire formée par les cellules épithéliales) et par les cellules immunitaires de l’épithélium (cellules de Paneth et cellules M). La reconnaissance des éléments bactériens pathogènes se fait par les récepteurs TLR et NOD. La réaction inflammatoire implique l’activation du système immunitaire muqueux (cellules mononucléées, lymphocytes et cellules dendritiques du dôme sous-épithélial). Les médiateurs en sont les cytokines (TNF, IL) sécrétées par ces différents acteurs cellulaires. DES : dôme sous-épithélial de la plaque de Peyer ; EAF, épithélium associé au follicule lymphoïde ; IL, interleukine ; NOD2 : nucleotide oligomerization domain 2 ; TLR : toll-like receptor ; TNF : tumor necrosis factor. |
Atteinte de la barrière muqueuse épithéliale Le nombre de cellules caliciformes sécrétant les mucines qui constituent le mucus protecteur de l’épithélium intestinal est diminué dans les MICI. De plus, l’utilisation de puces à ADN a révélé une diminution de l’expression des gènes codant les mucines dans l’iléon et le côlon des patients [
6]. La cohésion et l’étanchéité de la muqueuse intestinale sont assurées par les jonctions cellulaires des cellules épithéliales de l’intestin. Or, dans les MICI, les protéines formant les jonctions serrées des entérocytes (occludine, cadhérines et caténines) sont en quantité réduite [
7]. Les cellules épithéliales constituent également la première ligne de défense contre l’invasion par des organismes pathogènes. En communication constante avec la flore luminale, elles sont capables d’identifier les composants bactériens pathogènes par leurs récepteurs aux peptides bactériens extracellulaires TLR (toll-like receptor) et intracellulaires NOD2 (ou NOD2/CARD15 pour nucleotide-binding oligomerization domain/caspase-activating recruitment domain 15). Elles s’activent alors pour produire des peptides antimicrobiens (β-défensines HBD) et expriment des molécules du CMH afin d’amorcer la réponse immunitaire adaptative de la muqueuse. Dans les MICI, il existe un défaut fonctionnel de la barrière constituée par les peptides antimicrobiens [
8]. Si la RCH est associée à une très forte production d’HBD2, 3 et 4, l’induction de ces HBD est en revanche faible dans la MC. Ce déficit de HBD2 chez les malades souffrant de MC à localisation colique pourrait s’expliquer par un nombre réduit de copies du gène HBD. Les cellules de Paneth, localisées à la base des cryptes intestinales, sécrètent elles aussi des peptides antimicrobiens (α-défensines ou HD) en réponse à la détection de composants bactériens pathogènes par les récepteurs TLR et NOD. Dans la RCH, la production des HD5 et 6 est fortement augmentée, alors qu’elle est basse dans la MC iléale. Le défaut de synthèse de HD5 associé au développement d’une MC iléale résulterait d’un défaut du fonctionnement des cellules de Paneth causé par des mutations de NOD2. Globalement, les données actuelles suggèrent que, dans la RCH, les changements d’expression des défensines sont secondaires à l’inflammation alors que dans la MC iléale, ils pourraient être la cause de l’altération de l’immunité innée muqueuse. Dérégulation de la réponse immunitaire innée L’affaiblissement des premières défenses de la muqueuse contribue à la perméabilisation de l’épithélium intestinal. Celle-ci a pour conséquence l’augmentation des contacts entre les bactéries de la flore commensale et le système immunitaire muqueux. Dans la MC, ces interactions seraient encore facilitées par un défaut de la clairance bactérienne par les macrophages dont le processus de sécrétion des cytokines inflammatoires serait défectueux [
9]. L’excès de telles interactions serait à l’origine d’une perte de tolérance à la flore commensale, ce qui activerait les cellules sentinelles de l’immunité innée : les cellules dendritiques (CD) de la muqueuse (Figure 1). Les cellules dendritiques sont à l’interface entre les cellules épithéliales intestinales et les lymphocytes T. Elles présentent les antigènes aux lymphocytes T auxiliaires CD4+ naïfs (Th0) dont elles favorisent la différenciation en lymphocytes T régulateurs (Trég), garantissant ainsi la tolérance à la flore commensale. En cas d’infection, les CD activées par leurs récepteurs TLR et NOD2 produisent des cytokines pro-inflammatoires et favorisent la différenciation des lymphocytes T effecteurs Th1, Th2 et Th17 (Figure 2), ce qui amorce une inflammation locale persistante. La balance des cytokines sécrétées déterminera l’équilibre entre les différents types de lymphocytes T CD4+ effecteurs [
10]. Dans les MICI, une activation excessive des cellules dendritiques est observée au niveau des sites inflammatoires [
11]. Il en résulte une très forte différenciation des lymphocytes effecteurs de type CD4+ et CD8+ et des autres cellules effectrices telles que les natural killer (NK et NKT) et une abolition de la production de cellules Trég. Le défaut de lymphocytes Trég participe au développement d’une réponse immunitaire vis-à-vis de bactéries commensales qui normalement sont tolérées par le système immunitaire muqueux (tolérance périphérique). Cette rupture de tolérance périphérique perpétue alors l’inflammation.
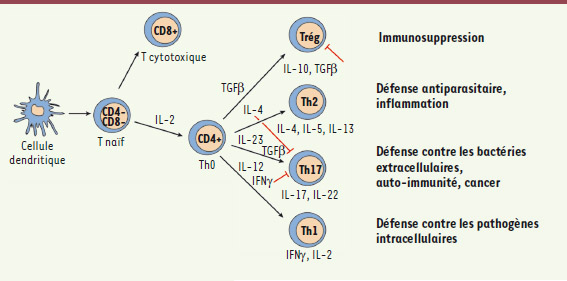
 | Figure 2.
Différenciation des lymphocytes T naïfs (Th0). CD : cluster de différenciation ; Th : lymphocyte T helper ; IFNγ : interféron gamma ; IL : interleukine, TGF : transforming growth factor. |
L’excès d’activation des CD est principalement la conséquence d’anomalies du fonctionnement des récepteurs TLR et NOD qui détectent les composants bactériens. En effet, dans les MICI, les altérations des mécanismes épithéliaux de l’immunité innée auraient pour origine une modification des patrons d’expression des TLR. L’hypothèse d’un dysfonctionnement de la réponse immunitaire vis-à-vis des bactéries de la lumière intestinale engendré par les TLR est confortée par la description de polymorphismes des gènes TLR1, 2, 4 et 6 associés au développement des MICI [
12]. L’existence de polymorphismes pathogéniques du gène NOD2 est en faveur d’un mécanisme défectueux de la prise en charge antigénique par les récepteurs TLR et NOD2. Les trois mutations majeures de NOD2 (Gly908Arg, Arg702Trp et Leu1007fsinsC) sont retrouvées à l’état homozygote ou hétérozygote composite chez 10 à 15 % des patients atteints de MC. L’utilisation de souris knock-in a permis d’évaluer les fonctions de variants de NOD2 et de montrer que les souris possédant une mutation NOD2 Leu1007fsinsC ont une susceptibilité plus grande que les souris sauvages à l’induction d’une colite par le sodium dextran sulfate. La colite est accompagnée d’une suractivation de la voie du nuclear factor kappa B (NF-κB) et d’une augmentation de la sécrétion d’IL(interleukine)-1β [
13]. Ces résultats, en désaccord avec les données cliniques qui associent les mutations de NOD2 à une diminution d’activité de NF-κB, pourraient s’expliquer par l’existence d’une régulation négative exercée par la protéine NOD2 sur la voie de signalisation des récepteurs TLR2. Dans le cas où NOD2 est mutée (Leu1007fsinsC), celle-ci n’inhiberait pas la voie TLR-NF-κB, conduisant à une production accrue de cytokines pro-inflammatoires en présence de bactéries commensales et/ou pathogènes. Le dérèglement de la voie de signalisation TLR2 et la mise en place d’une réponse immunitaire de type Th1 avec production excessive de cytokines pro-inflammatoires chez les souris Leu1007fsinsC vont dans ce sens [
14]. Ainsi, chez les porteurs de ces variants, la production de cytokines pro-inflammatoires en réponse à la stimulation par les composants bactériens et l’élimination des microbes intracellulaires sont altérées [
15]. Dérégulation de la réponse immunitaire adaptative Dans les MICI, les anomalies de la réponse immunitaire innée perturbent la reconnaissance des antigènes et leur présentation aux cellules effectrices (Figure 1). Ainsi, la barrière intestinale est plus sensible aux infections et l’activation du système immunitaire muqueux est dérégulée. Quand la MICI est active, il y a un déséquilibre entre le nombre de lymphocytes T effecteurs (Th) et de lymphocytes T régulateurs (Trég). Dans les MC, ce sont les lymphocytes Th1, caractérisés par une production élevée d’IL-2 et d’IFNγ (interféron), qui prédominent [
16]. À l’inverse, dans la RCH, la muqueuse des patients est infiltrée majoritairement par des lymphocytes Th2 atypiques que caractérise la production d’IL-5, d’IL-13 et de TGFβ ( transforming growth factor) [
17]. De plus, les recherches récentes ont mis à jour une nouvelle population de cellules T appelée Th17 qui contribuerait à la prédominance des populations effectrices sur les populations régulatrices dans les MICI [
18]. Les lymphocytes Th17 (CD4+CD25−) produisent la cytokine pro-inflammatoire IL-17, notamment en réponse à la présence de bactéries extracellulaires. La différenciation de la population Th17 à partir des lymphocytes T naïfs est induite par la coexpression d’IL-23 et de TGFβ dont le rôle dans la détermination de l’équilibre entre lymphocytes Trég (anti-inflammatoires) et Th17 (pro-inflammatoires) est primordial (Figure 2) [
19]. Les associations génétiques impliquant le gène du récepteur IL-23R dans les MICI [
20] ont donc conduit naturellement à suspecter cette sous-population effectrice qui a une forte activité inflammatoire, promeut l’activation et l’accumulation locale des neutrophiles sur le site de l’inflammation tissulaire et induit la production de peptides antimicrobiens comme les HBD [
21]. L’hypothèse avancée est celle d’une contribution de la voie de signalisation de l’IL-23R à l’inflammation qui provoquerait une altération de la synthèse des peptides antimicrobiens et favoriserait l’état pro-inflammatoire Th17. L’IL-23 favorise en effet le développement et l’expansion de cellules T mémoire pathogènes et en particulier la survie et l’expansion clonale des Th17 [
22]. Outre le rôle de cytokines telles que l’IL-23, la modification du patron d’expression des chimiokines (ou cytokines chimio-attractives) peut également provoquer l’afflux anormal de cellules immunitaires effectrices au niveau de la muqueuse intestinale. L’expression de très nombreuses chimiokines (en particulier : IL-8, granulocyte chemotactic protein-2 GCP2, growth regulated protein αet β GROα et GROβ, epithelial neutrophil activating protein 78 ENA-78, etc.) et de leurs récepteurs (CXCR1, CXCR2, etc.) est augmentée pendant la phase active des MICI [
23]. Dans les MICI, un défaut de la production des chimiokines ou un défaut de la régulation des voies de transduction de leurs récepteurs pourrait contribuer à la perte d’intégrité épithéliale en induisant la production locale de radicaux libres [
24,
25] et l’afflux des leucocytes dans la muqueuse grâce à une forte angiogenèse [
26]. Enfin, la RCH et la MC sont associées à une réponse humorale caractérisée par une infiltration de lymphocytes B plasmatiques. Dans la muqueuse, les taux d’immunoglobulines G1 (IgG1), IgG2, IgM et IgE sont augmentés tandis que la concentration d’IgA sécrétoires est diminuée. De plus, la suractivation des cellules B dans les MICI entraîne une forte production d’auto-anticorps muqueux de type IgG dirigés contre les antigènes bactériens commensaux de la lumière intestinale [
27]. Ces observations suggèrent un déséquilibre en défaveur des anticorps de sous-type protecteur (IgA) et en faveur des anticorps de sous-type aggressif (IgG) entretenant l’inflammation de la muqueuse. |
Dans les MICI, l’existence d’une vulnérabilité génétique (mutations dans les gènes TLR et NOD2) perturbe l’identification des antigènes intestinaux et leur présentation aux cellules effectrices. Il en résulte une réponse immunitaire adaptative inappropriée ayant pour conséquence la perte de tolérance à la flore commensale ainsi que l’amplification et l’entretien de la réaction inflammatoire aux pathogènes intestinaux, en particulier dans la MC où il existe une vulnérabilité du système immunitaire. Outre l’inflammation, l’infiltration de cellules immunitaires dans la muqueuse intestinale et à proximité des terminaisons nerveuses entériques conduit à des contacts neuro-immunitaires directs. Ces interactions provoquent l’activation des afférences viscérales provoquant des douleurs abdominales consécutives à l’inflammation. Ces données récentes ont permis le développement de nouvelles thérapeutiques régulant l’activation de la réponse immunitaire cellulaire et l’inflammation (anticorps dirigés contre les cytokines et leurs récepteurs, anticorps bloquant les molécules de costimulation des lymphocytes, etc.) qui complètent les traitements anti-inflammatoires classiques à base de corticostéroïdes et d’acides 5-amino-salicylés. Dans la MC, de nouvelles pistes thérapeutiques immunostimulatrices sont désormais envisagées pour pallier l’immunodéficience primaire et limiter les complications causées par les immunosuppresseurs et les anticorps antagonistes de cytokines pro-inflammatoires [1]. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Baumgart DC, Sandborn WJ. Inflammatory bowel disease: clinical aspects and established and evolving therapies. Lancet 2007; 369 : 1641–57. 2. Loftus EV Jr. Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence, and environmental influences. Gastroenterology 2004; 126 : 1504–17. 3. Cho JH. The genetics and immunopathogenesis of inflammatory bowel disease. Nat Rev Immunol 2008; 8 : 458–66. 4. Tamboli CP, Neut C, Desreumaux P, Colombel JF. Dysbiosis as a prerequisite for IBD. Gut 2004; 53 : 1057. 5. Sokol H, Pigneur B, Watterlot L, et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc Natl Acad Sci USA 2008; 105 : 16731–6. 6. Moehle C, Ackermann N, Langmann T, et al. Aberrant intestinal expression and allelic variants of mucin genes associated with inflammatory bowel disease. J Mol Med 2006; 84 : 1055–66. 7. Hill KA, Wang KL, Stryker SJ, et al. Comparative analysis of cell adhesion molecules, cell cycle regulatory proteins, mismatch repair genes, cyclooxygenase-2, and DPC4 in carcinomas arising in inflammatory bowel disease and sporadic colon cancer. Oncol Rep 2004; 11 : 951–6. 8. Ramasundara M, Leach ST, Lemberg DA, Day AS. Defensins and inflammation: the role of defensins in inflammatory bowel disease. J Gastroenterol Hepatol 2009; 24 : 202–8. 9. Smith AM, Rahman FZ, Hayee B, et al. Disordered macrophage cytokine secretion underlies impaired acute inflammation and bacterial clearance in Crohn’s disease. J Exp Med 2009; 206 : 1883–97. 10. Baumgart DC, Carding SR. Inflammatory bowel disease: cause and immunobiology. Lancet 2007; 369 : 1627–40. 11. Hart AL, Al-Hassi HO, Rigby RJ, et al. Characteristics of intestinal dendritic cells in inflammatory bowel diseases. Gastroenterology 2005; 129 : 50–65. 12. Cario E, Podolsky DK. Differential alteration in intestinal epithelial cell expression of toll-like receptor 3 (TLR3) and TLR4 in inflammatory bowel disease. Infect Immun 2000; 68 : 7010–7. 13. Maeda S, Hsu LC, Liu H, et al. Nod2 mutation in Crohn’s disease potentiates NF-kappaB activity and IL-1beta processing. Science 2005; 307 : 734–8. 14. Watanabe T, Kitani A, Murray PJ, Strober W. NOD2 is a negative regulator of Toll-like receptor 2-mediated T helper type 1 responses. Nat Immunol 2004; 5 : 800–8. 15. Inohara N, Ogura Y, Fontalba A, et al. Host recognition of bacterial muramyl dipeptide mediated through NOD2. Implications for Crohn’s disease. J Biol Chem 2003; 278 : 5509–12. 16. Bamias G, Sugawara K, Pagnini C, Cominelli F. The Th1 immune pathway as a therapeutic target in Crohn’s disease. Curr Opin Investig Drugs 2003; 4 : 1279–86. 17. Targan SR, Karp LC. Defects in mucosal immunity leading to ulcerative colitis. Immunol Rev 2005; 206 : 296–305. 18. Fujino S, Andoh A, Bamba S, et al. Increased expression of interleukin 17 in inflammatory bowel disease. Gut 2003; 52 : 65–70. 19. Leung-Theung-Long S, Guerder S. Les cellules Th17 : une nouvelle population de cellules T CD4 effectrices pro-inflammatoires. Med Sci (Paris) 2008; 24 : 972–6. 20. Peyrin-Biroulet L, Parmentier-Decrucq E, Branche J, Desreumaux P. L’IL-23R, un nouveau gène de susceptibilité dans les maladies inflammatoires chroniques intestinales. Med Sci (Paris) 2007; 23 : 250–2. 21. Matsuzaki G, Umemura M. Interleukin-17 as an effector molecule of innate and acquired immunity against infections. Microbiol Immunol 2007; 51 : 1139–47. 22. Bettelli E, Carrier Y, Gao W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature 2006; 441 : 235–8. 23. Kraneveld AD, Rijnierse A, Nijkamp FP, Garssen J. Neuro-immune interactions in inflammatory bowel disease and irritable bowel syndrome: future therapeutic targets. Eur J Pharmacol 2008; 585 : 361–74. 24. Keshavarzian A, Banan A, Farhadi A, et al. Increases in free radicals and cytoskeletal protein oxidation and nitration in the colon of patients with inflammatory bowel disease. Gut 2003; 52 : 720–8. 25. Zimmerman NP, Vongsa RA, Wendt MK, Dwinell MB. Chemokines and chemokine receptors in mucosal homeostasis at the intestinal epithelial barrier in inflammatory bowel disease. Inflamm Bowel Dis 2008; 14 : 1000–11. 26. Koutroubakis IE, Tsiolakidou G, Karmiris K, Kouroumalis EA. Role of angiogenesis in inflammatory bowel disease. Inflamm Bowel Dis 2006; 12 : 515–23. 27. Adams RJ, Heazlewood SP, Gilshenan KS, et al. IgG antibodies against common gut bacteria are more diagnostic for Crohn’s disease than IgG against mannan or flagellin. Am J Gastroenterol 2008; 103 : 386–96. 28. Sendid B, Jouault T, Vitse A, et al. Anti-glycan antibodies establish an unexpected link between C. albicans and Crohn disease. Med Sci (Paris) 2009; 25 : 473–81 29. Wellcome Trust Case Control Consortium : Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls. Nature 2007; 447 : 661–78. |