| |
| Med Sci (Paris). 2010 April; 26(4): 411–416. Published online 2010 April 15. doi: 10.1051/medsci/2010264411.L’octamanie Continue Le double jeu de OCT4 Sonia Stefanovic* and Michel Pucéat* Inserm UMR 633, Université Paris Descartes, programme Avenir, Équipe « Cellules souches et cardiogenèse », 4, rue Pierre Fontaine, 91000 Évry, France |
OCT4, un parent dans la famille POU En 1989, le gène POU5f1 codant pour le facteur de transcription OCT4 (ou OCT3/4) a été identifié chez la souris, dans les cellules souches embryonnaires et de tératocarcinome [
1–
4]. OCT4 est un facteur de transcription appartenant à la classe V de la famille POU (PIT, OCT, UNC). Les membres de la famille POU sont des protéines de liaison à l’ADN. Ils se lient à un motif octamérique localisé dans la région promotrice ou régulatrice (enhancer) de leurs gènes cibles. Le domaine POU fut identifié dès 1988 comme une séquence de 156 acides aminés présente dans les protéines PIT-L, OCT1, OCT2 et UNC86 [
5]. Le motif octamérique canonique reconnu par les facteurs POU est la séquence ATGC (A/T) AAT [
6] bien que cette séquence puisse beaucoup varier [
7]. Le domaine POU est constitué de deux parties : le sous-domaine spécifique (POUs) reconnaissant ATGC et l’homéodomaine (POUHD) reconnaissant AAAT. Ces deux parties sont connectées par une région flexible de longueur variable [
8]. Cette flexibilité entre les deux sous-domaines leur permet de se fixer sur des sites de liaison indépendamment l’un de l’autre. Ceci confère à la protéine POU une certaine versatilité dans sa fonction de régulation de la transcription [
9]. Des études récentes de ChIP-chip et ChIP-PET1, (Paired end tags) [7,
10] ont identifié plus de 1 000 promoteurs cibles pour OCT4, un chiffre que nous avons confirmé au laboratoire par une étude de ChIP-chip. Cela suggère que d’une part, nous avons encore beaucoup à découvrir sur le réseau transcriptionnel de pluripotence et que d’autre part, l’octamanie va pouvoir se prolonger. Chez l’homme, le gène POU5f1 code pour deux isoformes protéiques, OCT4-IA et OCT4-IB [
11] présentes dans les lignées de cellules souches embryonnaires et le blastocyste [
12]. Ces deux protéines, générées par épissage alternatif, possèdent les mêmes domaines POU et carboxy-terminal (CTD) mais diffèrent par leur région amino-terminale (NTD). La séquence amino-terminale responsable de l’activité transcriptionnelle d’OCT4-IA est absente dans OCT4-IB. L’ARNm d’OCT4-IB est à l’origine de trois isoformes protéiques car il est traduit via une initiation alternative aux codons start AUG et CUG. Cette isoforme aurait une fonction anti-apoptotique (Figure 1) [
13]. Les diverses isoformes d’OCT4 humain n’ont donc pas livré tous leurs secrets.
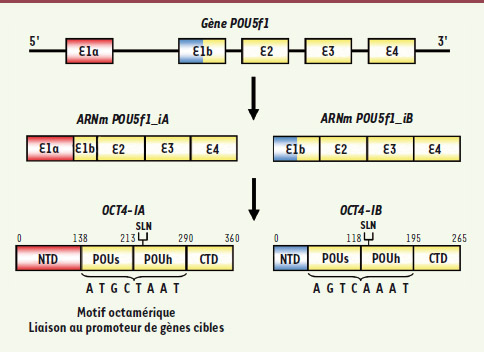
 | Figure 1.
Représentation schématique des isoformes humaines codées par le gène POU5f1. Chez l’homme, le gène POU5f1 code pour deux isoformes, OCT4-IA et OCT4-IB. Ces deux protéines, générées par épissage alternatif, possèdent le même domaine POU, domaine de liaison à l’ADN, et le même domaine carboxy-terminal (CTD). Le domaine POU est formé de deux parties : le sous-domaine spécifique (POUs) et l’homéodomaine (POUHD). Le motif octamérique reconnu par les facteurs POU est la séquence ATGC (A/T) AAT. Ces deux isoformes diffèrent par leur domaine amino-terminal (NTD) (SLN : séquence de localisation nucléaire). |
|
Expression d’OCT4 au cours du développement embryonnaire Chez la souris, les transcrits maternels et les protéines OCT4 provenant des ovocytes sont faiblement exprimés dans le zygote et dans les blastomères issus des premières divisions de clivage (2 et 4 cellules) (Figure 2). Au stade 4 cellules, l’expression zygotique du gène POU5f1 est activée. Par conséquent, le niveau d’expression de la protéine OCT4 augmente dans tous les blastomères jusqu’à la compaction de la morula [
14]. Après la formation du blastocœle, l’expression d’OCT4 ne perdure que dans la masse cellulaire interne (MCI) du blastocyste, elle n’est plus présente dans le trophectoderme [
3]. Une fois le blastocyste implanté dans l’utérus, l’expression d’OCT4 est restreinte à l’épiblaste, ce qui suggère qu’il exerce une fonction autre que le maintien de la pluripotence [6]. Au moment de la gastrulation, qui débute chez la souris entre le jour 6 et 6,5, l’expression d’OCT4 dans l’épiblaste commence à diminuer parallèlement à la spécification des différentes lignées cellulaires [6]. Cependant, une étude récente réalisée chez la souris montre un continuum du profil d’expression d’OCT4 pendant et après la gastrulation : schématiquement, au stade 6,5 jours, OCT4 est présent dans le mésoderme et l’endoderme mais pas dans l’ectoderme ; au stade 7,5 jours, le neuroectoderme est marqué par la sonde OCT4 tandis que le mésoderme et l’endoderme ne le sont plus ; au stade 9,5 jours, les tissus dérivant de ces trois feuillets sont négatifs pour ce marqueur, et seules les cellules germinales primordiales (PGC) expriment OCT4 [
15]. Au-delà, ce facteur reste exprimé dans les PGC précurseurs des gamètes [
16]. À la différence de son profil d’expression chez la souris, OCT4 humain est présent dans l’oocyte au stade de méiose II, une observation qui n’est cependant pas constante. Cette localisation persiste dans l’embryon jusqu’au stade 8 blastomères bien que toutes les cellules n’expriment pas le facteur. OCT4 se localise ensuite dans le noyau des cellules de la masse interne du blastocyste. Cette variabilité caractéristique des premiers stades de clivage s’explique par l’origine maternelle des transcrits et de la protéine. Dès que la transition maternelle-embryonnaire de la transcription s’opère, au moment de la compaction, l’expression d’OCT4 devient permanente (Figure 2) [
17].
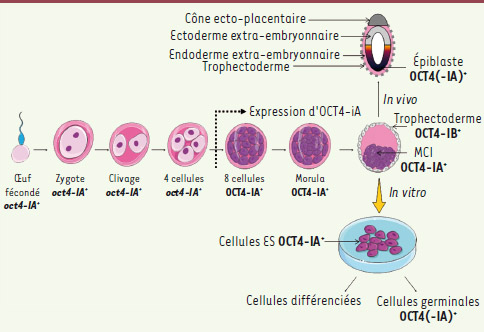
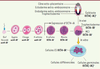 | Figure 2.
Expression d’OCT4 au cours du développement embryonnaire. Présent comme un transcrit maternel dans le zygote, oct4-IA est faiblement exprimé jusqu’au stade 8 cellules. Le gène oct4-iA endogène est ensuite activé, OCT4-IA est exprimé uniformément dans tous les blastomères jusqu’à la compaction de la morula. OCT4-IB est exprimé dans les cellules du trophectoderme. Par la suite, l’expression de l’isoforme A est restreinte à la masse cellulaire interne (MCI), et après l’implantation, potentiellement à l’épiblaste (-IA). Les cellules germinales expriment potentiellement l’isoforme A (-IA). |
Une seule étude distingue l’expression des différentes isoformes humaines au cours du développement préimplantatoire [12]. Dans cette étude, OCT4-IB est décrite comme une protéine cytoplasmique contrairement à OCT4-IA qui est nucléaire. L’expression d’OCT4-IB est restreinte aux cellules du trophectoderme et la protéine n’est pas détectable dans la masse cellulaire interne du blastocyste. Dernièrement, une troisième isoforme, OCT4-IB1, issue de l’épissage alternatif de POU5f1, a été décrite chez l’homme. Ce nouveau variant est présent in vitro dans les cellules ES (embryonic stem) puis son expression s’éteint au cours de la différenciation [
18].
In vitro, les protéines OCT4 murines et humaines sont exclusivement exprimées dans les cellules souches embryonnaires (ES), les cellules de carcinome embryonnaire (EC) et les cellules germinales embryonnaires (EG) à l’état indifférencié. Lors de la différenciation de ces cellules, l’expression d’OCT4 est réprimée [1–3,
19–
21]. Deux éléments enhancer distincts dirigent l’expression d’OCT4 selon le type cellulaire et le stade du développement embryonnaire : l’enhancer distal et l’enhancer proximal désignés respectivement par DE et PE [
22]. Le DE est localisé à 5 Kb environ en amont du promoteur. Il régule l’expression d’OCT4 dans la morula, la MCI et les cellules germinales. In vitro, il est actif dans les cellules ES, EC et EG. En revanche, le PE est localisé à 1,2 Kb environ du promoteur d’OCT4 et il est requis pour l’expression d’OCT4 dans l’épiblaste. |
OCT4 veille sur la pluripotence des cellules souches OCT4 est connu avant tout pour son rôle déterminant dans le maintien des cellules souches pluripotentes dans l’embryon des mammifères [
23]. Les travaux de Cauffman et al. ont montré que des deux isoformes humaines d’OCT4, seule l’isoforme A est importante pour le maintien de la pluripotence [12]. Le rôle de l’isoforme B reste encore mal connu. La localisation cytoplasmique d’OCT4-IB suggère que cette isoforme n’est pas un activateur transcriptionnel. Son expression exclusive dans les cellules du trophectoderme ne plaide pas pour son rôle dans le maintien de la pluripotence. OCT4, murin ou humain, n’est pas le seul facteur essentiel pour le maintien des cellules ES dans un état de pluripotence. Il est associé aux facteurs SOX2, NANOG et TCF3, découverts plus récemment [
24]. Ces quatre facteurs forment, par des mécanismes de corégulation et d’autorégulation, une boucle de régulation de la pluripotence. En particulier, OCT4 et SOX2 forment un hétérodimère qui permet de réguler d’autres gènes de pluripotence ainsi que leurs propres gènes en ciblant les motifs oct-sox de leurs enhancer. Ces facteurs activent, en collaboration avec l’ARN polymérase II, des gènes indispensables au maintien des cellules souches à l’état indifférencié alors qu’ils répriment - en association avec les protéines du groupe polycomb (PRC) - l’expression de gènes identifiés comme importants pour la différenciation des différents tissus [
25,
26]. OCT4 se lie en effet aux promoteurs occupés par SUZ12, un composant du complexe PRC2 [
27], suggérant qu’il recrute les protéines polycomb pour inhiber la transcription de gènes spécifiques de lignages cellulaires. Il peut de plus réguler l’expression même des composants des complexes polycomb PRC1 et PRC2 [
28]. OCT4 joue donc un rôle majeur dans la régulation épigénétique de la transcription génique. Ces processus se déroulent dans le cadre du maintien d’un niveau stable d’OCT4 en conditions de pluripotence cellulaire. La fonction indispensable d’OCT4 dans le processus de reprogrammation des cellules somatiques en iPS (induced pluripotent stem) lui a valu récemment d’atteindre son heure de gloire. Mais le mystère demeure quant aux mécanismes moléculaires fondamentaux par lesquels les quatre facteurs dits « de Yamanaka » ou « de Thomson », dont OCT4, orchestrent ce ballet de reprogrammation. De manière hypothétique, OCT4 et SOX2 entraîneraient lors du processus de reprogrammation l’expression et/ou le recrutement des protéines polycomb, éteignant l’expression des gènes codant pour les facteurs de spécification cellulaire. En effet, les modifications de la chromatine - dont la triméthylation de la lysine 27 sur l’histone 3 (H3K27me3) - catalysées par le complexe PRC2 et qui sont absentes dans les cellules adultes sont rétablies dans les « pseudo » cellules souches iPS [
29,
30]. Un autre mécanisme pourrait faire intervenir le processus d’inactivation du chromosome X. En effet, dans les cellules ES et iPS femelles, les deux chromosomes X sont actifs, comme en témoigne l’expression bi-allélique de gènes liés à l’X et la régulation appropriée des trois ARN non codants contrôlant réciproquement l’inactivation/activation de l’X : une expression de xist, et l’absence de tsix et xite [
31]. Une étude très récente montre que, dans la cellule ES, OCT4 se lie aux régions régulatrices des gènes codant pour tsix et xite pour maintenir l’activation des deux chromosomes X [
32] laissant suggérer qu’au cours de la reprogrammation, la réactivation du chromosome X est induite par le même processus moléculaire [
50]. |
OCT4, un inducteur de la différenciation cellulaire : effet de « dosage génique » Le taux d’OCT4 influence la destinée des cellules souches embryonnaires OCT4 a toujours été décrit comme un facteur clé du maintien de la pluripotence des cellules souches embryonnaires murines [ 23]. D’autres études ont suggéré un rôle du facteur de transcription OCT4 [
33–
35] dans le choix de la destinée des cellules souches embryonnaires. Niwa et al. ont montré, grâce à un système d’expression cellulaire inductible d’OCT4, qu’un niveau précis d’expression est critique pour le maintien de l’autorenouvellement des cellules ES. Une diminution du niveau d’expression d’OCT4 de moitié par rapport au niveau endogène dans les cellules ES indifférenciées aboutit à la perte de la pluripotence et à la différenciation des cellules ES en trophectoderme. En revanche, si ce taux dépasse de 50 % ou plus le niveau d’expression normal d’OCT4, les cellules ES s’engagent vers l’endoderme extra-embryonnaire et le mésoderme. Au contraire, en absence de LIF (leukemia inhibitory factor) et en présence de facteurs inducteurs de la neurogenèse, la surexpression d’OCT4 dans les cellules ES murines permet leur différenciation en neurones [ 35]. Plus récemment, les travaux d’une équipe française ont montré que l’expression de marqueurs du lignage hématopoïétique est augmentée lorsque les cellules ES surexprimant OCT4 sont différenciées en corps embryoïdes en présence de facteurs inducteurs [
36]. Dans cette étude, bien que le taux d’induction protéique ne soit pas révélé, l’ARN messager POU5f1 est surexprimé pendant 72 heures par un système d’expression viral intégratif. Ces résultats ont confirmé qu’OCT4 n’est pas simplement un répresseur de la différenciation trophectodermique. Il est aussi un régulateur de la spécification des cellules ES vers des types cellulaires différents. Induction du mésoderme cardiaque et expression accrue d’OCT4 En 2006, les travaux de notre équipe ont montré qu’en présence de LIF et de certains facteurs de la superfamille du TGFβ ( transforming growth factor) comme BMP2 ( bone morphogenetic protein) et TGFβ1, le niveau d’expression d’OCT4 est augmenté transitoirement dans les cellules ES murines, induisant l’expression des gènes mésodermiques et cardiaques tels que MESP1/2 ( mesoderm posterior 2), MEF2c ( MADS box transcription enhancer factor 2) et NKX2.5 [
37]. La voie du BMP2 est décrite comme la voie cardiogénique royale aussi bien in vivo qu’ in vitro à partir de cellules ES [
38,
39]. Elle induit la surexpression d’OCT4 et l’expression des facteurs de transcription précoces via l’effecteur intracellulaire SMAD2. Ce phénomène n’est pas restreint aux cellules ES mais peut être observé dans le blastocyste murin se différenciant vers le stade épiblaste [ 37]. Cette observation est à comparer avec la persistance d’OCT4 dans les cellules de l’épiblaste déjà engagées vers une destinée cardiaque [
40]. Cette même observation, reproduite dans notre laboratoire avec des cellules ES humaines, montre que le rôle d’OCT4 dans la spécification cardiaque est conservé entre les deux espèces [
41]. Cette expérience tient évidemment compte des différences dans les voies de signalisation impliquées dans le maintien de la pluripotence entre cellules ES murines et humaines. Contrairement à la voie FGF2 ( fibroblast growth factor 2), la voie LIF/STAT3 (signal transducer and activator of transcription 3) ne participe pas, ou du moins pas aussi directement, au maintien de l’autorenouvellement des cellules ES humaines [
42]. Dans les cellules ES humaines, en présence de FGF2, le BMP2 ou la surexpression de façon transitoire d’un transgène POU5f1 induit l’expression de gènes du mésoderme et cardiaques [ 41]. Des cellules ES aux iPS, actualité oblige, les expériences menées au laboratoire et faites avec les cellules ES ont été dupliquées en utilisant des cellules iPS. Nos travaux montrent que la surexpression d’OCT4-IA dans les cellules iPS humaines entraîne également l’expression des gènes mésodermiques et cardiaques. Nos résultats conduisent donc à penser qu’un niveau d’expression précis de OCT4 et SOX2, et une stœchiométrie OCT-SOX respectée sont requis pour la génération d’iPS. Le dosage relatif de chacun des quatre facteurs utilisés pour la reprogrammation paraît être un paramètre essentiel, mais encore mal connu et mal maîtrisé. |
Une double fonction déterminée par l’échange des facteurs SOX, cibles d’OCT4 OCT4 est donc impliqué, par un effet de dosage génique, dans le maintien de la pluripotence ou l’engagement des cellules ES vers une voie tissulaire spécifique. Plusieurs questions concernant le rôle d’OCT4 se sont alors posées, en particulier : comment la surexpression de ce facteur régule la spécification cardiaque des cellules ES ? En 2006, nos résultats avec les cellules ES murines nous avaient suggéré une hypothèse quant au mécanisme moléculaire sous-jacent à l’action cardiogénique d’OCT4 : nous avions proposé que, par un effet stœchiométrique, une élévation du niveau d’expression d’OCT4 pourrait déplacer le complexe PRC2 réprimant les promoteurs des gènes de différenciation et/ou recruter une déméthylase effaçant la marque épigénétique répressive (H3K27 méthylée) sur ces mêmes promoteurs, voire ajouter la marque activatrice H3K4 méthylée en recrutant une protéine trithorax. Ce processus serait en accord avec la théorie de la « modification d’histone pulsée ». Cette théorie prédit que les modifications des histones associées aux gènes du développement seraient asynchrones permettant une réponse différentielle aux gradients de morphogènes. À ce phénomène pourrait s’ajouter une régulation de la transcription des gènes de différenciation par des microARN [
43], voire un recrutement de microARN sur les promoteurs par complémentarité de séquence [
44]. Nos travaux ont permis de révéler que l’hypothèse était valide [41]. Nous avons découvert que le premier événement induit par l’augmentation transitoire du niveau d’expression d’OCT4 est son déplacement du promoteur de sox2 vers une autre cible appartenant aussi à la famille des facteurs SOX, sox17, un marqueur de l’endoderme connu pour son rôle essentiel dans la formation du mésoderme cardiaque [
45]. Cet échange s’accompagne d’une modification épigénétique des promoteurs de sox2 et sox17, ajout de l’histone H3K27 méthylée sur le promoteur de sox2 et de H3K4 méthylée sur celui de sox17. Ces résultats montrent donc qu’OCT4 agit par un recrutement d’enzymes de remodelage de la chromatine sur des promoteurs de ses gènes cibles. L’échange sox2/sox17 entraîne la rupture de la boucle de pluripotence OCT4-SOX2 et l’expression du facteur de transcription SOX17. L’expression de SOX17 entraîne alors, via la voie de signalisation des WNT, l’activation du facteur de transcription HEX et l’expression de molécules cardiogéniques diffusibles dont le BMP2. Sous l’effet paracrine, les cellules ES avoisinantes se spécifient en progéniteurs cardiaques (Figure 3). Dans les ES murines, nos travaux montrent des événements moléculaires identiques. Chez le poisson-zèbre, casanova (orthologue de sox17) est également une cible de SPG (orthologue d’OCT4). Ces données montrent que la voie OCT4-SOX17 est conservée dans l’évolution.
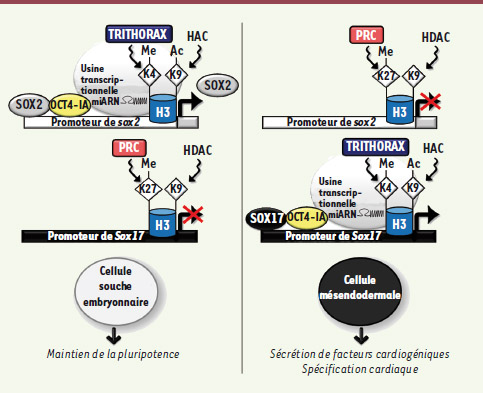
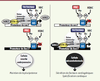 | Figure 3.
Événements moléculaires et cellulaires sous-jacents à la surexpression d’OCT4. La surexpression d’OCT4 entraîne la rupture de la boucle de pluripotence OCT4-SOX2 et son déplacement sur le promoteur du gène codant pour SOX17. Celui-ci, une fois exprimé, vient renforcer l’interaction OCT4/promoteur de sox17. À ce phénomène pourrait s’ajouter le recrutement d’enzymes de remodelage de la chromatine sur les promoteurs des deux gènes cibles. Suivant la marque épigénétique du promoteur de sox17, une usine transcriptionnelle est ainsi formée. L’expression de SOX17 par la cellule mésendodermale entraîne alors l’expression puis la sécrétion de molécules cardiogéniques. Par un effet paracrine, la cellule ES exprime les marqueurs précoces du phénotype cardiaque. H3 : histone 3 ; HAC : histones acétylases ; HDAC : histones déacétylases ; K : lysine ; Me : méthylé ; miARN : microARN ; PRC : complexe protéique répresseur. |
|
Pour conclure, un même facteur peut, dans des conditions particulières (niveau d’expression et cinétique d’expression), être impliqué dans des processus biologiques a priori opposés : la pluripotence et la différenciation cellulaire. Le cas d’OCT4 vient ainsi alimenter le concept de dosage génique rencontré également au cours du développement cardiaque pour d’autres facteurs de transcription comme GATA4 [
46] ou TBX5 [
47] par exemple. À cela s’ajoute un nouveau mécanisme : l’échange des facteurs sox. Un même facteur au sein d’une usine transcriptionnelle comprenant des facteurs de transcription, des enzymes de remodelage chromatinien, des microARN, etc. peut cibler différents facteurs de transcription au sein d’une même famille. Comment s’effectue ce ciblage reste une question biologique majeure en cours d’étude au laboratoire. Selon sa cible, l’effet cellulaire induit est différent. Un mécanisme d’action similaire a également été décrit pour la famille des facteurs GATA sans pour autant en avoir énoncé le mécanisme [
48,
49]. Ces deux concepts développent l’idée qu’un même gène peut entraîner des effets cellulaires très contrastés en fonction de son niveau d’expression et de ses gènes cibles. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient les membres de leur équipe pour leur contribution aux travaux rapportés et à la relecture du manuscrit, Guillaume Blin, Benjamin Brinon, Anne-Claire Guénantin, Oriane Guillevic, Laurent Hamon ainsi que les Dr Tui Neri et David Nury. Notre recherche et Sonia Stefanovic sont financées par l’Agence nationale de la recherche (programme blanc).
|
Footnotes |
1. Scholer HR, Balling R, Hatzopoulos AK, et al. Octamer binding proteins confer transcriptional activity in early mouse embryogenesis. EMBO J 1989; 8 : 2551–7. 2. Okamoto K, Okazawa H, Okuda A, et al. A novel octamer binding transcription factor is differentially expressed in mouse embryonic cells. Cell 1990; 60 : 461–72. 3. Rosner MH, Vigano MA, Ozato K, et al. A POU-domain transcription factor in early stem cells and germ cells of the mammalian embryo. Nature 1990; 345 : 686–92. 4. Scholer HR, Dressler GR, Balling R, et al. Oct-4: a germline-specific transcription factor mapping to the mouse t-complex. EMBO J 1990; 9 : 2185–95. 5. err W, Sturm RA, Clerc RG, et al. The POU domain: a large conserved region in the mammalian pit-1, oct-1, oct-2, and Caenorhabditis elegans unc-86 gene products. Genes Dev 1988; 2 : 1513–6. 6. Scholer HR. Octamania: the POU factors in murine development. Trends Genet 1991; 7 : 323–9. 7. Jin VX, O’Geen H, Iyengar S, et al. Identification of an OCT4 and SRY regulatory module using integrated computational and experimental genomics approaches. Genome Res 2007; 17 : 807–17. 8. Brehm A, Ovitt CE, Scholer HR. Oct-4: more than just a POUerful marker of the mammalian germline ? APMIS 1998; 106 : 114–26. 9. Herr W, Cleary MA. The POU domain: versatility in transcriptional regulation by a flexible two-in-one DNA-binding domain. Genes Dev 1995; 9 : 1679–93. 10. Mathur D, Danford TW, Boyer LA, et al. Analysis of the mouse embryonic stem cell regulatory networks obtained by ChIP-chip and ChIP-PET. Genome Biol 2008; 9 : R126. 11. Lee J, Kim HK, Rho JY, Han YM, Kim J. The human OCT-4 isoforms differ in their ability to confer self-renewal. J Biol Chem 2006; 281 : 33554–65. 12. Cauffman G, Liebaers I, Van Steirteghem A, Van de Velde H. POU5F1 isoforms show different expression patterns in human embryonic stem cells and preimplantation embryos. Stem Cells 2006; 24 : 2685–91. 13. Wang X, Zhao Y, Xiao Z, et al. Alternative translation of OCT4 by an internal ribosome entry site and its novel function in stress response. Stem Cells 2009; 27 : 1265–75. 14. Palmieri SL, Peter W, Hess H, Scholer HR. Oct-4 transcription factor is differentially expressed in the mouse embryo during establishment of the first two extraembryonic cell lineages involved in implantation. Dev Biol 1994; 166 : 259–67. 15. Downs KM. Systematic localization of Oct-3/4 to the gastrulating mouse conceptus suggests manifold roles in mammalian development. Dev Dyn 2008; 237 : 464–75. 16. Pesce M, Wang X, Wolgemuth DJ, Scholer H. Differential expression of the Oct-4 transcription factor during mouse germ cell differentiation. Mech Dev 1998; 71 : 89–98. 17. Cauffman G, Van de Velde H, Liebaers I, Van Steirteghem A. Oct-4 mRNA and protein expression during human preimplantation development. Mol Hum Reprod 2005; 11 : 173–81. 18. Atlasi Y, Mowla SJ, Ziaee SA, et al. OCT4 spliced variants are differentially expressed in human pluripotent and nonpluripotent cells. Stem Cells 2008; 26 : 3068–74. 19. Reubinoff BE, Pera MF, Fong CY, et al. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotechnol 2000; 18 : 399–404. 20. Pera MF, Cooper S, Mills J, Parrington JM. Isolation and characterization of a multipotent clone of human embryonal carcinoma cells. Differentiation 1989; 42 : 10–23. 21. Scholer HR, Hatzopoulos AK, Balling R, et al. A family of octamer-specific proteins present during mouse embryogenesis: evidence for germline-specific expression of an Oct factor. EMBO J 1989; 8 : 2543–50. 22. Yeom YI, Fuhrmann G, Ovitt CE, et al. Germline regulatory element of Oct-4 specific for the totipotent cycle of embryonal cells. Development 1996; 122 : 881–94. 23. Nichols J, Zevnik B, Anastassiadis K, et al. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4. Cell 1998; 95 : 379–91. 24. Cole MF, Johnstone SE, Newman JJ, et al. Tcf3 is an integral component of the core regulatory circuitry of embryonic stem cells. Genes Dev 2008; 22 : 746–55. 25. Boyer LA, Lee TI, Cole MF, et al. Core transcriptional regulatory circuitry in human embryonic stem cells. Cell 2005; 122 : 947–56. 26. Creyghton MP, Markoulaki S, Levine SS, et al. H2AZ is enriched at polycomb complex target genes in ES cells and is necessary for lineage commitment. Cell 2008; 135 : 649–61. 27. Squazzo SL, O’Geen H, Komashko VM, et al. Suz12 binds to silenced regions of the genome in a cell-type-specific manner. Genome Res 2006; 16 : 890–900. 28. Ku M, Koche RP, Rheinbay E, et al. Genomewide analysis of PRC1 and PRC2 occupancy identifies two classes of bivalent domains. PLoS Genet 2008; 4 : e1000242. 29. Maherali N, Sridharan R, Xie W, et al. Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution. Cell Stem Cell 2007; 1 : 55–70. 30. Wernig M, Meissner A, Foreman R, et al.
In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature 2007; 448 : 318–24. 31. Okamoto I, Otte AP, Allis CD, et al. Epigenetic dynamics of imprinted X inactivation during early mouse development. Science 2004; 303 : 644–9. 32. Donohoe ME, Silva SS, Pinter SF, et al. The pluripotency factor Oct4 interacts with Ctcf and also controls X-chromosome pairing and counting. Nature 2009; 460 : 128–32. 33. Niwa H, Miyazaki J, Smith AG. Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat Genet 2000; 24 : 372–6. 34. Reim G, Mizoguchi T, Stainier DY, et al. The POU domain protein spg (pou2/Oct4) is essential for endoderm formation in cooperation with the HMG domain protein casanova. Dev Cell 2004; 6 : 91–101. 35. Shimozaki K, Nakashima K, Niwa H, Taga T. Involvement of Oct3/4 in the enhancement of neuronal differentiation of ES cells in neurogenesis-inducing cultures. Development 2003; 130 : 2505–12. 36. Camara-Clayette V, Le Pesteur F, Vainchenker W, Sainteny F. Quantitative Oct4 overproduction in mouse embryonic stem cells results in prolonged mesoderm commitment during hematopoietic differentiation in vitro. Stem Cells 2006; 24 : 1937–45. 37. Zeineddine D, Papadimou E, Chebli K, et al. Oct-3/4 dose dependently regulates specification of embryonic stem cells toward a cardiac lineage and early heart development. Dev Cell 2006; 11 : 535–46. 38. Loebel DA, Watson CM, De Young RA, Tam PP. Lineage choice and differentiation in mouse embryos and embryonic stem cells. Dev Biol 2003; 264 : 1–14. 39. Tomescot A, Leschik J, Bellamy V, et al. Differentiation in vivo of cardiac committed human embryonic stem cells in postmyocardial infarcted rats. Stem Cells 2007; 25 : 2200–05. 40. Tam PPL, Schoenwolf G. Cardiac fate map: lineage, allocation, morphogenetic movement and cell commitment. In : Harvey RP, Rosenthal N, eds. Heart Development. New York: Saunders, 1999 : 3–18. 41. Stefanovic S, Abboud N, Desilets S, et al. Interplay of Oct4 with Sox2 and Sox17: a molecular switch from stem cell pluripotency to specifying a cardiac fate. J Cell Biol 2009; 186 : 665–73. 42. Daheron L, Opitz SL, Zaehres H, et al. LIF/STAT3 signaling fails to maintain self-renewal of human embryonic stem cells. Stem Cells 2004; 22 : 770–8. 43. Stefanovic S, Pucéat M. Oct-3/4: not just a gatekeeper of pluripotency for embryonic stem cell, a cell fate instructor through a gene dosage effect. Cell Cycle 2007; 6 : 8–10. 44. Place RF, Li LC, Pookot D, et al. MicroRNA-373 induces expression of genes with complementary promoter sequences. Proc Natl Acad Sci USA 2008; 105 : 1608–13. 45. Liu Y, Asakura M, Inoue H, et al. Sox17 is essential for the specification of cardiac mesoderm in embryonic stem cells. Proc Natl Acad Sci USA 2007; 104 : 3859–64. 46. Pu WT, Ishiwata T, Juraszek AL, et al. GATA4 is a dosage-sensitive regulator of cardiac morphogenesis. Dev Biol 2004; 275 : 235–44. 47. Mori AD, Zhu Y, Vahora I, et al. Tbx5-dependent rheostatic control of cardiac gene expression and morphogenesis. Dev Biol 2006; 297 : 566–86. 48. Jing H, Vakoc CR, Ying L, et al. Exchange of GATA factors mediates transitions in looped chromatin organization at a developmentally regulated gene locus. Mol Cell 2008; 29 : 232–42. 49. Ray S, Dutta D, Rumi MA, et al. Context-dependent function of regulatory elements and a switch in chromatin occupancy between GATA3 and GATA2 regulate Gata2 transcription during trophoblast differentiation. J Biol Chem 2009; 284 : 4978–88. 50. Navarro P. X inactivation : a direct link with the pluripotent state. Med Sci (Paris) 2009; 25 : 888–90. |