| |
| Med Sci (Paris). 2010 May; 26(5): 449–452. Published online 2010 May 15. doi: 10.1051/medsci/2010265449.Syndrome gastro-intestinal radio-induit : à qui la faute ? Agnès François* and Fabien Milliat Institut de radioprotection et de sûreté nucléaire, 31, avenue de la Division Leclerc, 92260 Fontenay-aux-Roses, France MeSH keywords: Syndrome d'irradiation aigüe, anatomopathologie, Animaux, Apoptose, effets des radiations, Mort cellulaire, ADN, Altération de l'ADN, Cellules endothéliales, Cellules épithéliales, Muqueuse gastrique |
Les travaux récemment publiés dans Science par David G. Kirsch et al. [
1] abordent un des sujets brûlants et toujours controversés à la base des études de radiopathologie : qui est responsable du syndrome gastro-intestinal (SGI) et donc de l’initiation des dommages subis par les tissus digestifs lorsqu’ils sont exposés aux rayonnements ionisants ? Les radiobiologistes ont cru répondre à cette question dès la fin des années 1960 avec le concept de la cellule cible. Ce concept considère la cellule souche épithéliale comme responsable, par sa survie ou sa mort, de la survie ou de la mort du tissu irradié [
2]. Cependant, le développement des outils génétiques et moléculaires ainsi que le perfectionnement des méthodes d’analyse ont permis, il y a moins de 10 ans, de remettre en cause ce concept, ou au moins de forcer la recherche à se pencher à nouveau sur cette question déterminante [
3]. |
Inculpation du suspect numéro 1 : la cellule épithéliale La production continue de cellules par les cellules souches et les progéniteurs à vie longue localisés à la base des cryptes intestinales assure le renouvellement constant de l’épithélium. Les cellules filles migrent et se différencient le long de l’axe crypte/villosité puis sont éliminées au sommet des villosités. Dans le tissu adulte, la production cellulaire s’équilibre parfaitement avec la perte naturelle des cellules en fin de vie [
12]. Les rayonnements bouleversent cet équilibre en créant des dommages à l’ADN suffisamment sévères pour entraîner la mort des cellules. Ainsi, la sévérité des dommages au tissu digestif est, selon le concept de la cellule cible, directement liée à la quantité de cellules souches perdues, et surtout au nombre de cellules survivantes qui auront pour rôle de régénérer le tissu irradié [
13]. Pour des doses suffisamment fortes, la stérilisation quasi complète du compartiment souche intestinal entraîne la mort de l’individu par SGI (voir Encadré). Plusieurs stratégies visant à stimuler la capacité de production cellulaire ou à protéger le compartiment épithélial souche de l’intestin peuvent être efficaces mais ne protègent jamais totalement contre le SGI suggérant que la cellule épithéliale n’est pas la seule impliquée. |
Réouverture du procès en 2001 : mise en examen de la cellule endothéliale L’équipe de Richard Kolesnik a jeté un pavé dans la mare en 2001 [3]. Ces travaux, publiés dans Science, mettent en évidence que l’endothélium des microvaisseaux de la muqueuse intestinale est la cible des rayonnements, et que les perturbations observées au niveau des cellules souches épithéliales sont la conséquence de l’atteinte des cellules endothéliales (CE) microvasculaires. L’apoptose radio-induite des CE est dépendante de la formation de céramides générés par la sphingomyélinase acide (acid sphingomyelinase, ASMase). La mort des CE est totalement inhibée chez les souris asmase−/−
, ce qui permet de démontrer qu’en l’absence d’apoptose endothéliale, les animaux sont protégés du SGI. Selon cette équipe il existe, certes, des dommages radio-induits de manière directe dans les cellules souches intestinales mais leurs conséquences, lésions fonctionnelles ou arrêt mitotique, dépendraient des dommages aux CE. Un élégant travail publié dans Proc Natl Acad Sci USA en 2004 confirme l’importance de la mort des CE dans l’initiation du SGI. L’administration d’un variant stable de l’angiopoïétine-1, facteur de survie des CE, protège les souris du SGI [
4]. Bien évidemment les choses ne sont pas si simples. Alors que certains travaux remettent même en cause la réalité de la mort radio-induite de l’endothélium [
5], d’autres études démontrent que lorsque les cellules épithéliales - mais pas les cellules endothéliales - sont protégées de la mort, on arrive également à protéger les animaux du SGI [
6,
7]. |
Mettons les choses au point : qui meurt, et quand ? L’irradiation du tissu digestif entraîne une première vague de mort cellulaire précoce, observée 4 heures après irradiation, qui touche à la fois l’endothélium, via la voie des céramides, et l’épithélium, via p53 (Figure 1). Les gènes transactivés par p53 permettent l’arrêt du cycle cellulaire et le déclenchement du processus apoptotique (via Bax par exemple) ou le choix d’une voie de survie en engageant les mécanismes de réparation de l’ADN (via p21WAF-1/CIP1
) [
8]. Une seconde vague de mort, la mort mitotique, survient 24 à 40 heures après irradiation et touche les premières cellules filles issues de la reprise des mitoses des cellules épithéliales lésées et mal réparées [
9]. Ainsi, chez les souris génétiquement déficientes en p53, la prolifération continue des cellules épithéliales les expose rapidement à la mort mitotique, et les souris sont plus sensibles au SGI [8]. On sait depuis plusieurs années que la sévérité des pertes cellulaires conditionne la capacité de l’épithélium à se régénérer et dépend autant de la mort mitotique que du taux d’apoptose précoce. Ceci justifie le fait de suivre systématiquement le nombre de cryptes survivantes, 3,5 jours après irradiation, comme marqueur de la capacité de régénération de l’épithélium. 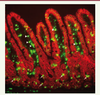 | Figure 1.
Mort cellulaire radio-induite dans l’intestin grêle de souris. Photo prise 4 heures après une irradiation à 19 Gy : co-marquage immunofluorescent de la structure de l’épithélium (E-cadhérine, composant de la membrane des cellules épithéliales, en rouge) et des cellules apoptotiques (marquage TUNEL, pour terminal deoxynucleotidyl transferase dUTP nick end labelling, en vert). On remarque de l’apoptose au niveau des cryptes (flèches) et au niveau du réseau microvasculaire des villosités (pointes de flèches). Observation x 200 (© Photo Rym Abderrahmani, avec permission). |
|
Que nous apportent les travaux de D. Kirsch et al. ? Pour identifier le compartiment cellulaire cible (endothélium et/ou épithélium) et déterminer le type de mort impliqué dans le SGI, Kirsch et al. ont utilisé des modèles de souris KO (knocked out, invalidées pour l’expression d’un gène) combinés à des modèles de souris transgéniques obtenues par la technologie Cre-loxP qui permet l’inactivation d’un gène spécifiquement dans un tissu. Ce type de transgenèse basé sur la recombinaison homologue permet d’inactiver in vivo un gène cible dans un compartiment cellulaire donné. Ainsi, par le croisement de souris exprimant la recombinase Cre sous le contrôle du promoteur villine (spécifique de l’épithélium) ou du promoteur Tie2 (récepteur de l’angiopoïétine, exprimé sélectivement par les cellules hématopoïétiques et endothéliales) avec des souris floxées1 pour Bax ou p53, les auteurs ont étudié les conséquences sur le SGI de nombreuses combinaisons d’inactivation de gènes impliqués dans la mort cellulaire, spécifiquement dans un tissu ou globalement dans l’organisme entier. En premier lieu, Kirsch et al montrent que les souris invalidées dans tous leurs tissus pour Bak ou Bax
2 ne sont pas protégées du SGI, ce qui contredit les travaux de Rotolo et al. [
10]. Mais il y a une possible explication à cette discordance. À des doses d’irradiation entraînant le SGI, le syndrome hématopoïétique (voir Encadré) joue un rôle important dans la mort des animaux puisqu’une pancytopénie induite par l’irradiation peut favoriser la mort par SGI [
11]. La seule façon de s’affranchir du syndrome hématopoïétique est d’effectuer une greffe de moelle osseuse. Dans les travaux de Rotolo, tous les animaux sont greffés, et l’amélioration de la survie observée chez les souris Bax−/−
et Bak−/−
peut donc être de manière certaine attribuée à une protection vis-à-vis du SGI. Rotolo et al. ont également observé une hypersensibilité des animaux Bax−/−
au syndrome hématopoïétique. Dans les travaux de Kirsch, une éventuelle protection contre le SGI peut donc être masquée par les lésions sévères au système hématopoïétique. Démontrer que des animaux sont protégés ou non du SGI exige d’être sûr des causes de la mort dans le modèle d’irradiation utilisé (syndrome hématopoïétique ou SGI). Dans les travaux de Kirsch et al., en l’absence de suivi des paramètres sanguins et d’autopsies systématiques, rien ne prouve que les animaux meurent d’un SGI pur et que les cellules n’ont pas été protégées de la mort par l’invalidation de Bak ou Bax. Dans une autre série de travaux, cette équipe a utilisé des souris Bak−/−
qui ont en plus été invalidées ou non pour Bax dans les cellules soit endothéliales (cre-tie2) soit épithéliales (cre-villine). L’invalidation de Bax réduit l’apoptose des CE et des cellules épithéliales sans protéger les souris du SGI, ce qui permet aux auteurs de conclure que le SGI ne dépend pas de l’apoptose précoce de ces deux compartiments. Mais ce modèle de « fond génétique Bak−/− » n’est peut-être pas approprié, car on sait que ces souris ont un taux d’apoptose endothéliale très réduit et sont protégées du SGI [3, 7, 10]. Il est donc difficile de déceler une éventuelle protection supplémentaire vis-à-vis du SGI que conférerait l’invalidation de Bax dans les CE ou les cellules épithéliales. Malheureusement, ces études ne comportent pas l’analyse de souris contrôles sauvages exprimant à la fois Bak et Bax, ni de souris invalidées pour Bax ou Bak seulement dans les compartiments cibles, ce qui aurait pu donner des réponses plus probantes. Enfin, le rôle de p53 dans la mort par SGI a également été exploré. Lorsque p53 est invalidé spécifiquement dans les cellules épithéliales, le SGI est plus sévère, rejoignant des observations antérieures faites sur des souris KO pour p53 [8]. Lorsque les deux gènes Bax et p53 sont invalidés, les souris restent sensibles au SGI. Ces données confirment que la mort mitotique des cellules épithéliales, qui est indépendante de p53, joue un rôle clé dans le développement du SGI [9]. L’apoptose radio-induite des CE est indépendante de p53, ce que confirme l’absence de modification de la survie des souris dont le gène p53 est invalidé dans les CE. Enfin, les souris surexprimant p53, ce qui a pour conséquence un arrêt du cycle cellulaire, sont protégées du SGI, confirmant l’importance de la quiescence cellulaire pour permettre la réparation des dommages à l’ADN radio-induits
 . . |
Ce travail confirme par une approche méthodologique puissante certains concepts déjà décrits dans la littérature mais, malheureusement, n’apporte pas beaucoup d’eau au moulin de la controverse. L’absence de caractérisation précise du modèle d’irradiation et de ses conséquences spécifiques dans les systèmes hématopoïétique et digestif n’apporte malheureusement pas d’éléments de réponse probants. L’interprétation des résultats quant à une protection ou une sensibilisation envers le SGI doit résulter d’une évaluation multiparamétrique, associant (1) des courbes de survie analysées par la méthode de Kaplan-Meier ; (2) l’identification des causes de la mort par un examen d’autopsie ; (3) le suivi des paramètres sanguins ; (4) la quantification des cryptes survivantes à 3,5 jours. Enfin, les courbes de survie doivent être établies pour chaque souche de souris utilisée, avec une indication précise du moment et des causes de la mort. L’identification du (ou des) compartiments cibles, des mécanismes de mort associés et des acteurs moléculaires clés impliqués dans le SGI devrait permettre dans le futur de mettre en place des stratégies thérapeutiques efficaces et ciblées. L’approche méthodologique de Kirch et al. ouvre de nouvelles perspectives, et l’utilisation de souris exprimant la recombinase Cre sous le contrôle de promoteurs spécifiques de tissus ou de cellules, voire inductibles, devrait permettre de résoudre la controverse dans les années à venir. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient toute l’équipe du Laboratoire de radiopathologie et thérapie expérimentale (LRTE) de l’Institut de radioprotection et de sûreté nucléaire (IRSN), Marie-Hélène Gaugler (LRTE) et François Paris de l’Inserm UMR U892, ainsi que Jean-Marc Bertho du Laboratoire de radiotoxicologie (IRSN) pour leur discussion fructueuse, et Rym Abderrahmani (LRTE) qui nous a gentiment permis d’utiliser l’une des photos issues de ses travaux de thèse.
|
Footnotes |
1. Kirsch DG, Santiago PM, di Tomaso E, et al. p53 controls radiation-induced gastrointestinal syndrome in mice independent of apoptosis. Science 2010; 327 : 593–6. 2. Withers, HR, Elkind MM. Microcolony survival assay for cells of mouse intestinal mucosa exposed to radiation. Int J Radiat Biol Relat Stud Phys Chem Med 1970; 17 : 261–7. 3. Paris F, Fuks Z, Kang A, et al. Endothelial apoptosis as the primary lesion initiating intestinal radiation damage in mice. Science 2001; 293 : 293–7. 4. Cho CH, Kammerer RA, Lee HJ, et al. Designed angiopoietin-1 variant, COMP-Ang1, protects against radiation-induced endothelial cell apoptosis. Proc Natl Acad Sci USA 2004; 101 : 5553–8. 5. Schuller BW, Binns PJ, Riley KJ, et al. Selective irradiation of the vascular endothelium has no effect on the survival of murine intestinal crypt stem cells. Proc Natl Acad Sci USA 2006; 103 : 3787–92. 6. Bhanja P, Saha S, Kabarriti R, et al. Protective role of R-spondin1, an intestinal stem cell growth factor, against radiation-induced gastrointestinal syndrome in mice. PLoS One 2009; 4 : e8014. 7. Qiu W, Carson-Walter EB, Liu H, et al. PUMA regulates intestinal progenitor cell radiosensitivity and gastrointestinal syndrome. Cell Stem Cell 2008; 2 : 576–83. 8. Komarova EA, Kondratov RV, Wang K, et al., Dual effect of p53 on radiation sensitivity in vivo: p53 promotes hematopoietic injury, but protects from gastro-intestinal syndrome in mice. Oncogene 2004; 23 : 3265–71. 9. Merritt AJ, Allen TD, Potten CS, Hickman JA. Apoptosis in small intestinal epithelial from p53-null mice: evidence for a delayed, p53-independent G2/M-associated cell death after gamma-irradiation. Oncogene 1997; 14 : 2759–66. 10. Rotolo JA, Maj JG, Feldman R, et al. Bax and Bak do not exhibit functional redundancy in mediating radiation-induced endothelial apoptosis in the intestinal mucosa. Int J Radiat Oncol Biol Phys 2008; 70 : 804–15. 11. Terry NH, Travis EL. The influence of bone marrow depletion on intestinal radiation damage. Int J Radiat Oncol Biol Phys 1989; 17 : 569–73. 12. Joubert D, Hollande F, Jay P, Legraverend C. Les cellules souches intestinales : 30 ans d’une histoire exemplaire. Med Sci (Paris) 2009; 25 : 441–4. 13. François A, Milliat F, Jullien N, et al. Radiothérapie : quelles orientations thérapeutiques contre les séquelles digestives ? Med Sci (Paris) 2009; 25 : 267–72. |



 .
.