| |
| Med Sci (Paris). 2010 May; 26(5): 459–460. Published online 2010 May 15. doi: 10.1051/medsci/2010265459.Mécanisme d’activation de l’oncogène BRAF
L’union fait la force Hugo Lavoie and Marc Therrien* Institut de recherche en immunologie et en cancérologie, unité de recherche en signalisation intracellulaire, département de pathologie et biologie cellulaire, Université de Montréal, CP 6128, Succursale centre-ville, Montréal (Québec), H3C 3J7 Canada MeSH keywords: Régulation allostérique, Animaux, Dimérisation, Activation enzymatique, Extracellular Signal-Regulated MAP Kinases, physiologie, Humains, MAP Kinase Kinase Kinases, Mammifères, Protéines tumorales, composition chimique, génétique |
L’activation anormale de la protéine kinase BRAF ou de composantes de la voie ERK dont elle fait partie se manifeste dans une forte proportion de tumeurs cancéreuses humaines [
1]. BRAF elle-même est mutée dans 8 % des cancers avec des incidences élevées dans les mélanomes (70 %) et les tumeurs thyroïdiennes (33 %) [
2]. BRAF s’avère donc être une cible de choix dans les thérapies anticancéreuses comme en témoignent plusieurs essais cliniques en cours [1]. Dans sa forme la plus simple, la voie ERK comprend trois kinases, soit RAF, MEK et ERK/MAPK, qui transmettent par le biais de phosphorylations en cascade les signaux émis par la petite GTPase RAS. Cette dernière est elle-même activée par des récepteurs membranaires, le plus souvent des récepteurs à activité tyrosine kinase (RTK), en réponse à des signaux extracellulaires de prolifération, de différenciation ou de survie cellulaire [
3]. Le module RAF-MEK-ERK est l’un des mieux caractérisés dans le domaine de la signalisation intracellulaire. Cependant, plusieurs stades du mécanisme restent encore à élucider comme, par exemple, la séquence exacte des événements conduisant à l’activation catalytique de RAF. |
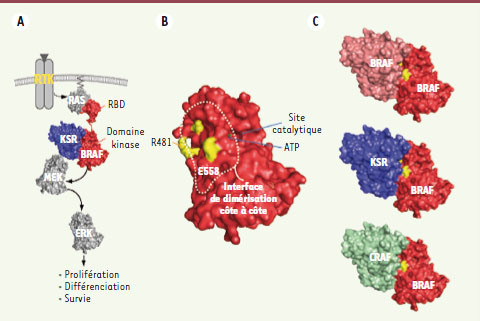
Complexité du mécanisme d’activation de RAF L’activation de RAF passe par plusieurs étapes. Certaines mettent en œuvre des régulations non covalentes qui modifient la localisation subcellulaire de RAF ou la conformation de sa structure tridimensionnelle, tandis que d’autres mettent en jeu des modifications post-traductionnelles, le plus fréquemment par phosphorylation. Telle qu’elle est comprise aujourd’hui, l’activation de RAF commence par son recrutement à la membrane plasmique via une interaction avec la petite GTPase RAS liée au GTP (Figure 1A). Cette fixation de RAS à un domaine de la portion amino-terminale de RAF, le Ras binding domain (RBD), provoque en particulier la déphosphorylation d’un résidu-clé situé en amino-terminal de son domaine kinase entraînant ainsi la libération d’un dimère de 14-3-3 qui autrement séquestre RAF dans le cytoplasme. Cette libération a pour effet d’exposer le cysteine-rich domain (CRD) adjacent au RBD et permet l’ancrage de RAF à la membrane. D’autre part, la liaison de RAF par RAS déstabilise une interaction inhibitrice entre la région amino-terminale de RAF et son domaine kinase, ce qui rend ce dernier réceptif aux prochaines étapes d’activation et, notamment, la phosphorylation de résidus situés immédiatement en amino-terminal du domaine kinase et dans sa boucle d’activation [
4] (Figure 1A). Hormis RAS et 14-3-3, d’autres protéines semblent participer au mécanisme d’activation de RAF [4]. C’est le cas de KSR (Kinase suppressor of Ras), une protéine apparentée à RAF par sa séquence et sa structure mais qui est catalytiquement inactive. Quoique cette protéine ait été initialement décrite comme une protéine d’échafaudage avec pour rôle de recruter le substrat MEK à son activateur RAF, plusieurs données expérimentales lui attribuent un rôle dans le mécanisme d’activation de RAF [
5,
6]. Nos travaux récents, qui font l’objet de la présente nouvelle, ont révélé le mécanisme par lequel KSR contribue à l’activation de RAF. De plus, ils dévoilent un aspect central du processus d’activation de RAF insoupçonné jusqu’ici.
 | Figure 1.
Activation de BRAF par la formation de dimères côte à côte. A. Modèle simplifié de l’activation de la voie ERK par les récepteurs RTK. L’interface de dimérisation côte à côte identifiée par notre équipe (B) est requise pour la formation d’homodimères de BRAF et suggère que des hétérodimères KSR-BRAF et CRAF-BRAF existent (C). Le résidu K481 est requis pour la formation d’homodimères BRAF-BRAF et le résidu E558 est muté en lysine dans certaines tumeurs cancéreuses. |
|
Dimérisation de RAF : une élégante hypothèse confirmée Les mutations oncogéniques mises à part, l’activation de RAF semble dépendre invariablement de RAS. Des expériences effectuées dans des cellules de drosophile en culture ont permis de déceler une exception à cette règle. En effet, il s’avère que la surexpression de KSR en présence de RAF et de MEK suffit pour activer RAF sans requérir une quelconque activité de RAS [6]. Ce résultat, d’abord mystérieux, a été élucidé par une étude de la structure du domaine kinase de BRAF qui recèle un indice capital de son mécanisme d’activation [
7]. En effet, l’analyse structurale de ce domaine suggère sa dimérisation où chaque monomère se présenterait côte à côte l’un par rapport à l’autre (Figure 1B et C) [6]. Cette hypothèse a été confirmée par des essais d’interaction in vitro utilisant des protéines recombinantes produites dans des bactéries [6]. Des mutations ciblant divers résidus-clés de l’interface non seulement perturbent la formation de dimères, mais, de plus, abolissent l’activité kinase de BRAF. Il semble donc que la dimérisation de RAF soit un élément-clé de son processus d’activation. Étant donné l’étroite homologie des séquences entre les domaines kinase de RAF et de KSR, nous avons posé l’hypothèse que l’activation de RAF par KSR résulterait de l’hétérodimérisation de leurs domaines kinase respectifs. Un modèle tridimensionnel d’un hétérodimère KSR/RAF hypothétique a donc été produit et utilisé pour prédire quels acides aminés de KSR entrent en contact avec RAF. De façon remarquable, la mutation de tous les résidus de KSR situés à l’interface de dimérisation de l’hétérodimère diminue fortement ou abolit la capacité de KSR à activer RAF. Enfin, cette propriété ne dépend ni d’une activité catalytique potentielle de KSR, ni de son rôle de pont entre RAF et MEK. Par ailleurs, ce travail a permis d’expliquer la nature d’une deuxième classe de mutations oncogéniques de BRAF qui ne se situent pas dans la boucle d’activation du domaine kinase, mais plutôt à l’interface de dimérisation du dimère [7]. En effet, l’analyse de l’une de ces mutations (E558K ; Figure 1B) a permis de démontrer qu’elle a la capacité d’augmenter la proportion de BRAF dimérique et, par le fait même, l’activité catalytique de ce mutant [6]. Considérant que les génomes de mammifères encodent trois isoformes de RAF et deux de KSR, on peut en déduire que divers hétérodimères de RAF dotés de différentes propriétés signalétiques coexistent potentiellement dans une cellule. L’observation d’hétérodimères BRAF/CRAF en est un exemple [7]. Bien que la conséquence structurale de cette dimérisation reste à découvrir, la transactivation entre monomères s’effectue indépendamment de leur activité catalytique intrinsèque, ce qui plaide en faveur d’un mode de régulation allostérique. |
Perspectives sur la signalisation modulée par allostérie La modification de l’activité d’une enzyme envers son substrat par la liaison d’une troisième molécule se nomme allostérie [
8]. Les affinités du régulateur lacR pour l’ADN ou de l’hémoglobine pour l’oxygène, respectivement modulées par le lactose et l’oxygène, sont des exemples classiques d’interactions modulées par allostérie [8]. Traditionnellement, l’allostérie était principalement considérée dans l’étude d’enzymes du métabolisme cellulaire. L’activation de RAF par dimérisation avec KSR rappelle bien ce phénomène moléculaire qui constituait, selon Jacques Monod, le « deuxième secret de la vie » après le code génétique. Récemment, des exemples de domaines kinase activés par dimérisation ont été découverts. En effet, l’activité kinase du récepteur à l’EGF (EGFR), de la protéine kinase PKR et de la kinase LKB1 est induite par des mécanismes d’allostérie par dimérisation [
9–
11]. L’allostérie semble donc jouer un rôle prédominant lors de la transmission de signaux intracellulaires et pourrait ouvrir la voie à diverses thérapies ciblées. Comme BRAF est très fréquemment activé dans des tumeurs de diverses origines et que même l’activité du variant V600E dépend de la dimérisation de son domaine kinase [6], la découverte de composés chimiques bloquant la dimérisation de BRAF devrait contribuer à la mise au point de nouvelles thérapies anticancéreuses hautement efficaces. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Montagut C, Settleman J. Targeting the RAF-MEK-ERK pathway in cancer therapy. Cancer Lett 2009; 283 : 125–34. 2. Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417 : 949–54. 3. Ashton-Beaucage D, Therrien M. La signalisation RTK/RAS/ERK élargie : contributions de la génétique à l’assemblage d’un réseau de signalisation. Med Sci (Paris) 2010; 26 (sous presse). 4. Claperon A, Therrien M. KSR and CNK: two scaffolds regulating RAS-mediated RAF activation. Oncogene 2007; 26 : 3143–58. 5. Roy F, Laberge G, Douziech M, et al. KSR is a scaffold required for activation of the ERK/MAPK module. Genes Dev 2002; 16 : 427–38. 6. Rajakulendran T, Sahmi M, Lefrancois M, et al. A dimerization-dependent mechanism drives RAF catalytic activation. Nature 2009; 461 : 542–5. 7. Wan PT, Garnett MJ, Roe SM, et al. Mechanism of activation of the RAF-ERK signaling pathway by oncogenic mutations of B-RAF. Cell 2004; 116 : 855–67. 8. Fenton AW. Allostery: an illustrated definition for the second secret of life. Trends Biochem Sci 2008; 33 : 420–5. 9. Dar AC, Dever TE, Sicheri F. Higher-order substrate recognition of eIF2alpha by the RNA-dependent protein kinase PKR. Cell 2005; 122 : 887–900. 10. Zhang X, Gureasko J, Shen K, et al. An allosteric mechanism for activation of the kinase domain of epidermal growth factor receptor. Cell 2006; 125 : 1137–49. 11. Zeqiraj E, Filippi BM, Deak M, et al. Structure of the LKB1-STRAD-MO25 complex reveals an allosteric mechanism of kinase activation. Science 2009; 326 : 1707–11. |