| |
| Med Sci (Paris). 2010 May; 26(5): 461–463. Published online 2010 May 15. doi: 10.1051/medsci/2010265461.Se protéger du SIDA ? L’exemple des singes d’Afrique Béatrice Jacquelin,* Olivier Rescanière,* Anne-Sophie Liovat, Gaël Petitjean, Françoise Barré-Sinoussi, and Michaela Müller-Trutwin Unité de régulation des infections rétrovirales, département de virologie, Institut Pasteur, 25-28 rue du Docteur Roux, 75724 Paris Cedex 15, France MeSH keywords: Syndrome d'immunodéficience acquise, immunologie, prévention et contrôle, Animaux, Lymphocytes T CD4+, Cercopithecus aethiops, physiologie, virologie, Cytokines, Modèles animaux de maladie humaine, Évolution de la maladie, Régulation de l'expression des gènes |
Depuis la découverte du VIH (virus de l’immunodéficience humaine) en 1983, le développement d’un vaccin pour enrayer l’épidémie mondiale de SIDA (syndrome d’immunodéficience acquise) constitue un des enjeux principaux de la recherche sur ce virus. Malheureusement, en dépit d’efforts internationaux soutenus, aucune solution vaccinale n’a abouti jusqu’à présent. Le VIH confronte les scientifiques à des problèmes singuliers qu’ils ne pourront surmonter sans une meilleure compréhension des interactions virus-hôte aboutissant au SIDA. En particulier, la détermination de corrélats de protection, c’est-à-dire quelles réponses immunitaires peuvent être protectrices et comment les induire, demeure une étape indispensable. Pour avancer dans ce domaine, il existe plusieurs modèles dont celui des singes d’Afrique, hôtes naturels des virus de l’immunodéficience simienne (SIV, simian immunodeficiency virus) qui sont à l’origine des VIH. Contrairement à l’infection par le VIH chez l’homme, l’infection par le SIV chez les hôtes naturels se solde rarement par le développement d’un SIDA. Pourquoi ? La réponse à cette question pourrait recéler certaines des clés pour comprendre comment protéger l’homme de la pathogenèse du VIH1. |
Le modèle non pathogène des singes d’Afrique On dénombre en Afrique jusqu’à 40 espèces de primates naturellement infectés par des SIV [
1]. Les plus communément étudiés sont les singes verts d’Afrique (AGM) infectés par le SIVagm, et les mangabeys enfumés (SM)2 infectés par le SIVsm pour lesquels la séroprévalence du SIV, in natura, excède les 50 % chez l’adulte. En revanche, aucun singe asiatique (tel que le macaque) ne présente d’infection naturelle SIV. Ils sont néanmoins sensibles à l’infection par des SIV et développent un SIDA, de façon similaire à l’homme infecté par le VIH. Les macaques sont donc utilisés comme modèles pathogènes de l’infection par le SIV. La protection observée chez les hôtes naturels n’est pas due à une pathogénicité atténuée du virus, puisque des macaques infectés par du SIVsm développent un SIDA [
2]. Elle n’est pas non plus le fait d’une réponse immunitaire adaptative plus intense ou plus efficace. Au contraire, les réponses cellulaires et humorales des hôtes naturels tendent à être relativement faibles en comparaison de celles observées chez l’humain ou le macaque [2,
3]. De même que lors des infections pathogènes par le VIH ou le SIVmac3,, les cellules CD4+, notamment les lymphocytes T CD4+ activés, sont les cibles des SIV chez les hôtes naturels. Dans les deux types d’infection, on assiste au cours de la phase aiguë à une déplétion majeure de ces cellules au niveau du sang périphérique et de l’intestin [2,
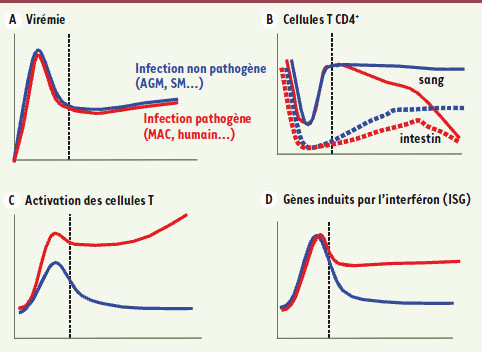
4]. En revanche, en phase chronique les modèles pathogènes et non pathogènes se démarquent (Figure 1B). Au cours de l’infection par le VIH chez l’homme ou par le SIVmac chez le macaque, un déclin progressif des cellules T CD4+ est observé dans tous les compartiments. Au contraire, les hôtes naturels infectés par le SIV recouvrent un taux presque normal de lymphocytes T CD4+ circulants, et jusqu’à 75 % au niveau de l’intestin, et ces taux restent constants tout au long de la phase chronique de l’infection en dépit d’une virémie élevée. En effet, au cours des infections non pathogènes, on mesure une virémie comparable à celle qui est observée dans les infections pathogènes, aussi bien dans le sang que dans l’intestin qui est le site majeur de la réplication virale des VIH et SIV (Figure 1A) [2]. Cette caractéristique a contraint à un changement de paradigme dans le modèle classiquement admis de la pathogenèse du VIH, une charge virale élevée n’étant plus le déterminant unique de la progression vers le SIDA. Dès lors, comment la protection contre le SIDA chez les singes d’Afrique peut-elle s’exercer en dehors d’un contrôle de la réplication virale ?
 | Figure 1.
Principales caractéristiques des infections par le SIV chez les hôtes naturels (AGM, SM) et des infections pathogènes par le VIH-1 chez l’Homme ou le SIVmac chez le macaque (MAC). A. Tout au long des deux types d’infection, la charge virale plasmatique est similaire. La protection chez les hôtes naturels n’est donc pas le résultat d’un contrôle de la réplication virale. B. Dans les deux modèles d’infection, on observe, en phase aiguë, une déplétion majeure des lymphocytes T CD4+ dans le sang et dans l’intestin, suivie d’une augmentation progressive en fin de primo-infection. En phase chronique, chez l’homme et le macaque, le taux de CD4+ décline progressivement dans tous les compartiments, en revanche chez les hôtes naturels, ces taux restent constants. C. Dans les infections non pathogènes, l’activation des cellules T retrouve un niveau normal en phase chronique alors qu’elle s’emballe progressivement dans les infections pathogènes. D. L’expression des gènes induits par l’interféron est transitoire au cours de l’infection SIV des hôtes naturels, ce qui démontre l’existence d’un mécanisme actif de régulation de l’activation immunitaire. |
De toutes les particularités des modèles non pathogènes de l’infection par le SIV, la plus frappante est sans doute la capacité des hôtes naturels à maintenir une activation immunitaire normale tout au long de la phase chronique de l’infection [2, 4]. Partant de ce constat, de nombreuses recherches ont exploré, au cours des dernières années, le rôle dans le développement du SIDA de l’activation chronique et généralisée du système immunitaire observée dans les infections par le VIH ou par le SIVmac [
5]. Aujourd’hui, une activation immunitaire mal contrôlée est considérée comme le meilleur marqueur prédictif de la progression vers le SIDA et représente probablement le paramètre déterminant de la disparition au long cours des cellules CD4+. En l’absence d’une telle activation immunitaire chronique, les singes d’Afrique sont protégés de ses effets délétères. Il n’est pas exclu qu’une évolution ancestrale commune ait permis aux singes africains et à leurs SIV de trouver un équilibre parfait, ne déclenchant pas de réaction immune délètère et permettant la survie de l’hôte malgré une forte dissémination du virus. |
La régulation de l’activation immunitaire au cœur de la protection contre le SIDA Deux hypothèses peuvent expliquer l’absence d’activation immunitaire généralisée chez l’AGM et le SM. Ou leur système immunitaire « ignore » la présence du virus, ou il la reconnaît, mais l’activation immunitaire qu’il déclenche est alors efficacement contrôlée. Les résultats scientifiques publiés récemment plaident en faveur de cette seconde option. Le système immunitaire des hôtes naturels n’est pas indifférent aux SIV : dans les semaines qui suivent l’infection par le SIVagm chez l’AGM, une élévation de l’activation des cellules T est bien mesurée, mais elle est transitoire et retourne à un niveau basal à la fin de la phase aiguë (Figure 1C) [
6]. L’activation des cellules T est généralement déclenchée et régulée par l’immunité innée, notre première ligne de défense contre les agents infectieux. Dès les premières heures qui suivent une agression pathogène, les cellules de l’immunité innée s’activent et libèrent des cytokines. En particulier, l’interféron alpha (IFN-α) qui peut moduler les réponses innées et adaptatives, est une des premières cytokines produites par les cellules dendritiques plasmacytoïdes lors d’infections virales. Dans les infections pathogènes par le VIH ou le SIVmac, les quantités de ces cytokines - TNF (tumor necrosis factor)-α, IL(interleukine)-6, IL-12, IL-15, IL-18, IFN-α, etc. - sont bien plus importantes que lors d’autres infections chroniques telles que les hépatites B ou C [
7]. Au contraire, chez l’AGM infecté par le SIVagm, la production de ces cytokines est globalement modérée [6]. Toutefois, une augmentation significative d’IFN-α est observée dans les premières semaines de l’infection [
8,
9]. L’activité biologique des interférons se traduit par l’induction de l’expression de gènes appelés ISG pour IFN stimulated genes. Nous avons récemment montré que les ISG sont fortement induits et de manière identique pendant la phase aiguë de l’infection SIV chez l’AGM et chez le macaque (Figure 1D) [9]. Mais, alors que l’expression de ces gènes reste élevée dans les cellules du sang et des ganglions lymphatiques chez le macaque, elle décroît jusqu’à son niveau basal chez l’AGM dès la fin de la phase aiguë (4 semaines post-infection). Nos travaux apportent ainsi la preuve qu’un mécanisme actif qui agit sur l’immunité innée, contrôle l’activation immunitaire chez l’AGM. Une équipe américaine ayant obtenu un résultat similaire chez le SM [
10], ce mécanisme semble commun à toutes les espèces de singe naturellement protégées. Il faut désormais déterminer quels en sont les rouages. Chez les singes d’Afrique infectés par le SIV, s’il existe une réaction inflammatoire à la phase aiguë de l’infection, elle est transitoire, témoignant d’une réponse immunitaire bien orchestrée semblable à celle qui se développe normalement dans les infections résolutives (Figure 2). À l’opposé, se pourrait-il que, chez l’Homme, l’inflammation exagérée observée lors de l’infection par le VIH inhibe l’induction d’un mécanisme de contrôle de l’activation immunitaire, interdisant tout retour en arrière ? Il existe un faible nombre de patients qui, comme les hôtes simiens naturels, présentent une virémie élevée associée à une activation immunitaire chronique faible et qui ne progressent pas vers le SIDA [
11]. Leur existence laisse supposer qu’un mécanisme de contrôle identique à celui qui prévaut chez les hôtes naturels existe chez l’homme. Trouver comment induire ce mécanisme est donc essentiel pour espérer développer de nouvelles stratégies thérapeutiques et vaccinales visant à contrôler l’activation immunitaire [4] qui persiste même chez les patients dont la virémie est contrôlée naturellement ou sous traitement antirétroviral [
12].
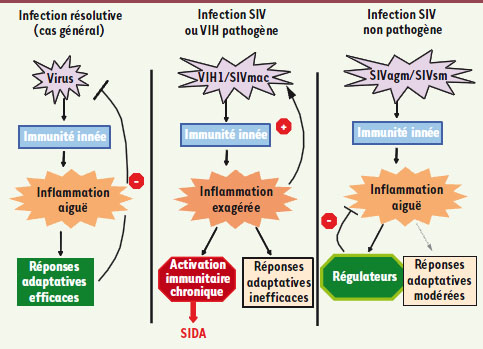
 | Figure 2.
Modèle expliquant les différences entre une infection virale résolutive (contrôlée), l’infection pathogène VIH-1/SIVmac, et l’infection non pathogène SIVagm/SIVsm chez les hôtes naturels. Lors d’une infection virale classique, le virus est détecté par le système immunitaire inné qui, par l’induction d’une réponse inflammatoire, va déclencher des réponses adaptatives. Celles-ci sont capables d’éliminer ou de contrôler le virus. Dans le contexte d’une infection pathogène VIH-1/SIVmac, l’inflammation induite est exagérée et conduirait à : (1) favoriser la multiplication virale ; (2) induire des réponses adaptatives inefficaces ; et (3) induire une activation chronique du système immunitaire à l’origine de la progression vers le SIDA. À l’opposé, dans le cadre d’une infection non pathogène chez l’hôte naturel, l’inflammation induite est plus modérée que dans le cas du VIH-1/SIVmac. Les régulateurs de l’immunité pourront contrôler cette inflammation empêchant l’activation immunitaire généralisée. Il y a donc moins de cellules cibles du virus. Les réponses adaptatives induites dans ce contexte ne sont que modérées. L’ensemble aboutit à un équilibre profitable à la fois au virus et l’hôte. |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Peeters M, Chaix ML, Delaporte E. Phylogénie des SIV et des VIH. Mieux comprendre l’origine des VIH. Med Sci (Paris) 2008; 24 : 621–8. 2. Liovat AS, Jacquelin B, Ploquin MJ, et al. African non human primates infected by SIV - why don’t they get sick ? Lessons from studies on the early phase of non-pathogenic SIV infection. Curr HIV Res 2009; 7 : 39–50. 3. Lozano Reina JM, Favre D, Kasakow Z, et al. Gag p27-specific B- and T-cell responses in Simian immunodeficiency virus SIVagm-infected African green monkeys. J Virol 2009; 83 : 2770–7. 4. Sodora DL, Allan JS, Apetrei C, et al. Toward an AIDS vaccine: lessons from natural simian immunodeficiency virus infections of African nonhuman primate hosts. Nat Med 2009; 15 : 861–5. 5. Giorgi JV, Hultin LE, McKeating JA, et al. Shorter survival in advanced human immunodeficiency virus type 1 infection is more closely associated with T lymphocyte activation than with plasma virus burden or virus chemokine coreceptor usage. J Infect Dis 1999; 179 : 859–70. 6. Kornfeld C, Ploquin MJ, Pandrea I, et al. Antiinflammatory profiles during primary SIV infection in African green monkeys are associated with protection against AIDS. J Clin Invest 2005; 115 : 1082–91. 7. Stacey AR, Norris PJ, Qin L, et al. Induction of a striking systemic cytokine cascade prior to peak viraemia in acute human immunodeficiency virus type 1 infection, in contrast to more modest and delayed responses in acute hepatitis B and C virus infections. J Virol 2009; 83 : 3719–33. 8. Diop OM, Ploquin MJ, Mortara L, et al. Plasmacytoid dendritic cell dynamics and alpha interferon production during Simian immunodeficiency virus infection with a nonpathogenic outcome. J Virol 2008; 82 : 5145–52. 9. Jacquelin B, Mayau V, Targat B, et al. Nonpathogenic SIV infection of African green monkeys induces a strong but rapidly controlled type I IFN response. J Clin Invest 2009; 119 : 3544–55. 10. Bosinger SE, Li Q, Gordon SN, et al. Global genomic analysis reveals rapid control of a robust innate response in SIV-infected sooty mangabeys. J Clin Invest 2009; 119 : 3556–72. 11. Choudhary SK, Vrisekoop N, Jansen CA, et al. Low immune activation despite high levels of pathogenic human immunodeficiency virus type 1 results in long-term asymptomatic disease. J Virol 2007; 81 : 8838–42. 12. Martinez V, Autran B. Les HIV controllers : une nouvelle entité évolutive de l’infection par le VIH ? Med Sci (Paris) 2008; 24 : 7–9. |